EZH1/2抑制剂UNC1999对外周血免疫细胞表型的影响
2021-08-04刘丹平池沛冬梅美华黄俊琪
刘丹平,池沛冬,梅美华,游 莹,黄俊琪
(1.中山大学附属第一医院器官移植科∕∕广东省器官捐献与移植免疫重点实验室∕∕广东省器官移植国际科技合作基地,广东广州 510080;2.中山大学肿瘤防治中心检验科,广东广州 510060)
Zeste 增强子同源物1(enhancer Zeste of homo‐log 1,EZH1)和Zeste增强子同源物2(enhancer Zeste of homolog 2,EZH2)是多梳蛋白抑制复合物2(polycomb repressive complex 2,PRC2)的两个功能亚基,可以催化组蛋白3赖氨酸27位点(H3K27)甲基化至其三甲基化形式(H3K27me3),诱导转录阻断和基因沉默;EZH1 还可通过与参与RNA 聚合酶介导的转录起始和∕或延伸的因子的赖氨酸残基甲基化促进转录激活[1-2]。UNC1999是一个EZH1∕2双重抑制剂,通过与S-腺苷-L-甲硫氨酸(S-adeno‐syl-L-methionine,SAM)竞争发挥作用,可口服生物利用,细胞毒性低[3-4],已被报道能抑制套细胞淋巴瘤、多发性骨髓瘤、胃癌等多种肿瘤[5-7],为多种癌症治疗带来了新的希望。同时有研究发现UNC1999具有潜在的抑制病毒复制的作用[8]。本研究利用多色流式细胞术对用药后外周血免疫细胞亚群表型进行分析,为UNC1999的临床应用提供参考。
1 材料与方法
1.1 材料
选取2020年12月至2021年1月中山大学附属第一医院成年健康体检者,签署知情同意书后,使用其检测剩余血液标本,研究方案已通过中山大学附属第一医院伦理委员会审批(伦理审查批件号:[2018]259)。实验使用12 份健康者血液样本(2 mL∕份),为减少个体差异带来的误差,每4 份血液样本提取PBMC 后混合均匀,获得PBMC 细胞数为(1.57±0.27)×107个,其中1∕4 细胞用于CCK8 试验,3∕4 细胞经处理后用于流式细胞术检测。实验所用的1640培养基、PBS缓冲液、青链霉素、胎牛血清均为Gibco 产品;CCK-8 试剂盒购自日本同仁;Ficoll 分离液(17-1440-03);流式细胞仪(Beckman Coulter);DuraClone IM 表型检测管(B53309、B53318、B53328、B53351、B53340、B53346;Beck‐manCoulter)、固定液(8 546859;Beckman Coul‐ter)、PerFix-nc Kit(B31168;Beckman Coulter)。
1.2 方法
1.2.1 外周血PBMC 提取及细胞培养 外周血(EDTA 抗凝)500×g离心5 min 后,弃血浆,加入两倍血液体积的PBS,混匀后,在15 mL 离心管加入Ficoll 分离液(Ficoll 分离液:血液:PBS=1:1:2),管子倾斜45 ℃,缓慢加入混了PBS 的血,形成明显分层,2 300 r∕min 离心20 min(离心机半径r=9.5 cm),升速为6,降速为0,离心完毕后中间白色层细胞为PBMC,分离出PBMC后用PBS洗涤细胞3次。使用含体积分数10 g∕L 胎牛血清及体积分数1%青链霉素的1640 培养基培养PBMC(培养条件为37 ℃、体积分数5%CO2)。
1.2.2 CCK-8 实验 将细胞悬液以100 000 个∕孔的密度铺于96 孔板,每孔100 μL,二氧化碳孵育箱培养(37 ℃、体积分数5% CO2)。分别加入终浓度梯度为0、5、10、20 和40 μmol∕L 的UNC1999(溶剂为DMSO),作用12 h 后每孔加入10 μL CCK-8 试剂,37 ℃孵育4 h,于450 nm 下检测OD 值,计算细胞存活率,细胞存活率=[(实验孔-空白孔)∕(对照孔-空白孔)]×100%。
1.2.3 流式细胞术检测细胞亚群 以1×106∕mL 将细胞接种于12 孔板中,置于37 ℃,体积分数5%CO2培养箱中,静置培养12 h 加入药物,使终浓度为10 μmol∕L,对照组加入DMSO,终浓度为2 μL∕mL,作用36 h后终止,离心去培养基,加PBS洗涤1次,留下100 μL(包含1×106细胞),混匀后,各加100 μL 样本至贝克曼干粉管,Treg 管加50 μL 样本;常温孵育15 min(避光),各加2 mL PBS,离心后吸净上清,各加400 μL PBS 重悬(Treg 管除外),上机检测;Treg 管尽量吸干净上清,加入5 μL 固定液,混匀,避光放置10 min;加入300 μL 的破膜液,室温避光孵育1 h,加入2 mL 的PBS,离心5 min 去上清,加入500 mL PBS重悬,上机检测(表1)。
表1 UNC1999组与对照组外周血免疫细胞表型的比较Table 1 Comparison of immunophenotype of peripheral immune cells in UNC1999 and DMSO groups()
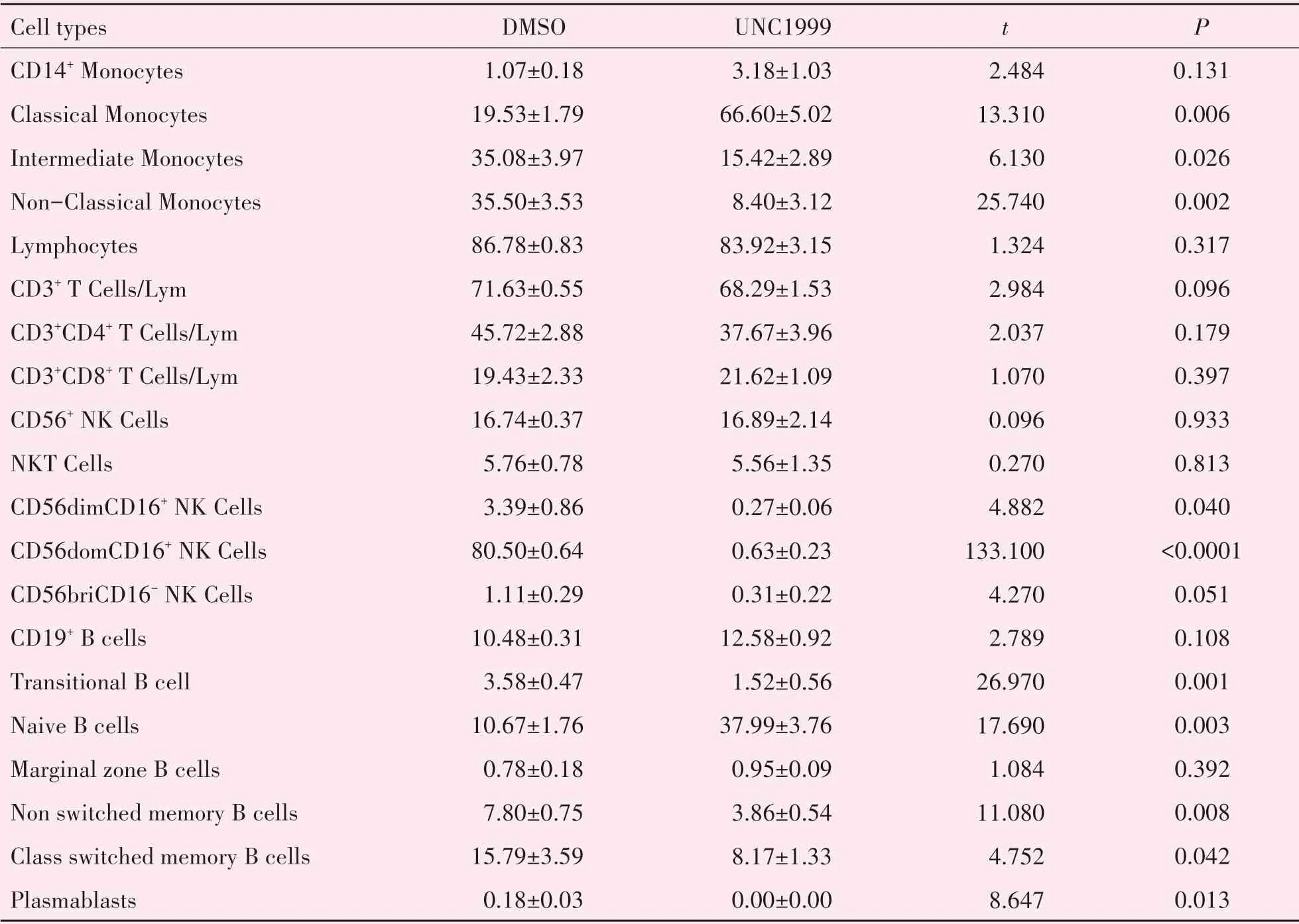
表1 UNC1999组与对照组外周血免疫细胞表型的比较Table 1 Comparison of immunophenotype of peripheral immune cells in UNC1999 and DMSO groups()

续表
1.3 统计学分析
实验数据均使用Graphpad Prism 8.0 软件进行统计分析。计量资料符合正态分布,采用均数±标准差,不符合正态分布,采用中位数(四分位间距)描述。配对数据两组间比较,差值数据呈正态分布且方差齐,采用配对t检验;否则采用校正t检验或配对资料的符号秩和检验。多组均数比较,各组定量资料都呈正态分布并且方差齐性采用单因素方差进行分析,反之用Kruskal WallisH检验,有统计学意义时再进行两两比较。均采用双侧检验,P<0.05为差异具有统计学意义。
2 结果
2.1 UNC1999的细胞存活率检测
不同浓度的UNC1999 与PBMC 作用12 h 后,CCK-8 法检测细胞OD 值计算其存活率。经检验5组差异有统计学意义(F=134.953,P<0.001),5、10 μmol∕L 浓度与对照组相比差异无统计学意义(P=0.992,0.087),且细胞的存活率保持在80%以上,遂选择UNC1999 10 μmol∕L 作为后续实验的处理条件(图1)。
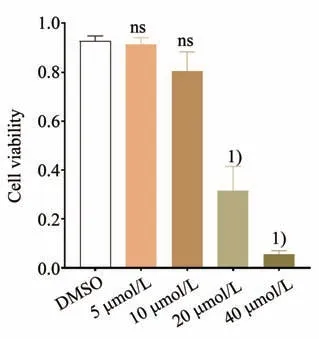
图1 UNC1999作用后PBMC的存活率Fig.1 The cell viability of PBMC after UNC1999 treatment
2.2 流式细胞术检测结果
2.2.1 用药组与对照组单核细胞亚群的比较 相比对照组,用药组单核细胞占PBMC 比例差异没有统计学意义(P>0.05),经典型单核细胞(CD14++CD1 6-)比例上调,中间型单核细胞(CD14++CD16+)和非经典型单核细胞(CD14+CD16+)比例下调(P<0.05;图2)。

图2 用药组与对照组单核细胞亚群的比较Fig.2 Comparison of monocyte subsets in UNC1999 and DMSO groups
2.2.2 用药组与对照组NK亚群的比较 相比对照组,用药组NK细胞占淋巴细胞比例差异没有统计学意义(P>0.05),CD56dimCD16+,CD56domCD16+细胞亚群比例明显下调,差异有统计学意义(P<0.05;图3)。
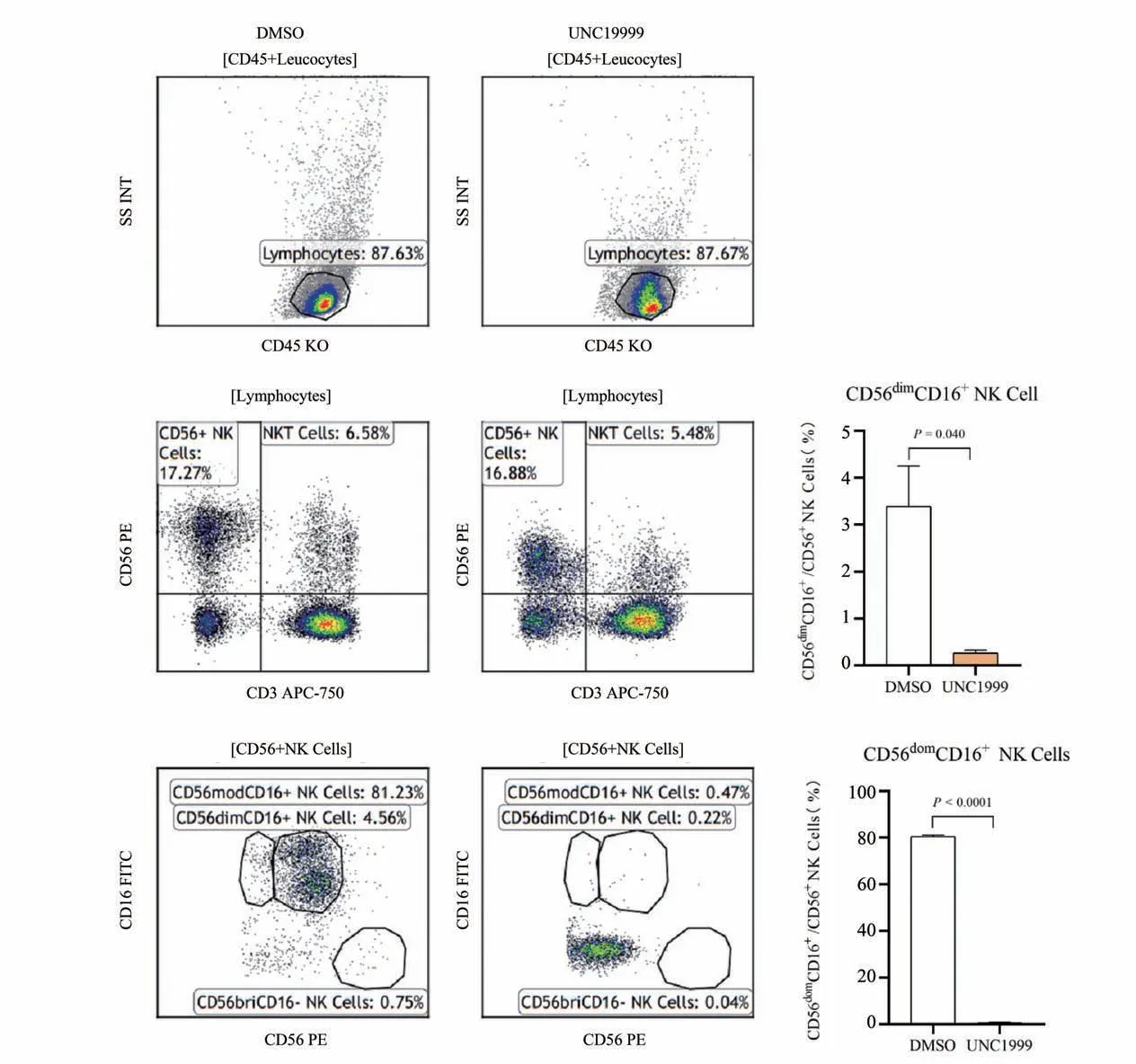
图3 用药组与对照组NK细胞亚群的比较Fig.3 Comparison of NK subsets in UNC1999 and DMSO groups
2.2.3 用药组与对照组B 细胞的比较 相比对照组,UNC1999组B细胞比例差异没有统计学意义(P>0.05),初始B 细胞(naïve B)比例明显上调,记忆B细胞(non switched memory B cells,class switched memory B cells,memory B Cells)、过渡B 细胞(tran‐sitional B cell)、浆细胞(plasmablasts)比例下调,差异有统计学意义(P<0.05;图4)。
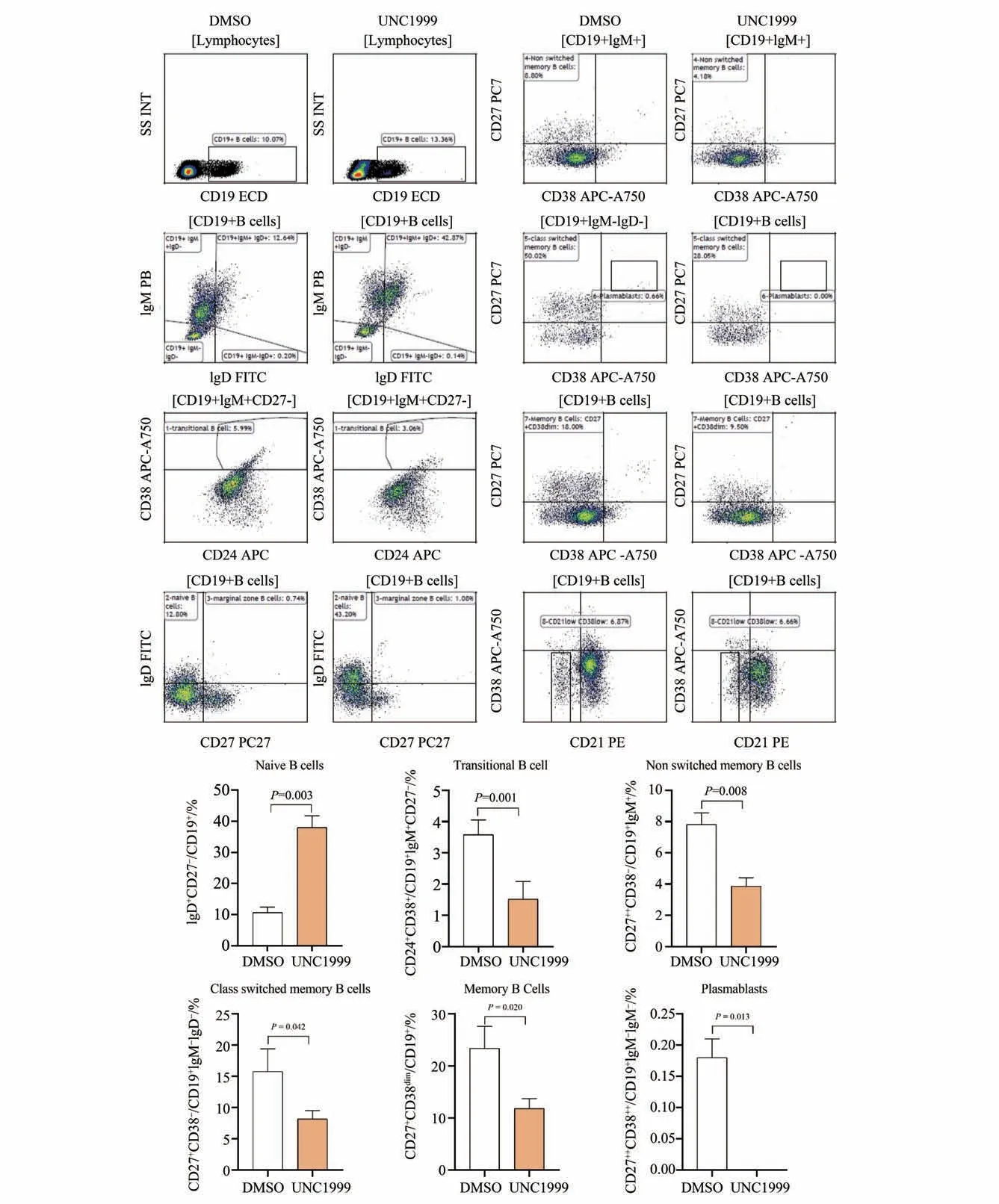
图4 用药组与对照组B细胞亚群的比较Fig.4 Comparison of B cells subsets in UNC1999 and DMSO groups
2.2.4 用药组与对照组树突状细胞亚群的比较相比对照组,UNC1999 组DC 比例上调,其中pDC∕DC 下调,mDC∕DC 上调,差异有统计学意义(P<0.05;图5)。
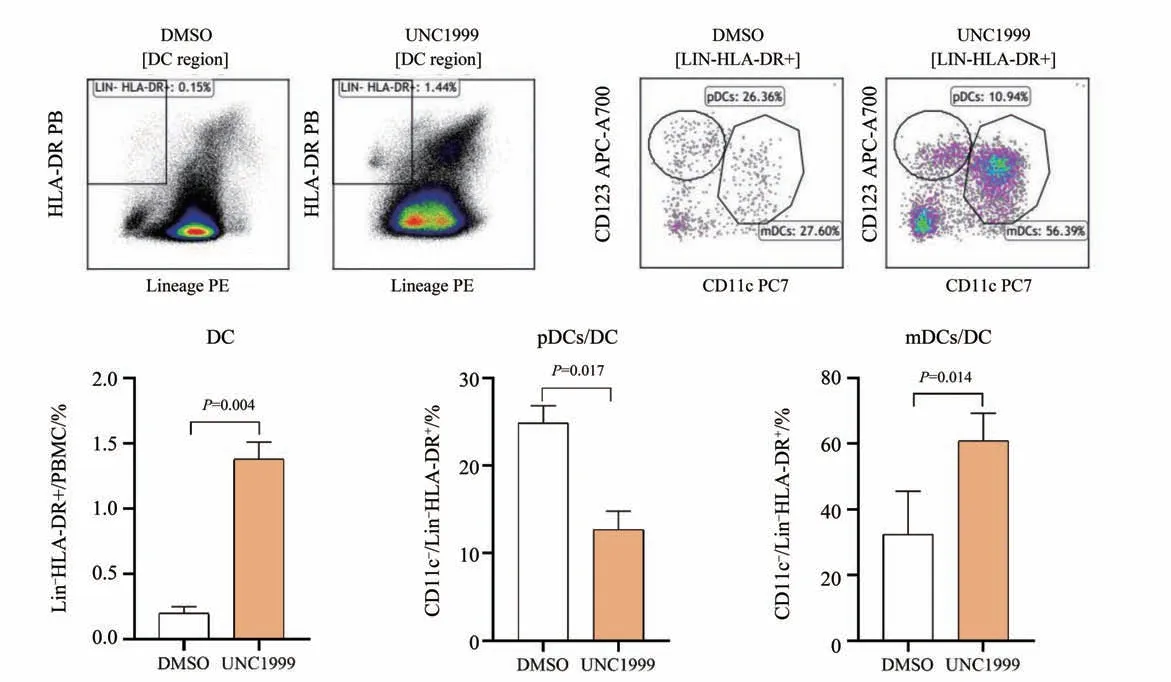
图5 用药组与对照组DC细胞亚群的比较Fig.5 Comparison of DC subsets in UNC1999 and DMSO groups
2.2.5 用药组与对照组T 淋巴细胞亚群的比较相比对照组,UNC1999 组CD8+T 细胞亚群中CD8+中枢记忆T 细胞(central memory T cell,TCM)、CD8+PD-1+比例上调,CD8+效应记忆T 细胞(effec‐tive memory T cell,TEM)比例下调;CD4+T细胞亚群中CD4+CD27+比例下调(P<0.05),其余淋巴细胞亚群在两组间差异没有统计学意义(P>0.05;图6)。
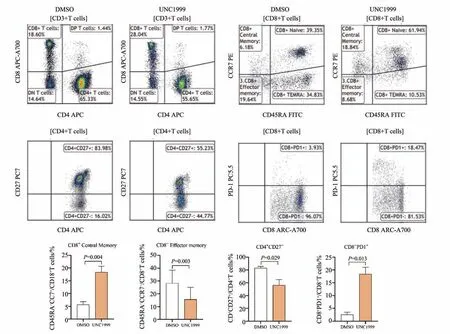
图6 用药组与对照组T淋巴细胞亚群的比较Fig.6 Comparison of T lymphocyte subsets in UNC1999 and DMSO group
3 讨论
UNC1999处理后CD16表达下调,CD16是Ⅲ型免疫球蛋白Fc 受体,分为FcγRⅢA 和FcγRⅢB,FcγRIIIB 仅中性粒细胞表达,FcγRⅢA 与FcRγ 链结合,根据免疫受体酪氨酸激活基序(immunore‐ceptor tyrosine-based activation motif,ITAM)或免疫受体酪氨酸抑制基序(immunoreceptor tyrosinebased inhibitory motif,ITIM)介导细胞激活和抑制,起双向调节作用。同时,ITAM还存在抑制性ITAM(in‐hibitory ITAM,ITAMi)构型,可阻断炎症引起的钙内流、ROS 产生、内吞作用、白细胞浸润等作用,这使得FcγRⅢA具有靶向治疗炎症性疾病的潜力[9-10]。
外周单核细胞根据CD14 和CD16 分为经典型单核细胞(CD14++CD16-),中间型单核细胞(CD14++CD16+)以及非经典型单核细胞(CD14+CD1 6+)。储备在髓外部位的经典型单核细胞可聚集到感染组织中,在控制感染、限制炎症损伤方面起重要作用;非典型单核细胞被招募到非炎症组织中,负责清除细胞碎片和修复内皮[11]。在败血症、艾滋病毒、炎症性肠病以及代谢性疾病及心血管疾病中,中间和∕或非经典型单核细胞亚群的细胞数或比例增加,CD16+单核细胞可产生大量TNF-a 和IL-1b 导致促炎环境[12],并维持炎症因子的高水平状态,被称为“促炎症亚群CD16+单核细胞”。研究[13]显示,CD16+单核细胞在SARS-CoV-2 感染患者中与疾病严重程度相关,可能与该细胞群在CO‐VID-19 患者肺部富集及其在维持血管内环境稳定方面的功能等相关。本研究发现用药后经典型单核细胞比例明显上调,CD16+单核细胞群比例下调,提示UNC1999 可能抑制CD16 表达,可能有利于减缓细胞因子的产生,减轻炎症反应。
NK 细胞通过多个方面发挥免疫调节作用,抑制过度的免疫应答以避免病理损伤,一些肿瘤也可利用这些生理调节功能导致免疫耐受和肿瘤逃逸[14]。NK 细胞分成CD56bri和CD56dimNK 细胞群,CD56briNK 细胞代表相对年轻的、不成熟的NK 细胞,在成熟的过程中获得表达CD16 的能力,成为CD56dimNK 细胞,CD16 受体可介导直接细胞毒作用和抗体依赖性细胞毒作用[15]。在体外,PBMC 分离出来的CD56briNK 细胞与滑膜成纤维细胞接触后上调CD16,分化为CD56dimNK 细胞,产生大量的细胞因子,具有更强的细胞溶解能力[16]。淋巴结和扁桃体中的CD56briNK 细胞能够在IL-2 刺激下上调CD16分化为CD56dimNK细胞[17]。有研究[18]表明EZH1∕2抑制剂促进CD56+前体细胞增殖,使前体细胞谱系向3 型固有淋巴样细胞倾斜,揭示了参与NK细胞成熟调节的表观遗传机制。本实验用药组CD56dimCD16+,CD56domCD16+细胞亚群比例下调,但该药物改变NK细胞表型的作用机制及对感染免疫的影响仍需进一步的深入研究。
B 细胞中的EZH2 失活将B 细胞阻断在增殖和不成熟阶段,构成淋巴瘤发展的关键因素[19-20]。套细胞淋巴瘤中EZH1 表达下调,EZH2∕EZH1 比值的失衡可能在淋巴瘤的发病机制中起作用[21]。相比对照组,用药后初始B细胞比例上调,记忆B细胞、过渡B细胞、浆细胞比例下调,药物可能阻滞了B细胞的分化,其中EZH1或者EZH1∕EZH2比值的失衡是否也影响了外周B细胞的分化,值得深入探讨。
树突状细胞(dendritic cells,DC)分为浆细胞样DC(plasmacytoid DC,pDC)和髓样DC(myeloid∕con‐ventional DC,mDC)。pDC 通过感知病毒感染快速产生大量干扰素和细胞因子,可减缓病毒复制并导致炎症环境;mDC 可限制病毒复制,促进T 细胞免疫[22-23]。实验结果显示用药组DC 总比例以及mDC∕DC 上调,UNC1999 可能促进DC 的表达,有利于发挥抗原提呈作用。
T 细胞根据CD45RA 和CCR7 分成初始T 细胞(CD45RA+CCR7+naïve,TN),中枢记忆T细胞(CD45RA-CCR7+Central memory,TCM),效应记忆T细胞(CD45RA-CCR7-effector memory,TEM),终末效应记忆T 细胞(CD45RA+CCR7-effector memory re-expressing CD45RA,TEMRA)。CD8+TN,CD8+TCM具有自我更新能力,在慢性感染中,TCM 可被重新激活以清除或抑制病原体[24]。程序性死亡受体1(programmed cell death protein 1,PD-1)是活化T 细胞的负调节因子,是T 细胞耗竭的标志[25-27]。CD27属于肿瘤坏死因子受体超家族,其在癌症细胞的表达使其成为抗癌选择之一,抗CD27 单克隆抗体的激动剂与阻断PD-1配体的协同作用可增强衰竭的CD8+T 细胞的增殖和功能[28]。本研究显示该药物影响了T 细胞的部分亚群比例,但其对T 细胞功能的影响需进一步探索。
UNC1999是具有潜力的抗肿瘤药物,研究发现该药物可能具有抗病毒作用[8],因此研究UNC1999对免疫系统影响十分必要。我们的结果显示UNC1999 改变了PBMC 的细胞表型,在合并其他病原体感染的情况下,使用UNC1999 导致上述细胞表型的改变可能影响正常的免疫功能,导致免疫应答的低效或延迟反应。
