先天性高胰岛素血症手术治疗效果分析
2021-08-04梁奇峰梁鉴坤张宾宾白晓玲游辅宇
梁奇峰 温 哲 梁鉴坤 刘 涛 张宾宾 白晓玲 游辅宇
先天性高胰岛素血症(congenital hyperinsulinism,CHI)是造成婴幼儿持续性低血糖最常见的原因,若不及时治疗可导致不可逆的脑神经损伤[1]。其主要致病机制是胰岛β细胞调节异常,胰岛素分泌过量,继而诱发严重、持续性的低血糖。欧美国家CHI约占活产婴儿的1/50 000[2],日本约占1/35 400[3]。目前CHI的内科治疗包括频繁喂养、静脉持续注射高浓度葡萄糖和升血糖药物(如二氮嗪、奥曲肽、胰高血糖素)。对于内科治疗无效或不能耐受药物治疗的患者则需行部分胰腺切除术或胰腺次全切除术。尽管国外已有不少大宗CHI病例行手术治疗的研究,但国内此类研究仍相对少见。因此,本研究通过总结我院行手术治疗的9例CHI患者临床资料,探讨国内CHI的手术方式、疗效及安全性。
材料与方法
一、临床资料
1. 一般资料:2012年12月至2017年12月,广州市妇女儿童医疗中心肝胆外科共收治9例需行手术治疗的CHI患者,其中男6例,女3例。起病年龄为出生1 h至3个月。手术时日龄32~163 d,中位手术时日龄52 d。
2. 诊治程序:先于内分泌科治疗,内科治疗无效后转外科手术治疗。根据2017年日本儿科内分泌学会发布的CHI临床实践指南,在血浆葡萄糖浓度<2.8 mmol/L的情况下,若满足下列标准中2项或以上或满足1项且遗传学分析提示存在CHI致病基因,则可确诊CHI[3]: ①血胰岛素>1 μU/mL; ②皮下或肌内注射0.5~1 mg胰高血糖素15~45 min后血糖升高幅度>1.67 mmol/L; ③为维持正常血糖,静脉注射葡萄糖的速度>7 mg·kg-1·min-1·c-1(小于6个月的患者)或3~7(大于等于6个月的患者)。
3. 基因及影像学检查:本组患者均行ABCC8和KCNJ11基因测序分析及B超、CT和MR检查。仅1例在外院行18F-DOPA PET-CT检查。
二、研究方法
1. 病例纳入标准:由内分泌科医生按照诊断标准确诊为CHI,使用二氮嗪治疗7~10 d(二氮嗪从10 mg·kg-1·d-1逐渐增加至15 mg·kg-1·d-1),仍表现出持续性低血糖;部分患者加用奥曲肽治疗5 d后无改善,考虑保守治疗无效,转外科手术治疗。所有病例由患者监护人签署知情同意书,本研究由广州市妇女儿童医疗中心医学伦理委员会批准。
2. 手术方案的选择:术前PET-CT考虑局灶型CHI的患者,行病灶和正常的胰腺冰冻病理活检。其余患者行胰头、胰体、胰尾的冰冻病理检查[12]。根据术中冰冻病理结果再次判断病理类型。
3. 确定手术切除范围:胰腺切除范围参考III BHNL等[4]的研究。当胰腺切除范围达95%时,通过切开胆囊底部,注入美兰后,间断挤压胆囊,使整个胆总管蓝染显影,避免发生误损伤。完成胰腺切除后,再次挤压胆囊,若无美兰溢出,则可证实无胆漏的发生。
4. 术后管理及随访:术后继续监测血糖和血胰岛素水平。恢复正常饮食后,若仍发生低血糖,先频繁喂养,必要时口服二氮嗪治疗。出院标准:在不静脉输注葡萄糖、正常饮食的前提下不出现低血糖;通过频繁喂养或口服二氮嗪可维持正常血糖。治愈标准:在不静脉输注葡萄糖的前提下,正常饮食,无需口服药物,超过18 h血糖仍处于正常范围[5]。患者均通过门诊和电话随访,术后随访3~8年,中位随访时间6年。
结 果
一 、基本情况
本研究中发现4例ABCC8基因突变的CHI患者,其中3例为父系遗传的ABCC8基因突变,1例为父母遗传的ABCC8基因杂合突变。9例术前B超、CT和MR检查均未见明显异常。仅有1例在外院行18F-DOPA PET-CT检查,考虑胰头局灶型CHI,但术中冰冻病理证实为非典型型CHI。7例术中冰冻病理检查考虑为弥漫型,1例术中冰冻病理检查未见明确病灶。术后石蜡病理证实1例为局灶型CHI,7例为弥漫型CHI ,1例为非典型型CHI(表1)。
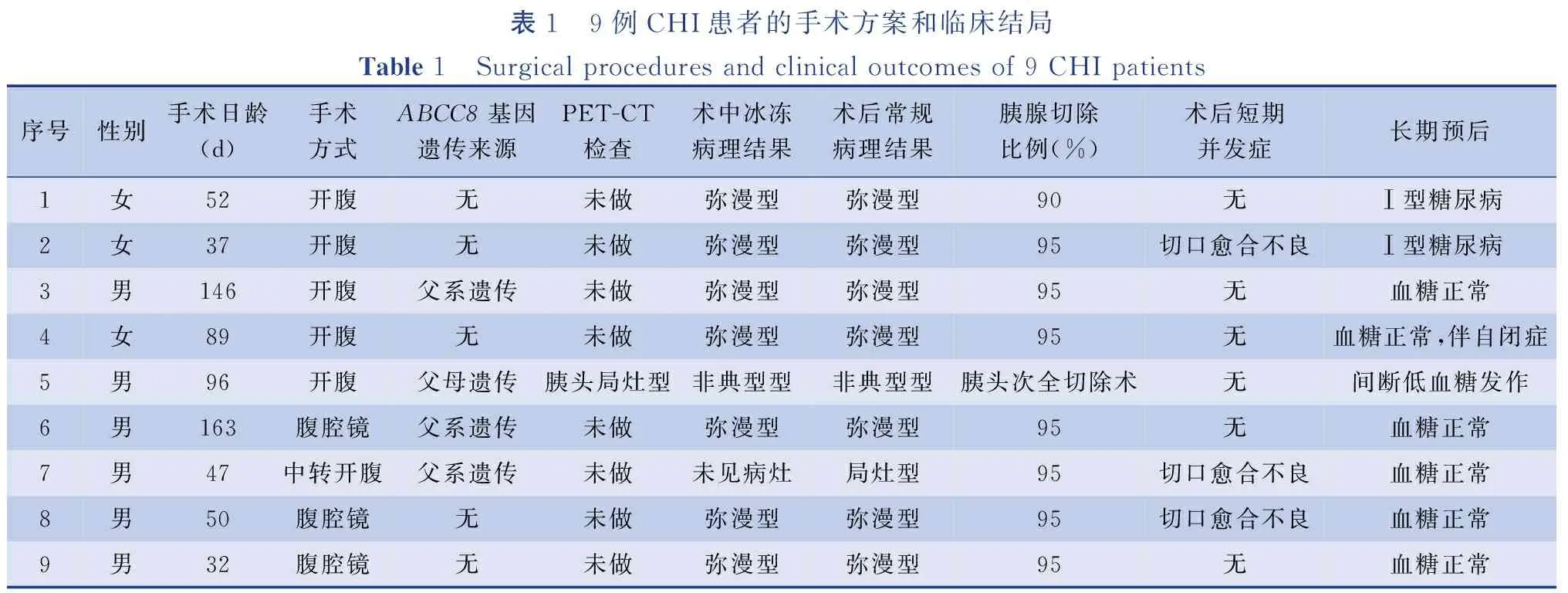
表1 9例CHI患者的手术方案和临床结局Table 1 Surgical procedures and clinical outcomes of 9 CHI patients序号性别手术日龄(d)手术方式ABCC8基因遗传来源PET-CT检查术中冰冻病理结果术后常规病理结果胰腺切除比例(%)术后短期并发症长期预后1女52开腹无未做弥漫型弥漫型90无Ⅰ型糖尿病2女37开腹无未做弥漫型弥漫型95切口愈合不良Ⅰ型糖尿病3男146开腹父系遗传未做弥漫型弥漫型95无血糖正常4女89开腹无未做弥漫型弥漫型95无血糖正常,伴自闭症5男96开腹父母遗传胰头局灶型非典型型非典型型胰头次全切除术无间断低血糖发作6男163腹腔镜父系遗传未做弥漫型弥漫型95无血糖正常7男47中转开腹父系遗传未做未见病灶局灶型95切口愈合不良血糖正常8男50腹腔镜无未做弥漫型弥漫型95 切口愈合不良血糖正常9男32腹腔镜无未做弥漫型弥漫型95无血糖正常
二、手术治疗效果
除1例术中冰冻病理证实为胰头非典型型CHI患者行胰头次全切除+胰体尾空肠Roux-en-Y吻合术外,其余8例行胰腺次全切除术(切除90%~95%胰腺)。开放手术5例,腹腔镜手术4例(其中1例中转开腹手术)。患者术后短期均出现高血糖,需小剂量胰岛素静脉泵注维持血糖正常水平。部分患者出现血糖波动,需胰岛素、静脉葡萄糖交替使用控制血糖。9例未发生胆管或脾血管损伤等并发症。3例术后出现切口液化,予换药处理后好转。
1. 局灶型CHI:病例7术中胰腺表面冰冻病理检查未见明确病灶,临床上考虑弥漫型CHI,行95%胰腺次全切除术,术后石蜡病理检查在胰头深部发现了局灶型病灶。患者术后出院时血糖波动于4.2~7.2 mmol/L,不需接受药物治疗。随访至今,患者正常饮食的情况下可维持正常血糖水平。
2. 弥漫型CHI:病例1行90%胰腺切除术,出院时全奶鼻饲喂养,仍间断发生低血糖,多发生于18时左右或鼻饲奶前,需口服二氮嗪剂控制血糖水平。术后第2年出现Ⅰ型糖尿病,需口服药物降低血糖。病例2行95%胰腺切除术,出院时饮奶前或夜间偶有低血糖,需添加糖水喂养控制血糖,术后第3年发展为Ⅰ型糖尿病,目前采用胰岛素泵降低血糖。其余5例均行95%胰腺切除术,出院时正常喂养,无低血糖发作,血糖波动于3.9~10 mmol/L,无需药物治疗。目前5例患者均正常饮食,无低血糖发作或糖尿病发生,其中1例出现自闭症。
3. 非典型型CHI:病例5术前行18F-DOPA PET-CT检查考虑为胰头局灶型CHI,但术中冰冻及石蜡病理证实为非典型型CHI,经历2次手术。第一次行50%胰头切除术+胰体、尾空肠Roux-en-Y吻合术,术后第15天鼻饲全量奶,糖速6.9 mg·kg-1·d-1的情况下仍有反复的低血糖,血糖最低达1.5 mmol/L。根据PET-CT和病理检查结果,考虑胰头病灶切除不彻底,遂行二次手术,行胰头次全切除,仅保留十二指肠内侧和胆管周围的部分胰腺组织。患者术后未能达到正常血糖水平,出院时在饮奶前或夜间有低血糖发作,添加糖水喂养即可纠正低血糖。目前该患者除一日三餐外,只需要定期口服果汁即可维持正常血糖。
讨 论
一、CHI的分型及鉴别
CHI目前被认为是一种遗传异质性疾病,已发现16个基因突变可导致CHI[6]。其中编码胰岛β细胞膜上KATP通道2个亚基(SUR1和Kir6.2)的基因(ABCC8和KCNJ11)突变所致的CHI最为常见,占36%~56%[7,8]。目前仍有45%~55%的CHI患者找不到致病基因[9]。按组织病理学,CHI可分为局灶型、弥漫型以及非典型型。局灶型CHI病变多由ABCC8和KCNJ11的单等位基因父系隐性突变的遗传所致[8,10],其病理特征是病灶边界不规则,胰岛内分泌细胞出现肿瘤样增殖,细胞核常增大[11,12]。与胰岛素瘤不同的是,CHI病灶内保留了正常胰腺的小叶结构和外分泌成分,病灶外的胰岛细胞则是正常的。弥漫型CHI病变多数为ABCC8和KCNJ11双等位基因隐性突变,显性突变相对少见[12],其病理特征是胰腺内出现弥漫分布的、占总量5%~10%的异常胰岛细胞有特征性增大的细胞核(为正常大小的1~3倍)[11,12]。非典型型CHI是一种少见类型,目前未发现致病的基因突变,其病理特征是出现局限性胰岛核增大,即胰腺的某一区域存在类似弥漫型特征的病变或是Beckwith-Wiedemann综合征,其内分泌组织相对于外分泌组织的数量显著增加,胰腺实质的正常小叶结构有不同程度的丧失[13-15]。Snider等[8]研究发现,经过病理证实的149例局灶型CHI,单等位基因隐性KATP突变预测局灶型CHI的敏感性为97%,特异性为90%。Arya等[16]研究表明ABCC8和KCNJ11父系遗传突变在病理组织学上证实为局灶型CHI的预测准确率只有45%(24/53)。本研究中发现4例ABCC8突变,3例父系遗传突变中只有1例经病理证实为局灶型CHI,其余2例为弥漫型CHI,1例父系母系混合突变,经病理证实为非典型型CHI。因此,通过基因突变预测病理类型可能存在一定的误差,而且对手术方式的指导价值有限[17]。
对于局灶型CHI行病灶切除即可治愈,根据文献报道,局灶型CHI占所有病例的40%~50%,因此术前鉴别局灶型CHI并确定病灶位置至关重要[18]。既往研究表明,B超、CT和MR检查均不能鉴别局灶型和弥漫型CHI。Brunelle等[19]在1989年通过经肝门静脉取样(transhepatic portal venous sampling,TPHVS)来鉴别局灶型和弥漫型CHI。Ferry等[20]在2000年通过动脉内钙离子刺激、门静脉取样(arterial stimulation with venous sampling,ASVS)来鉴别局灶型和弥漫型CHI,但这两种方法耗时长,有创,对医者技术的要求高,且特异性和敏感性并不令人满意。18氟-左旋多巴(18F-L-DOPA)是多巴胺类似物的放射性示踪剂,该示踪剂可被胰腺内、外分泌细胞摄取、脱羧基并储存,因此L-DOPA的放射性异构体18F-L-DOPA可以被用来进行 PET-CT显像,从而鉴别并定位CHI[21]。Laje等[22]研究表明,18F-L-DOPA PET-CT显像诊断局灶型CHI的敏感性为85%,特异性为96%,阳性预测值为96%。18F-L-DOPA正电子发射计算机断层扫描(positron emission tomography,PET-CT)已成为术前鉴别局灶型和弥漫型CHI最好的无创方法[23]。但Laje等研究中有8例术前PET-CT考虑弥漫型CHI,最终经过术中冰冻病理诊断为局灶型CHI,术中及时更改了手术方案,行胰腺部分切除,最终获得治愈。术中冰冻病理检查是在决定手术方案前对PET-CT结果的再次确认和必要纠正。如果局灶型病灶深埋于胰腺深部,则需要在PET-CT的定位指导下多次进行冰冻切片分析,才能发现病变。由于局灶型病变具有章鱼样触角,延伸至周围正常组织,因此必须在手术切缘多处取材,以确保病灶完全切除。由于条件限制,本研究中只有1例术前行18F-L-DOPA PET-CT检查,考虑为胰头局灶型CHI,但术中冰冻病理证实为非典型型CHI。病例7术中在胰腺表面多处取材后冰冻病理仍未能发现病灶,术后石蜡病理证实局灶型病灶位于胰头深部,因此术前PET-CT检查对位置深的局灶型CHI诊断非常重要,可以弥补术中活检的局限性。诊断明确的局灶型CHI患者仅行胰腺病灶切除术即可治愈,可以避免胰腺次全切除,减少正常胰腺的不必要切除,避免发生糖尿病的风险。
二、手术方案的选择
局灶型CHI原则上通过病灶挖除或胰腺部分切除术切除局部病变,即可达到治愈的目的。局灶型的病灶直径多数<10 mm,可暴露在胰腺表面,也可能深埋于胰腺实质内;可发生在胰头、胰体或胰尾[12]。对于不同未知的病灶,其手术方案也存在差异。对于表浅、细小的病灶,即使在胰头,也可以通过简单的挖除去除病灶。但对于胰腺实质深面的病灶,如果位于胰体或胰尾,可行胰腺远端部分切除术;如果位于胰头深面,在保护十二指肠动脉血供的情况下,行胰头次全切除术+胰体尾空肠Roux-en-Y吻合术则是彻底切除病灶,避免术中胆总管损伤的最好方法。Scott等[5]研究表明,早期病灶位于胰头的部分局灶型病例,由于未行胰头次全切除术,患者术后会出现严重的低血糖。据文献报道[5],病灶在胰头的局灶型CHI患者中约30%需行胰头次全切除术+胰体尾空肠Roux-en-Y吻合术,个别病变延伸至十二指肠壁的患者甚至需要行胰十二指肠切除术(Whipple手术)。本研究中,病例7为局灶型CHI患者,由于术前、术中均未确诊病灶,遂行胰腺次全切除术(切除范围95%)。其术后血糖正常,但如果术前有PET-CT检查指导,或许可以避免胰腺次全切除术。
弥漫型CHI因为病变弥漫分布在整个胰腺,因此需行胰腺次全切除术。小儿胰腺解剖位置特殊,周围脏器复杂,给小儿胰腺手术技术的发展带来一定困难[24]。常见的术中并发症包括出血、脾脏损伤、小肠损伤、胆总管损伤;术后并发症包括胆漏、胆道狭窄、切口感染。当手术切除范围超过95%时,需要靠近胆总管及十二指肠壁切除胰腺,因此,避免胆管损伤是至关重要的,技术上存在一定难度。胰腺次全切除术后胆总管并发症(术中损伤或术后狭窄)的发生率为2%~15%[25]。Scott等[12]报道了避免术中并发症的技巧,即游离胰腺时,通过骨骼化脾动静脉,彻底结扎胰腺动静脉小分支,避免对脾脏血供的影响。对胰头部位进行手术操作时,将1~2个血管吊带放置在十二指肠后侧的胆总管胰腺外段,然后在十二指肠C环内摆动,通过此方法可以辨认胰头内的胆总管。在切除靠近十二指肠壁的胰腺时,在可能的情况下,尽量保留供应十二指肠第三、第四部分的胃十二指肠动脉(上/下/后/前胰十二指肠动脉),可以避免十二指肠缺血。在手术结束时挤压胆囊,了解有无胆漏发生。本研究接受其提出的骨骼化脾动静脉和保留胃十二指肠动脉的观点,但在避免损伤胆总管上采用了一种新的方法:即将美兰注入胆囊,使整个胆总管蓝染显影。通过颜色的对比,术者在手术过程中能够清晰辨认胆总管。在完成胰腺切除后,再次挤压胆囊。若无美兰溢出,则可证实无胆漏的发生。本组行胰腺次全切除术的8例患者无一例出现胆总管损伤并发症。
三、对弥漫型CHI胰腺次全切除术的切除范围选择和长期预后预测
对弥漫型CHI患者界定合适的胰腺切除范围是非常困难的。目前对于CHI患者的手术切除范围尚未达成共识,多数研究中心的胰腺次全切除范围为90%~98%,患者在术后可能会达到正常血糖水平;也可能因胰腺切除过少导致术后持续性低血糖,需要二次手术;也可能因胰腺切除过多,导致术后短期内外分泌功能不全,远期发展为糖尿病。Beltrand等[26]观察105例CHI患者中,47例局灶型CHI行胰腺部分切除术,无一例发生糖尿病,而58例弥漫型CHI行胰腺次全切除术,高血糖的发生率在术后第13年时达100%;术后第8年,进展为Ⅰ型糖尿病并需要胰岛素治疗者占所有患者的42%,术后第14年占91%。遗憾的是其研究并未详细说明胰腺次全切除术切除胰腺的范围。Lord等[27]研究中,在中位随访的8.9年时间里,121例接受胰腺切除术的CHI患者中有44例发展为Ⅰ型糖尿病,其中41例胰腺切除范围不低于95%,而其他3例胰腺切除范围分别为66%、75%和90%。而且与非糖尿病者相比,糖尿病患者胰腺切除范围的中位数更高。
随着患者年龄增长,胰腺切除的范围逐渐扩大,其罹患糖尿病的风险也随之升高。总的来说,弥漫型CHI无法像局灶型那样,通过手术切除病灶,达到治愈的目的。因此,弥漫型CHI行胰腺次全切除术的目的应该是术后缓解严重的低血糖,病人无需在医院持续静脉注射高浓度葡萄糖,而是通过频繁喂养、口服药物,甚至是正常饮食即可维持正常血糖。本研究中,早期2例弥漫型CHI行90%和95%的胰腺切除,在出院时有低血糖发生,但可以控制,分别于术后2年和3年发展为Ⅰ型糖尿病,需要口服药物或注射胰岛素治疗。其余1例局灶型和5例弥漫型CHI患者行95%胰腺切除术,出院时无低血糖发作。随访至今,在正常饮食的情况下均无需用药,无低血糖、糖尿病发生。本研究中,弥漫型CHI患者行胰腺次全切除术后糖尿病的总体发生率为28.6%(2/7),而在95%胰腺次全切除术的患者中糖尿病的发生率是16.7%(1/6)。
本研究中糖尿病发生率较其他文献低,可能原因是胰腺次全切除的范围为90%~95%。本研究发现切除95%胰腺的CHI患者术后不仅有更多患者血糖达到正常水平(83.3%,5/6),而且糖尿病的发生率也比其他文献报道低。因此,弥漫型CHI患者行胰腺次全切最合适的切除范围可能在95%左右。本研究的中位随访时间为6年,若随访时间进一步延长,糖尿病发生率有可能会升高,因此对行胰腺次全切除术的CHI患者需严密、长期监测血糖情况。
四、本研究的局限性
本研究存在以下不足。第一,由于CHI不常见,手术病人的数量不多,每种分型的病人数量有限,故本研究结论可能存在偏倚。第二,由于影像技术限制,本研究中仅有1例术前在外院行18F-L-DOPA PET-CT检查,而国外的研究中心普遍对CHI患者行18F-L-DOPA PET-CT检查,以鉴别局灶型CHI和弥漫型CHI。第三,有研究表明部分胰腺次全切除术后患者亦存在外分泌功能不全[28]。但本研究没有涉及此方面的评估,在以后的研究中需要增加胰腺外分泌功能的监测和治疗。第四,胰腺次全切除术后患者出院时出现可控制的低血糖或血糖偏高。但长期随访后,部分患者血糖恢复正常,部分患者发展为糖尿病,可能与术后胰腺再生有关。部分疗效不佳的患者随访依从性差,因此术后随访中未能行胰腺MR形态学检查,缺少胰腺增生的相关资料。
综上,对二氮嗪等药物治疗无效的CHI患者可采用手术治疗。18F-DOPA PET-CT对非典型型CHI的诊断价值需要进一步探讨。弥漫型CHI患者行胰腺次全切术可有效控制血糖,部分患者可以获得正常血糖,但部分患者会发展为Ⅰ型糖尿病,尤其是术后短期仍有低血糖发作的患者发生糖尿病的可能性更大。对大多数弥漫型CHI患者行95%胰腺次全切是适合的,且减少了远期糖尿病的发生。术前PET-CT对鉴别局灶型CHI有重要意义。术前PET-CT和术中冰冻病理检查有助于明确CHI分型,指导选择正确的手术方式。
