全腹腔镜ALPPS治疗小儿巨块型肝脏肿瘤
2021-08-04郑百俊吴宣林郭新奎
余 辉 郑百俊 高 亚 龚 伟 吴宣林 刘 瑶 熊 娜 余 强 李 鹏 郭新奎
手术完整切除是肝脏肿瘤患者获得根治的最主要途径,同时保留足够的残肝容积是避免术后肝功能衰竭的必要条件[1]。巨块型肝脏肿瘤患者往往因为存在较大的术后肝功能衰竭风险而丧失手术根治机会,是目前肝胆外科医生面临的临床难题,对于小儿肝胆外科医生尤为如此。由于小儿肝脏肿瘤病情进展快、缺少及时的体检和规范的查体,多数患者就诊时已发展为巨块型肝脏肿瘤。对于部分肝母细胞瘤等常见小儿巨块型肝脏恶性肿瘤患者,采用新辅助化疗有望使肿瘤缩小,便于手术切除,达到手术根治效果;但对于部分术前化疗效果欠佳的恶性肿瘤患者及良性肿瘤的患者来说,面临的选择则少得多。虽然肝移植术可作为选择之一,但考虑到治疗费用高、肝源紧张、病情进展快、待诊时间长、开放手术创伤大、术后恢复时间长、术后需终身服用免疫抑制剂等治疗现状以及二胎政策放开等因素,患者家长行肝移植的意愿并不强烈。ALPPS为术前化疗效果欠佳的恶性肿瘤及良性巨块型肿瘤患者带来了福音,其通过一期离断肝脏实质和患侧门静脉分支结扎等方法改变肝脏血流动力学,进而激活应激反应(肝内嗜肝因子再分配、局部创伤、门静脉血流再调整以及门静脉高压),刺激残肝容积在短时间内迅速增大,可有效避免二期巨块型肿瘤切除术后发生肝功能衰竭[2,3]。ALPPS使原本无法切除或者处于可切除边缘的肝脏巨块型肿瘤患者获得根治机会,并避免因残肝功能不足导致的术后肝功能衰竭,在成人肝胆外科已于2012年率先开展,在提高肿瘤切除率的同时可减少对肝移植的需求,作为极限性肝切除手术方法的探索,被誉为近年来肝脏外科领域最具革命性创新技术之一[4,5]。但ALPPS在儿童肝脏肿瘤中的应用尚处于起步阶段,董岿然等于2018年报告1例ALPPS治疗肝母细胞瘤,其适应证、并发症的处理以及临床疗效的评估尚待进一步总结[6]。本团队和其他同道在前期腹腔镜小儿肝切除术的临床实践中已证实ALPPS治疗肝母细胞瘤安全可行,可作为小儿肝切除的新选择[7-9],推测在此基础上施行全腹腔镜ALPPS有望成为治疗巨块型肝脏肿瘤的新方法。2020年7月,西安交通大学第二附属医院小儿外科收治1例肝脏巨块型间叶错构瘤患者,采用全腹腔镜ALPPS顺利施行肝脏右三叶切除术,术后效果令人满意,为巨块型肝脏肿瘤残肝容积不足的患者提供了希望。现结合病例资料及相关文献复习报告如下。
材料与方法
一、一般资料
患者,女,3岁,以腹部进行性增大包块3个月收入院。既往体健,无明显诱因发病。身高120 cm,体重16.5 kg,入院查体发现腹部膨隆明显,右上腹部触及一巨大类圆状质硬包块,下界可达脐下两横指,左界越过腹中线,边界不清,移动度差。实验室检查提示血尿粪常规、凝血全套、生化指标以及甲胎蛋白水平正常。辅助检查B超报告肝右叶探及较大低回声肿块(Ⅴ段、Ⅵ段、Ⅶ段、Ⅷ段),占据肝右静脉,紧贴并压迫肝中静脉,占据门静脉右支、门静脉主干,胆囊受压,范围约13.7 cm×8.9 cm×14.4 cm;无门静脉高压征象。增强CT检查提示肝右叶可见巨大软组织肿块影,动脉期呈不均匀强化,门脉期及延迟期持续强化,范围约13.5 cm×8.9 cm(图1),右肾受压变形;腹膜后未见肿大的淋巴结。三维重建提示肿瘤与肝脏大血管关系不明(图1);初步预估肿瘤容积为353.9 mL,达全肝容积的53.5%,预估完整安全切除肿瘤后残肝容积为221.3 mL,达全肝容积的23.0%(图1);提示存在术后肝衰竭风险。术前头颅、胸部CT无异常发现。粗针多点穿刺活检病理检查提示肝脏间叶错构瘤。术前已充分告知病情,取得患者家长谅解并签署相关知情同意书。患者治疗方案(包括ALPPS手术计划)已上报医务部并备案,施行ALPPS手术前已通过医院医学伦理委员会审查并批准。
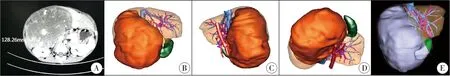
图1 肝脏巨块型间叶错构瘤患者术前影像学资料 A:增强CT示肝右叶巨块型肿瘤,门静脉及右肾受压变形; B:三维重建正面观; C:三维重建右面观; D:三维重建下面观; E:肿瘤术前预估切线
二、手术方法
2020年7月11日施行全腹腔镜下胆囊切除术、ALPPSⅠ期手术即门静脉右支结扎加肝脏实质分割。术前72 h按照0.5 mg/kg剂量静脉注射吲哚氰绿(Indocyanine green,ICG);常规后背垫高并取仰卧位,双下肢分开;沿脐正中逐层切开入腹置入12 mm Trocar,30°荧光腹腔镜探查发现腹腔内少量淡黄色腹水,肿瘤位于肝右叶及部分左内叶,质硬,稍显苍白,其中部分瘤体略突出肝表面。术中激发ICG了解肿瘤边界以及有无转移情况。结合术前影像学检查、术中探查以及ICG显影情况,拟按照原方案行ALPPSⅠ期手术。分别于剑突左下缘、右肋缘下两横指与腋前线交界处以及脐下两横指左侧锁骨中线水平各置一5 mm Trocar建立操作通道。超声刀离断肝圆韧带、肝镰状韧带,腹壁外进针向上牵引并固定胆囊床,常规逆行切除胆囊。于近胆囊床切除1.0 cm×0.5 cm×0.5 cm肿瘤组织再次送病理检查,电凝止血。超声刀结合电凝细心解剖第一肝门,该处软组织明显水肿,探查发现2枚肿大淋巴结,大小约1.0 cm×1.0 cm,完整切除后送病理检查。Glisson鞘内解剖出门静脉右支及肝右动脉,Hem-o-lok结扎夹夹闭、丝线双重结扎后离断门静脉右支。ICG荧光结合肝脏表面缺血线引导下电凝钩标记预切线(镰状韧带右侧2 cm处),解剖游离出第二肝门后超声刀顺序离断右侧冠状韧带、右三角韧带以及肝肾韧带。超声刀和微波刀沿预切标记线由浅入深、由前向后逐步深入切割完全劈裂肝实质,游离出肝内血管及胆管后采用Hem-o-lok夹分别夹闭切断直至肝中静脉根部水平。减低腹腔压力条件下,温蒸馏水反复冲洗后创面止血并确定无胆汁渗漏,术中多次激发ICG荧光确定左外叶无肿瘤残留,肝创面埋置无菌透明薄膜后覆盖止血纱布。常规留置一根腹腔引流管。详见图2。
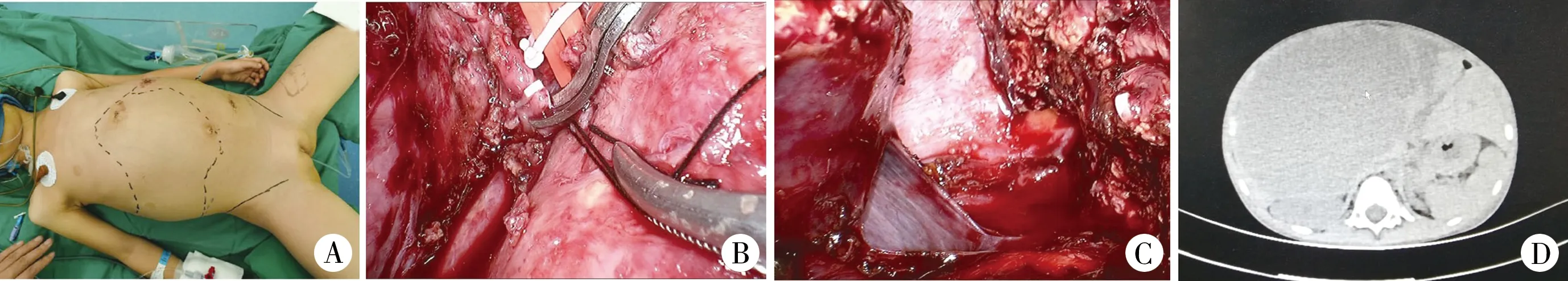
图2 ALPPSⅠ期手术情况 A:患者体位; B:门静脉右支结扎; C:肝脏实质分割; D:术后第3天复查CT
2020年7月24日施行全腹腔镜下肝右三叶切除术。术前72 h按照0.5 mg/kg剂量再次静脉注射ICG;体位及Trocar孔位置同前,常规建立CO2气腹,荧光显微镜下探查发现腹腔少量淡黄色清亮腹水,网膜组织充血水肿并覆盖包裹胆囊床及第一肝门;左半肝较前增大、增厚,色泽红润,右半肝色泽灰暗。细致游离上述粘连并充分止血,取出留置的片状塑料薄膜,暴露第一肝门,辩清肝右动脉、右肝管并Hem-o-lok结扎夹夹闭后离断。沿原离断平面继续采用超声刀、双极电凝以及微波刀离断肝实质,自浅入深、由前向后逐步深入,术中多次激发ICG进行术中导航明确有无肿瘤残留、胆汁渗漏。置肝脏三叶拉钩抬起右半肝显露下腔静脉,于第三肝门部细心游离出数根肝短静脉,Hem-o-lok结扎夹夹闭后离断;暴露肝后下腔静脉无血管区,沿此间隙向第二肝门方向继续游离下腔静脉前方残留的肝实质,直至依次完全游离出肝中静脉及肝右静脉根部,Hem-o-lok结扎夹夹闭后离断,完整切除右三叶。温蒸馏水反复冲洗、激发ICG后检查创面未见明确活动性出血、胆汁渗漏及肿瘤残留;再次核查左外叶肝血供显示良好。沿下腹皮横纹处切口8 cm,逐层切开入腹后将装袋后的标本取出,常规置管关闭切口。详见图3。
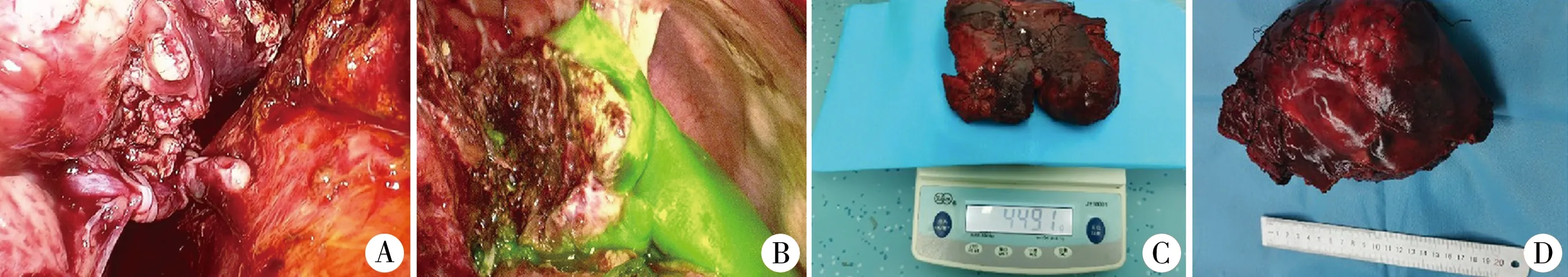
图3 ALPPSⅡ期手术情况 A:肝动脉右支、右肝管的解剖、结扎与离断; B:ICG引导下肝实质的离断; C:标本称重; D:标本测量
结 果
本病例于2020年7月11日施行全腹腔镜下胆囊切除术。手术顺利,耗时180 min,安全返回病房,未输血;术后3天内体温波动于36.3~37.5℃,腹腔引流管通畅且固定良好,引流量约50 mL/d,术后第3天达高峰约100 mL,至术后第7天基本无渗液引出。术后常规给予抗生素、白蛋白等对症支持治疗,连续复查相关检查(肝功能、血常规、凝血功能)提示术后3天转氨酶维持在较高水平,术后10天肝功能逐渐恢复正常。凝血功能未见异常。术后每2天采用超声、CT检查评估术后肝脏体积及胆管、血管变化,其中超声提示门静脉左支通畅、内径5.6 mm、流速42 cm/s;术后第3天CT检查测量术后残肝明显增大,由术前的221 cm3增大至394 cm3,较术前增加78.28%,在随后的10天内多次复查CT,残肝体积维持在术后第3天水平,未按照预期进一步增大。但增大后残肝体积已达到预期保留左半肝的安全肝容积要求,满足ALPPSⅡ期手术要求。
2020年7月24日施行全腹腔镜下ALPPSⅡ期肝右三叶切除术。手术顺利,耗时360 min,右半肝完整切除,输红细胞悬液400 mL、冰冻血浆200 mL。手术标本重449.1 g。术后给予支持治疗后患者的肝功能、血常规、凝血功能等指标迅速恢复。术后3天体温波动于36.3~37.8℃,腹腔引流管通畅且固定良好,引流液为清亮胆汁,补充诊断胆漏,术后第3天引流量达高峰约175 mL,后引流量逐渐减少约20 mL/d,8月13日带管出院;术后12 d肝功能恢复正常。病理结果示肝脏间叶错构瘤。血常规、炎性因子、胆红素、转氨酶以及血清白蛋白水平详见图4。
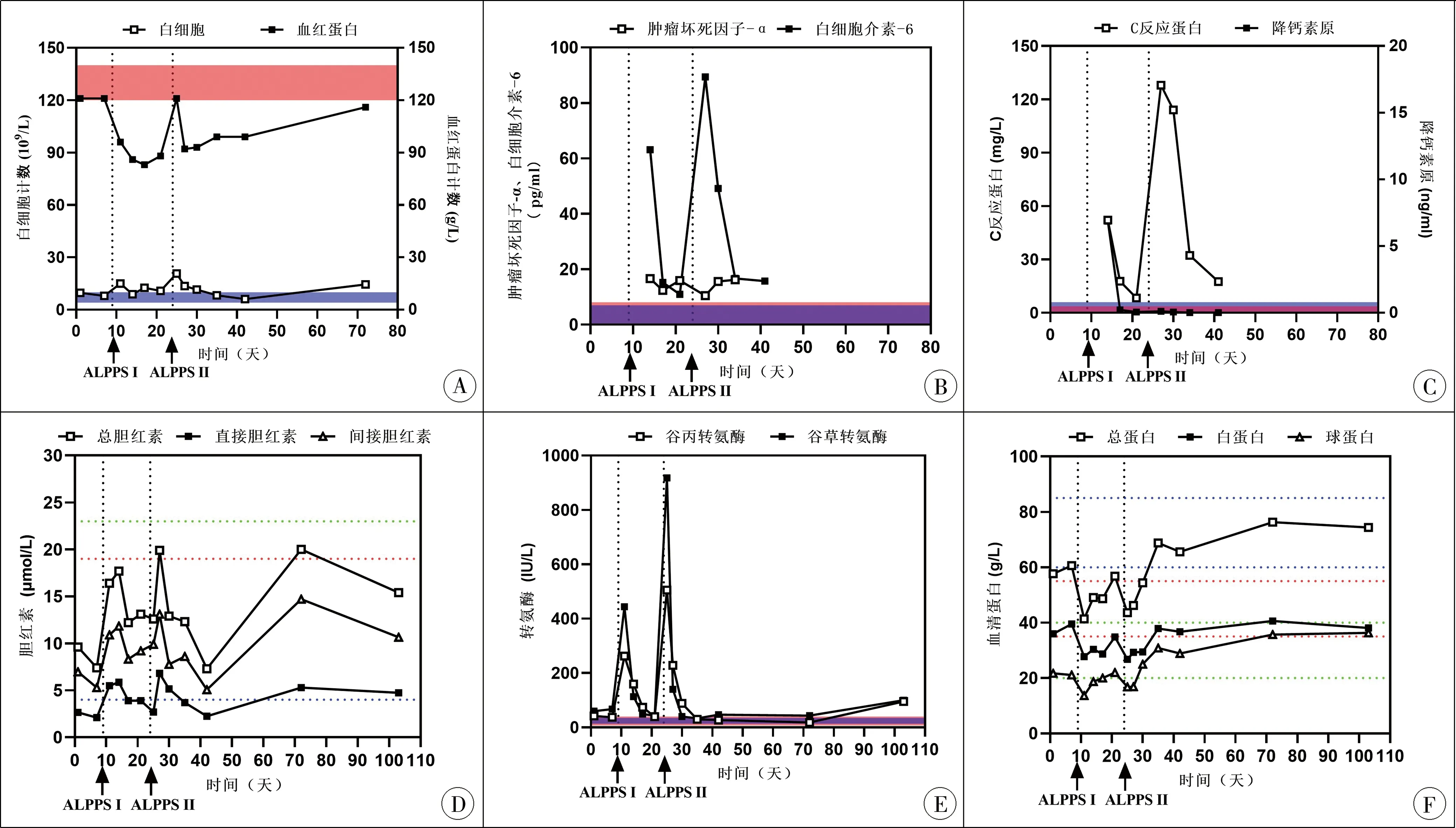
图4 ALPPSⅠ期、Ⅱ期围手术期实验室检查结果 A:血常规; B:肿瘤坏死因子-α、白介素-6; C:C反应蛋白、降钙素原; D:胆红素; E:转氨酶; F:血清蛋白
随访至今,患者一般情况较好。CT 检查提示残留肝脏未见明显占位性病变和腹腔积液。肝功能、凝血功能和AFP均在正常范围之内。
讨 论
小儿巨块型肝脏肿瘤尤其是部分术前化疗效果欠佳的肿瘤是目前小儿外科医生面临的棘手难题之一,如何完整切除肝脏肿瘤并避免因残肝容积不足导致术后肝功能衰竭等问题亟需解决。ALPPS通过短时间内刺激残肝有效肥大,使得上述不可切除的小儿巨块型肝脏肿瘤变为可切除[2,3],为小儿巨块型肝脏肿瘤患者带来了希望[10]。
根治性切除是治疗巨块型肝脏肿瘤的主要手段,有助于巨块型肝脏肿瘤患者获得治愈;但大面积施行的肝切除术可导致术后肝功能衰竭甚至危及患者生命,另外也增加了患者围手术期并发症发生率[1,4,10]。如何在保障肝脏肿瘤有效根治性切除的基础上避免术后发生肝功能衰竭,减少并发症是治疗巨块型肝脏肿瘤的两个关键。成人肝胆外科临床研究已证明ALPPS能够在短期内刺激残肝肥大至安全范围,能够扩大现有外科手术切除局部巨大肝脏肿瘤的适应证范围,并降低术后肝功能衰竭的风险,被誉为肝胆外科领域革命性手术策略和技术创新[4,5]。为避免肝切除术肝衰竭等致死性并发症,对健康成人来说,适宜的(25%~30%)FLR/TLV是必须的,尤其是对术前接收新辅助化疗的患者,一般认为其FLR/TLV要达到40%以上[11];尽管儿童肝脏储备功能可能较成人大,对肝脏肿瘤切除术可能具有更大的耐受性,但目前对于小儿巨块型肝脏肿瘤患者尚无明确指南/共识制定适宜的FLR/TLV。董岿然等采取ALPPS术为1例FLR/TLV为32.2%的PRETEXT Ⅳ期肝母细胞瘤患者成功施行了肝脏肿瘤切除术,已证实了ALPPS术治疗小儿巨块型肝脏肿瘤的安全性和有效性[6]。本例患者预估完整安全切除肿瘤后残肝容积为221.3 mL,FLR/TLV为23.0%,尚不能达到25%的安全极限值,施行一期肝肿瘤切除术存在较大的风险。另外该患者住院后,已多次组织包括影像科、介入科、儿童重症科、麻醉科等在内的多学科会诊,鉴于门静脉右支尚不具备血管介入条件,因此无法行门静脉栓塞术。
考虑到小儿肝脏肿瘤中巨块型比例较成人高,临床上采用ALPPS治疗小儿巨块型肝脏肿瘤的客观需求更为迫切。本例临床资料显示ALPPSⅠ期术后第3天复查评估残肝容积急速增大,由术前221 cm3增大至394 cm3,较术前增加78.28%,与成人报道ALPPS术后7 d内残肝容积增大74%~87%一致[1,4,10],上述小儿ALPPS技术的开展充分体现了该技术在短时间内促进肝脏再生的有效性,为后续开展ALPPS治疗小儿巨块型肝脏肿瘤提供了新的参考和治疗方向。目前尚无明确机制阐述门静脉结扎后残肝容积急速肥大这一现象,多种可能机制如体内嗜肝因素重新分配、局部炎症和创伤刺激、残肝血供增加以及门静脉高压等尚待进一步研究[1,4,10]。ALPPSⅠ期术后实验室检查炎性指标CRP、TNF-α以及IL-6水平维持在正常上限值之上,提示尽管ALPPSⅠ期术后患者机体在较长时间内处于炎性持续状态,但残肝容积在术后3天内急速增大后维持不变,推测上述炎性环境等因素短时间发生急剧变化激活了残肝肥大发生的相关阈值,导致了残肝的肥大。已有实验研究证实部分炎性因子(如IL-6、HGF、TNF-α及TGF-β等)与残肝肥大有关[12],进一步提示通过筛选此类炎性因子及探寻其潜在机制,进而针对性开发相关药物刺激残肝肥大救治巨块型肝脏肿瘤的转化应用前景良好。另外,还应该注意到ALPPS手术存在较高的出血、胆漏以及继发性感染风险[13],可导致患者病情恶化甚至危及患者生命。本例尽管在术中尽量做到轻柔操作、低压条件下充分止血以及细致处理细小胆管,加之术前注射ICG术中导航探寻可能存在的微小胆漏以及肝脏分割间填塞止血材料,但仍未避免ALPPS手术带来的出血、胆漏,因此尚需进一步采取有效措施降低出血、胆漏以及继发性感染风险。此外,尽管ALPPS短时间能够刺激残肝肥大,但肥大的残肝能否发挥生理功能降低机体生理负荷、ALPPSⅠ期术后带瘤肝脏组织承担的肝脏生理负荷程度、带瘤和残留肝组织满足机体基本代谢的时限要求以及ALPPS术后存在的炎性持续状态对原有的以及肥大的残肝有无潜在影响等问题尚需进一步阐明。此外,ALPPS术后残肝容量与实验室检查、肝脏功能之间也可能存在差异,单纯地通过术后残肝容量评估肝脏功能稍显片面,有文献提出在ALPPSⅠ期术中采用ICG清除率来评估残肝实际功能可能有临床指导意义[14]。
ALPPS术后存在的炎性持续状态不仅对残肝起到短时间内的刺激再生作用,其对肿瘤所在病变肝脏的潜在影响需要进一步评估。本例患者ALPPSⅠ期术后第3天与第5天超声检查提示病肝肿瘤大小几乎无改变;但已有研究通过比较ALPPSⅠ期、Ⅱ期肿瘤细胞的增殖活性Ki67标记指数变化发现,Ki67标记指数在短时间内由60%增加到80%[15],提示尽管ALPPSⅠ期、Ⅱ期手术间隔时间较短,加之腹腔镜下进行门静脉右支结扎和肝脏分割最大程度地减少了对肿瘤组织的挤压。虽然ALPPS增加了巨块型肝脏肿瘤的切除概率,但也存在促进肿瘤复发转移的可能,尚需进一步大样本临床随机对照研究评估其手术根治的安全性,并观察其远期疗效。
最后,与一期肝肿瘤切除术比较,ALPPS术后患者存在较高并发症(肝功能衰竭、胆漏、感染等)发生率,其病死率也较高;两次手术间隔期间也存在肿瘤进展等问题。因此,对于小儿巨块型肝脏肿瘤患者,必须基于患者受益最大化的原则谨慎选择治疗计划和预备方案。本研究因纳入的研究病例数量有限,尚需后续纳入更多的病例进行大样本前瞻性随机对照研究,提高ALPPS作为标准术式治疗小儿巨块型肝脏肿瘤的循证医学证据级别,进一步验证全腹腔镜ALPPS治疗巨块型肝脏肿瘤的可行性、安全性。
