18F-FDG 双时相及18F-FDG 联合11C-CHO PET/CT 多模态显像在原发性肝细胞肝癌中的诊断价值
2021-08-04邬心爱邬永军王雪王城王春梅牛瑞
邬心爱 邬永军 王雪 梅 王城 王春梅 牛瑞 龙
1 内蒙古医科大学附属医院核医学科,内蒙古自治区分子影像学重点实验室,呼和浩特 010000;2 内蒙古自治区鄂尔多斯市东胜区人民医院急诊科 017000
原发性肝癌是我国常见的消化道恶性肿瘤之一,且发病率呈逐年上升趋势[1],其主要包括肝细胞肝癌(hepatocellular carcinoma,HCC)。HCC 早期多无明显的临床症状,因此影像学诊断尤为重要。原发性肝癌诊疗规范(2017 年版)[2]中指出,18F-FDG PET/CT 多部位显像对HCC 诊疗的优势:PET 功能影像不受解剖结构的影响,可准确显示结构复杂部位的病灶,评价肿瘤的恶性程度;规范中另指出,11C-胆碱(choline,CHO)PET 显像可提高诊断高分化肝癌的灵敏度,与18F-FDG PET/CT显像具有互补作用,可以更好地显示肿瘤细胞分化程度的异质性。本研究通过分析18F-FDG PET/CT双时相显像及其联合11C-CHO PET/CT 多模态显像,并与组织病理学检查及临床随访结果进行对照,探讨PET/CT 显像在HCC 诊断中的应用价值。
1 资料与方法
1.1 研究对象
回顾性分析2016 年3 月至2018 年12 月于内蒙古医科大学附属医院核医学科就诊的临床疑似原发肝占位性病变的73 例患者的临床资料,其中男性41 例、女性32 例,年龄58~72 岁;行18F-FDG PET/CT 双时相显像者47 例,行18F-FDG联合11C-CHO PET/CT 多模态显像者26 例。最终诊断以组织病理学检查或临床随访结果为“金标准”,临床随访时间为12 个月。在行PET/CT 检查前,征得患者及家属同意并签署了知情同意书。本研究符合《赫尔辛基宣言》的原则。纳入标准:临床疑似原发肝占位性病变,且超声检查、CT、MRI等征象不典型和病变解剖结构复杂等情况临床未确诊定性。排除标准:超声检查、CT、MRI 检查提示肝转移瘤或原发病变明确;肝脏病变已行治疗者。
1.2 显像方法
显像仪器为德国西门子公司的Biograph16型PET/CT 仪,正电子显像剂18F-FDG 和11C-CHO均由内蒙古自治区分子影像学重点实验室的MINItrace 型回旋加速器(美国GE 公司)生产,放射化学纯度≥95%。
18F-FDG PET/CT 显像:患者检查前禁食6 h以上,检测体重及血糖浓度,血糖浓度控制在7.0 mmol/L 以下。静脉注射18F-FDG,剂量按5.55 MBq/kg 计算。注射后患者在安静环境中平卧位休息60 min,行多部位(颅顶-股骨上段)PET/CT 显像。CT 采集参数:管电流77 mA、管电压120 kV、层厚5.0 mm、层距0.6 mm。PET 采集参数:连续进床(CBM)速度1.6 mm/s,重建方法TrueX+TOF(ultralHD-PET)。2 h 后行肝脏局部延迟显像(参数同前)。
11C-CHO PET/CT 显像:18F-FDG PET/CT 显像后隔日行11C-CHO PET/CT 显像,显像前无需特殊准备,静脉注射11C-CHO 370 MBq,10 min 后行肝脏局部PET/CT 显像,CT 及PET 采集参数同前。
1.3 图像分析
扫描获得数据进行衰减校正及迭代法重建,最终获得多部位或局部三维CT、PET、PET/CT 融合图像,并得到最大密度投影(MIP)可旋转图像。图像采集及重建完成后传输至西门子TureD 后处理工作站,由2 位有PET/CT 诊断经验的副高以上职称医师独立阅片进行定性及定量图像判读分析,意见有分歧时请示上级医师作出最终判读。
定性分析:肝脏病变的部位、大小、形态、密度及显像剂分布异常情况。
定量分析:选取病变(11C-CHO、18F-FDG 高代谢区)最大截面勾画ROI,非高代谢病变根据PET/CT 融合图像中CT 病变范围勾画ROI;同时勾画大小相同的正常肝组织,分别测量并计算每个病变的SUVmax、肝本底的SUVmax、肿瘤SUVmax/肝本底SUVmax比值(the maximum standardized uptake values ratio of tumor to liver,T/L)。18F-FDG、11C-CHO PET/CT 显像病变的SUVmax高于周围正常肝组织,即T/L>1 为阳性;二者联合显像时T/L(18FFDG 或11C-CHO)>1 为阳性。PET/CT 结果由定性分析结合定量分析最终判断得出。
1.4 统计学分析
应用SPSS 21.0 软件进行统计学分析。计量资料符合正态分布,以±s表示。所有病变及肝本底的SUVmax、T/L 及良性病变SUVmax的比较采用配对t检验,P<0.05 为差异有统计学意义。对良恶性病变间差异有统计学意义的参数绘制ROC 曲线(以病变良恶性为状态变量,分别以18F-FDG、18FFDG 延迟、18F-FDG 双时相的SUVmax和18F-FDG、11C-CHO、18F-FDG 联合11C-CHO 的SUVmax为检验变量),并计算AUC 及PET/CT 显像诊断的灵敏度、特异度和准确率等效能指标,采用Z秩和检验比较各组间ROC 曲线的差异,P<0.05 为差异有统计学意义。
2 结果
2.1 18F-FDG 双时相显像结果的比较
73 例疑似原发肝占位性病变患者均无失访。18F-FDG PET/CT 双时相显像共检47 例患者,共检出49 个病变,其中2 例为肝左右叶双病变,经组织病理学检查或临床随访结果证实,40 个病变为HCC(高分化8 个、中低分化32 个),9 个病变为良性(包括5 个血管平滑肌脂肪瘤、2 个炎性假瘤及2 个其他)。高分化HCC 病变长径为25.7~70.8(42.5±18.2) mm;中低分化HCC 病变长径为10.9~112.0 (56.5±29.6) mm。18F-FDG PET/CT显像发现27 个高代谢病变,双时相显像发现32 个高代谢病变。由表1 可知,中低分化HCC 的病变SUVmax、肝本底SUVmax和T/L 间的差异均有统计学意义(均P<0.05);高分化HCC 的病变SUVmax和T/L间的差异均有统计学意义(均P<0.05),肝本底SUVmax的差异无统计学意义(P>0.05);良性病变SUVmax的差异无统计学意义(P>0.05)。以病变良恶性为状态变量,以SUVmax(18F-FDG、18F-FDG延迟、18F-FDG 双时相)为检验变量绘制ROC 曲线(图1A),对应的AUC、95%CI、最佳阈值及诊断效能见表2。由图1A 可见,18F-FDG PET/CT 显像分别与其延迟显像、双时相显像的SUVmax的ROC曲线间的差异均有统计学意义(Z=2.315、2.376,均P<0.05);而延迟显像与双时相显像的SUVmax的ROC 曲线间的差异无统计学意义(Z=0.252,P>0.05)。
表1 49 个原发肝占位性病变的18F-FDG PET/CT 双时相显像定量指标的比较( ±s)Table 1 Quantitative indexes comparison of 49 primary liver space-occupying lesions in 18F-FDG PET/CT dual-phase imaging ( ±s)
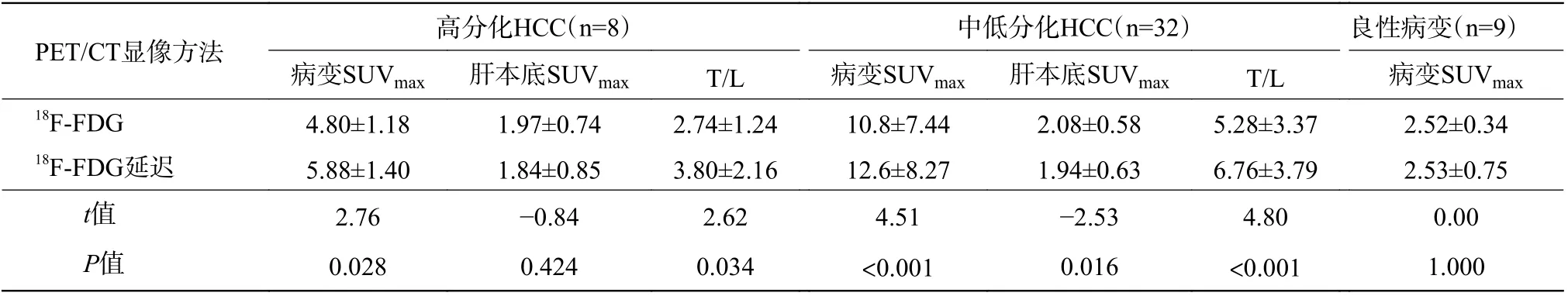
表1 49 个原发肝占位性病变的18F-FDG PET/CT 双时相显像定量指标的比较( ±s)Table 1 Quantitative indexes comparison of 49 primary liver space-occupying lesions in 18F-FDG PET/CT dual-phase imaging ( ±s)
注:FDG 为氟脱氧葡萄糖;PET/CT 为正电子发射断层显像计算机体层摄影术;HCC 为肝细胞肝癌;SUVmax 为最大标准化摄取值;T/L 为肿瘤SUVmax/肝本底SUVmax 比值
PET/CT显像方法 高分化HCC(n=8) 中低分化HCC(n=32) 良性病变(n=9)病变SUVmax 肝本底SUVmax T/L 病变SUVmax 肝本底SUVmax T/L 病变SUVmax 18F-FDG 4.80±1.18 1.97±0.74 2.74±1.24 10.8±7.44 2.08±0.58 5.28±3.37 2.52±0.34 18F-FDG延迟 5.88±1.40 1.84±0.85 3.80±2.16 12.6±8.27 1.94±0.63 6.76±3.79 2.53±0.75 t值 2.76 -0.84 2.62 4.51 -2.53 4.80 0.00 P值 0.028 0.424 0.034 <0.001 0.016 <0.001 1.000
2.2 18F-FDG 及其联合11C-CHO 显像结果的比较
18F-FDG 及其联合11C-CHO PET/CT 显像共检26 例患者,共检出26 个病变,其中,经组织病理学检查或临床随访证实,22 个为HCC(高分化9个、中低分化13 个),4 个为良性病变。高分化HCC病变长径为25.4~106.5 (56.8±28.8) mm,低分化HCC 病变长径为27.5~109.4 (63.8±29.8) mm,18FFDG PET/CT 显像发现13 个高代谢病变,18F-FDG联合11C-CHO PET/CT 显像共发现18 个高代谢病变。由表3 可见,高分化HCC 的病变SUVmax、肝本底SUVmax间的差异均有统计学意义(均P<0.001),而T/L 间的差异无统计学意义(P>0.05);中低分化HCC 的病变SUVmax间的差异无统计学意义(P>0.05),而肝本底SUVmax、T/L 间的差异均有统计学意义(均P<0.001);良性病变的SUVmax的差异无统计学意义(P>0.05)。以病变良恶性为状态变量,以SUVmax(18F-FDG、11C-CHO、18F-FDG联合11C-CHO)为检验变量绘制ROC 曲线(图1B),对应的AUC、95%CI、最佳阈值及诊断效能见表2。由图1B 可见,18F-FDG PET/CT 与18F-FDG联合11C-CHO PET/CT 的SUVmax的ROC 曲线间的差异有统计学意义(Z=2.037,P<0.05)。18F-FDG 与11C-CHO、11C-CHO 与 其 联 合18F-FDG PET/CT 的SUVmax的ROC 曲线间的差异均无统计学意义(Z=0.544、0.564,均P>0.05)。典型病例的18F-FDG、11C-CHO PET/CT 显像图见图2、3。
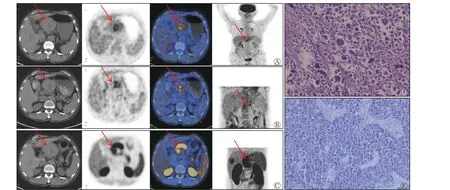
图2 肝左叶原发占位性病变患者(男性,63 岁)的18F-FDG PET/CT(A)及延迟(B)、11C-CHO PET/CT(C)显像图和组织病理学检查图A、B、C 图中由左至右依次为CT、PET、PET/CT、MIP 图像。A 中CT 图像显示肝左叶见类圆形软组织肿块影,中央见稍低密度影,大小为73.2 mm×84.6 mm(箭头所示),PET/CT 图像显示肿块中央代谢增高,SUVmax=3.9,T/L=1.64,肿块周边未见明显代谢增高;B 中PET/CT 图像显示肿块中央代谢较前增高,SUVmax=4.6,T/L=1.69,肿块周边未见明显代谢增高(箭头所示);C 中PET/CT 图像显示肿块周边半环形代谢增高,SUVmax=14.8,T/L=3.81,肿块中央未见代谢增高(箭头所示);D 为肝左叶病变中央区穿刺组织病理学检查图(苏木精-伊红染色法,×200),结果为低分化肝细胞肝癌;E 为肝左叶病变周边穿刺组织病理学检查图(苏木精-伊红染色法,×200),结果为高分化肝细胞肝癌。FDG 为氟脱氧葡萄糖;PET 为正电子发射断层显像术;CT 为计算机体层摄影术;CHO 为胆碱;MIP 为最大密度投影;SUVmax 为最大标准化摄取值;T/L 为肿瘤SUVmax/肝本底SUVmax 比值Figure 2 18F-FDG PET/CT (A) and delayed (B), 11C-CHO PET/CT (C) imaging and histopathology result of patient with primary spaceoccupying lesions in the left lobe of the liver (male, 63 years old)
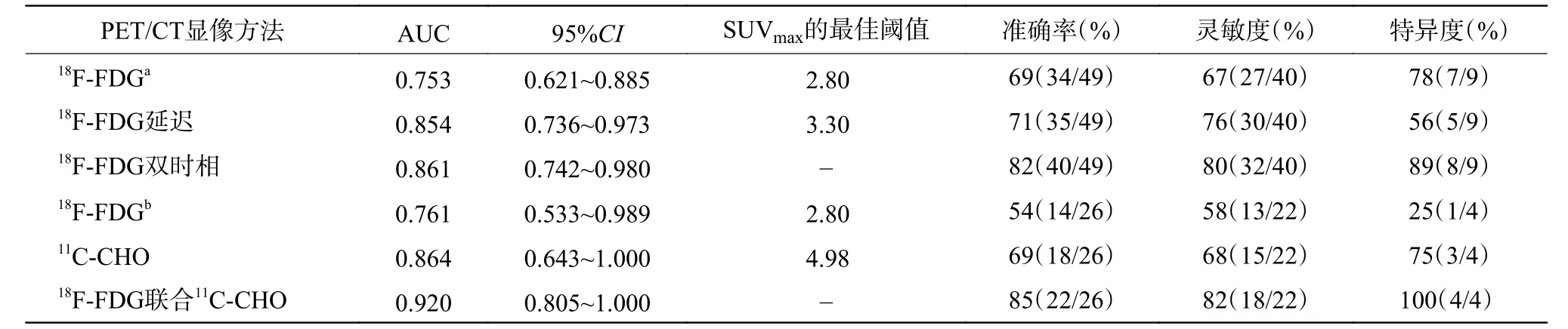
表2 不同PET/CT 显像方法诊断原发肝占位性病变良恶性的受试者工作特性曲线结果及诊断效能Table 2 Results and diagnostic efficacy of receiver operating characteristic curves for benign and malignant primary liver space-occupying lesions in different PET/CT imaging methods
表3 26 个原发肝占位性病变的18F-FDG 与11C-CHO PET/CT 显像定量指标的比较( ±s)Table 3 Comparison indexes of 26 primary liver space-occupying lesions in18F-FDG, 11C-CHO PET/CT imaging ( ±s)
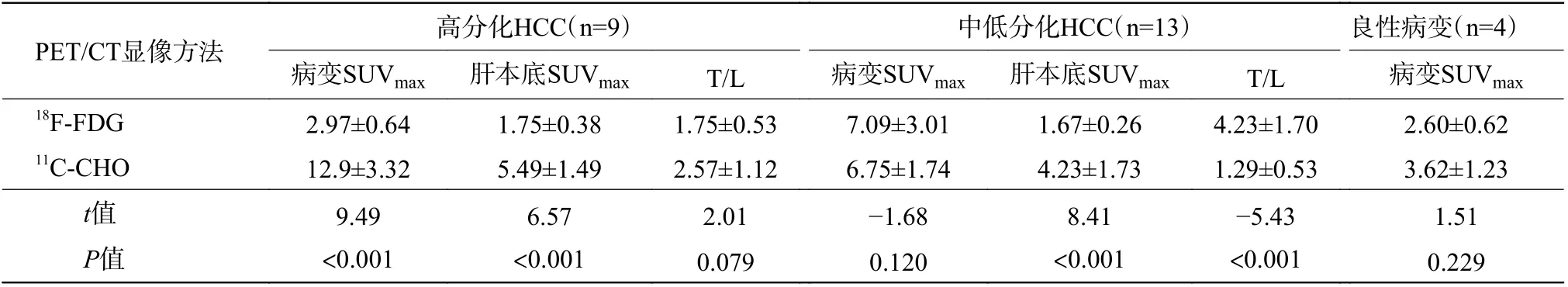
表3 26 个原发肝占位性病变的18F-FDG 与11C-CHO PET/CT 显像定量指标的比较( ±s)Table 3 Comparison indexes of 26 primary liver space-occupying lesions in18F-FDG, 11C-CHO PET/CT imaging ( ±s)
注:FDG 为氟脱氧葡萄糖;CHO 为胆碱;PET/CT 为正电子发射断层显像计算机体层摄影术;HCC 为肝细胞肝癌;SUVmax 为最大标准化摄取值;T/L 为肿瘤SUVmax/肝本底SUVmax 比值
PET/CT显像方法 高分化HCC(n=9) 中低分化HCC(n=13) 良性病变(n=4)病变SUVmax 肝本底SUVmax T/L 病变SUVmax 肝本底SUVmax T/L 病变SUVmax 18F-FDG 2.97±0.64 1.75±0.38 1.75±0.53 7.09±3.01 1.67±0.26 4.23±1.70 2.60±0.62 11C-CHO 12.9±3.32 5.49±1.49 2.57±1.12 6.75±1.74 4.23±1.73 1.29±0.53 3.62±1.23 t值 9.49 6.57 2.01 -1.68 8.41 -5.43 1.51 P值 <0.001 <0.001 0.079 0.120 <0.001 <0.001 0.229
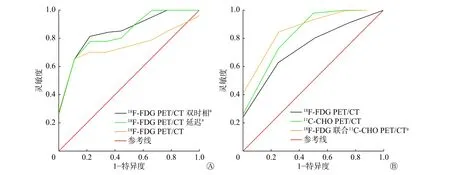
图1 不同PET/CT 显像方法诊断原发肝占位性病变良恶性的受试者工作特征曲线 a 表示与18F-FDG FDG/CT 相比,差异均有统计学意义(Z=2.376、2.315、2.037,均P<0.05)。 FDG 为氟脱氧葡萄糖;CHO 为胆碱;PET/CT 为正电子发射断层显像计算机体层摄影术Figure 1 Receiver operating characteristic curves of benign and malignant primary liver space-occupying lesions diagnosed by different PET/CT imaging methods
3 讨论
3.1 18F-FDG PET/CT 对HCC 的诊断价值
葡萄糖结构类似物18F-FDG 为PET/CT 最常用的显像剂,其基本原理是18F-FDG 通过葡萄糖转运载体大量进入肿瘤细胞,参与葡萄糖的代谢过程。肿瘤细胞与正常组织细胞具有不同的糖代谢机制,在肿瘤细胞中由于葡萄糖转运mRNA 的表达增加,葡萄糖转运蛋白(glucose transporter,Glut)-1和Glut-3 水平升高,己糖激酶水平升高,葡萄糖-6-磷酸酶水平下调等共同因素的作用,6-磷酸-FDG不能参与进一步代谢而分解,使得18F-FDG 在肿瘤细胞中聚集[3]。HCC对18F-FDG 的摄取程度与肿瘤细胞分化程度密切相关,在分化程度较高的肿瘤细胞内含有高浓度的葡萄糖-6-磷酸酶,去磷酸化水平高,可对6-磷酸-FDG 去磷酸化生成游离18F-FDG,然后释放出细胞,导致肿瘤组织内18F-FDG 含量相对较低,PET/CT 显像表现为18F-FDG 摄取接近于周围正常肝组织,与良性病变有相似表现,容易造成假阴性[4]。本研究中双时相显像的8 个高分化HCC 病变,其18F-FDG PET/CT
表现与周围正常肝组织代谢相似,32 个中低分化HCC 病变表现为明显高代谢。尽管18F-FDG PET/CT显像对HCC 诊断存在假阴性,但对阳性结果患者的治疗决策有重要指导意义。
3.2 18F-FDG PET/CT 双时相显像对HCC 的诊断价值
文献报道,18F-FDG PET/CT 诊断HCC 的假阴性率为40%~50%[5-6],本研究为了提高HCC 的检出率,增加了患者肝脏局部2 h 的延迟显像。李云等[7]的研究结果显示,18F-FDG PET/CT 早期及双时相显像诊断HCC 的阳性率分别为73.9%、90.9%。吴冰等[8]对HCC 诊断的研究结果显示,早期及延迟18F-FDG PET/CT 显像诊断HCC 的灵敏度分别为65.8%、78.9%,准确率分别为62.5%、75.0%。双时相显像可提高诊断HCC 的灵敏度和准确率,其诊断依据为炎症病变与肿瘤对18F-FDG 摄取高峰时间点不同,即良性病变随时间延长SUVmax减低或变化不明显;而恶性肿瘤随时间延长SUVmax明显升高[7]。本研究中1 例患者肝左叶病变18F-FDG PET/CT 延迟显像代谢较前增高且代谢范围也增大。延迟显像更能表现HCC 的生物学特性,对早期显像有补充作用。本研究中双时相显像诊断HCC的灵敏度由早期显像的67%提高至80%,通过18F-FDG PET/CT 双时相显像有80%的肝癌患者被确诊;有3%(1/40)的中低分化HCC 病灶延迟相的SUVmax较早期显像下降或无明显变化,其原因可能与肝癌细胞表面Glut-l 的表达过低有关。Glut-1在恶性肿瘤18F-FDG 的代谢过程中起着关键作用,而部分肝癌细胞膜上表达Glut-1 较少,因此18FFDG 显像时表现为低代谢[9]。
3.3 18F-FDG 联合11C-CHO PET/CT 对HCC 的诊断价值
18F-FDG PET/CT 显像对HCC 病变的整体检出率较低,高分化HCC 摄取18F-FDG 较少或不摄取,容易造成假阴性[10]。随着正电子显像剂的研发应用,11C-CHO 已被用于恶性肿瘤的诊断[11],如脑部肿瘤、肺肿瘤、肾肿瘤和前列腺肿瘤等。11C-CHO 是具有强亲和力的脂质示踪剂,主要用于高分化HCC 的诊断,特别是在CHO 激酶和CHO转运蛋白活性较高的肝癌中,CHO 是合成磷脂的前体,其参与肿瘤细胞膜磷脂的合成,分化程度高的肿瘤细胞在PET/CT 上表现为高代谢,常用于对HCC 诊断的补充与鉴别诊断,Castilla-Lièvre等[12]的研究结果显示,11C-CHO、18F-FDG、18F-FDG联合11C-CHO PET/CT 显像诊断HCC 的灵敏度分别为75%、36%、93%。Wu 等[13]对76 例HCC 患者的研究结果显示,48 例18F-FDG PET/CT 显像为阳性,28 例为阴性,11C-CHO PET/CT 显像的阳性率为71.4%(20/28);11C-CHO PET/CT 检测高分化HCC 患者的阳性率明显高于18F-FDG PET/CT(66.7%对35.7%,P>0.05),二者在中分化HCC检测中的灵敏度差异无统计学意义(85.7%对72.0%,P=0.648);以上2 种示踪剂联合应用较18F-FDG PET/CT显像的诊断灵敏度明显升高(89.5%对63.1%,P<0.001)。吴湖炳等[14]的另一项研究结果显示,约70% HCC 病灶无明显18F-FDG 高代谢,而11C-CHO显像为阳性,弥补了18F-FDG 显像的假阴性。章泽宇和程红岩等[15]的研究结果显示,11C-CHO PET/CT显像对肿瘤长径<2 cm 的小肝癌的阳性检测率为31.8%,且统计学结果显示,11C-CHO PET/CT 显像情况与病灶的大小无明显的相关性,这提示其可能对小肝癌的检测有帮助。因目前影像学方法对小肝癌诊断价值有限,11C-CHO PET/CT显像对小肝癌的诊断价值需进一步证实。
本研究中图2 和图3 患者肝左、右叶病变的18F-FDG、11C-CHO PET/CT 显像表现为不同高代谢区域,组织病理学检查结果证实,肝左叶病灶中央及周边分别为低分化和高分化HCC,肝右叶病变为高分化HCC,此结果证明了18F-FDG 联合11C-CHO PET/CT 应用可提高不同分化程度HCC 的检出率,充分显示了肿瘤细胞分化程度的异质性。
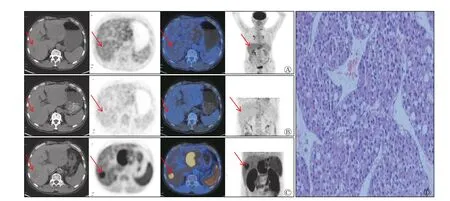
图3 肝右叶原发占位性病变患者(男性,63 岁,与图2 为同一例患者)的18F-FDG PET/CT(A)及延迟(B)、11C-CHO PET/CT 显像图(C)和组织病理学检查图A、B、C 图中由左至右依次为CT、PET、PET/CT、MIP 图像。A 中CT 图像显示肝右叶后段见类圆形低密度影,大小为31.8 mm×34.0 mm,PET/CT 图像显示代谢未见明显增高(箭头所示),SUVmax=2.4,T/L=1.00;B 中PET/CT 图像显示相应部位代谢未见明显增高(箭头所示),SUVmax=2.3,T/L=1.00;C 中PET/CT 图像显示肝右叶病变代谢明显增高(箭头所示),SUVmax=14.2,T/L=3.22;D 为肝右叶病变穿刺组织病理学检查图(苏木精-伊红染色法,×200),结果为高分化肝细胞肝癌。FDG 为氟脱氧葡萄糖;PET 为正电子发射断层显像术;CT 为计算机体层摄影术;CHO 为胆碱;MIP 为最大密度投影;SUVmax 为最大标准化摄取值;T/L 为肿瘤SUVmax/肝本底SUVmax 比值Figure 3 18F-FDG PET/CT (A) and delayed (B), 11C-CHO PET/CT imaging (C) and histopathology result of patient with primary spaceoccupying lesions in the right lobe of the liver (male, 63 years old, the same patient as Figure 2)
本研究结果证实,应用18F-FDG 联合11C-CHO PET/CT 显像,使18F-FDG PET/CT 显像诊断HCC的灵敏度由58%提高至82%,准确率由54%提高至85%,这说明联合显像对检出HCC 有重要的临床应用价值,与文献报道结果有很好的一致性[13]。
本研究尚存在不足之处,如入组病例数有限,肝脏18F-FDG PET/CT 双时相显像、18F-FDG 联合11C-CHO PET/CT 多模态显像得到满意的HCC 的诊断结果仍需继续积累充足的病例。
综上,18F-FDG PET/CT 双时相显像、18F-FDG联合11C-CHO PET/CT 多模态显像可分别提高中低及高分化原发性HCC 的准确率,对肝癌患者治疗方案决策及临床预后判定有重要的指导价值。
利益冲突本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明邬心爱负责文献的查阅、论文的撰写;邬永军负责数据的统计、指导论文的起草;王雪梅负责论文的修改与审阅;王城负责病理信息的收集、论文的修改与指导;王春梅负责临床及影像学资料的整理;牛瑞龙负责图像的采集与处理。
