99Tcm 标记lncRNA HOTAIR 反义寡核苷酸探针的制备及其对人脑胶质瘤U87 细胞活性的影响
2021-08-04任炯羽张熹张福禄冯薛烟
任炯羽 张熹 元 张福禄 冯薛烟 赵 倩
1 宁夏医科大学总医院核医学科,银川 750004;2 中南大学湘雅医学院,长沙410006;3 宁夏医科大学研究生院,银川 750004
长 链 非 编 码RNA( long non-coding RNA,lncRNA)是一类长度超过200 个核苷酸的RNA 分子,虽然大多数lncRNA 的功能尚不清楚,但近年来已有越来越多的lncRNA 的功能得到鉴定[1]。最近的研究结果表明,lncRNA 具有稳定的二级结构,可作为多种肿瘤的外周生物标志物[2]。它们在很大程度上参与细胞在转录、转录后和表观遗传水平上对基因表达的调节[3],并能通过不同机制调节细胞功能[4],例如:调节染色质动态,基因表达,细胞的生长、分化和发育[5-6]。lncRNA 的表达及突变能促进肿瘤的发生和转移,由于其在多种组织中的全基因组表达模式和组织表达特异性,lncRNA有望成为新的肿瘤生物标志物和治疗靶点[7]。同源异型盒基因转录的反义基因间RNA(homeobox gene anti-sense intergenic RNA,HOTAIR)是研究最深入的lncRNA 之一,其来源于染色体12q13.13上同源异型盒基因 C11 和同源异型盒基因 C12 之间的同源异型盒基因 C 反义链的转录,是第一个被发现具有反式调节功能的lncRNA[8-9]。一些研究结果表明,HOTAIR在不同类型的肿瘤中表达失调,例如:乳腺癌、非小细胞肺癌、肝细胞癌、胃肠道癌和结直肠癌等[4,7]。并且,HOTAIR 参与了多种与肿瘤发生相关的过程,例如:影响细胞的迁移、增殖、凋亡、侵袭、攻击和转移[10]。鉴于这些重要功能,HOTAIR被用作人类各种肿瘤的潜在生物标志物[11]。
反 义 寡 核 苷 酸( antisense oligonucleotides,ASON)是人工合成的长度为16~22 个碱基的单链DNA 类似物,通过沃森-克里克碱基配对与靶基因结合,可以导致核酸内切酶介导的转录本被敲除,以致靶基因沉默[12-13]。ASON 可以高效、特异、不可逆地与靶基因互补结合,但标记后的探针能否进入胶质瘤细胞与HOTAIR 特异性结合并影响细胞功能尚不明确。因此,本研究通过制备放射性核素标记的靶向lncRNA HOTAIR 的ASON 探针99Tcm-HYNIC-ASON[HYNIC 为联肼尼克酰胺(hydrazino nicotinamide)],在细胞水平上研究其对人脑胶质瘤U87 细胞增殖和迁移能力的影响,为HOTAIR 在胶质瘤中的应用提供良好的理论支持。
1 材料与方法
1.1 主要材料与仪器
长度为19 个碱基的ASON 探针购自上海生工生物工程股份有限公司,并进行化学合成和修饰。人脑胶质瘤U87 细胞购自中国科学院上海细胞库;99Tcm-高锝酸盐溶液购自北京原子高科技术股份有限公司;HYNIC 购自美国TriLink 公司;交联葡聚糖凝胶(Sephadex) G25 购自美国GE 公司;脂质体Lipofectamine 2000 购自美国Invitrogen 公司;Tricine 购自美国Sigma-Aldrich 公司;DMEM培养基、胎牛血清购自西安励合生物有限公司;细胞计数试剂盒8(cell counting kit-8,CCK-8)购自美国APExBIO 公司。超滤管购自德国Sartorius 公司;MR-96A 酶标仪购自美国 Thermo 公司;GC-1200 型 γ 放射免疫计数器购自中国计量科学研究院;1645050 PowerPac Basic 基础电泳仪购自美国Bio-Rad 公司。
1.2 ASON 的合成与修饰
设计与HOTAIR 片段完全互补的ASON 序列:5′-AATTCTTAAATTGGGCTGG-3′,序列两端分别进行2′-O-甲基化修饰,两端各有2 个碱基进行硫代修饰以提高稳定性。5′端连接NH2C6,即合成结构式为 3′-ASON-NH2C6-5′,具体见图1,HYNIC 与Tricine 共同偶联99Tcm。
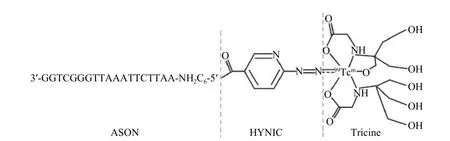
图1 99Tcm - HYNIC -ASON 探针的结构式 HYNIC 为联肼尼克酰胺;ASON 为反义寡核苷酸Figure 1 Structure of 99Tcm-hydrazine nicotinamide-antisense oligonucleotides
1.3 99Tcm-HYNIC-ASON 探针的制备
取1 mg HYNIC 溶于 100 μL N,N-二甲基甲酰胺(DMF)溶液,浓度10 mg/mL。将0.2 mg ASON溶于50 μL 缓冲液(2 mol/L NaCl、0.5 mol/L NaHCO3、2 mmol/L 乙二胺四乙酸)中。将HYNIC 和ASON以摩尔比为25∶1 的比例混合,避光反应1~2 h。反应结束后加入60%甲醇至总体积为500 μL,置于超滤管中以15 000×g离心10 min(保证离心后体积<50 μL)。随后向离心后反应物中依次加入100 μL Tricine (100 mg/mL)、20 μL 新鲜淋取的99Tcm-高锝酸盐溶液(111 MBq),最后加入4 μL 新鲜配置的SnCl2·2H2O(1 mg/mL)溶液,混匀,避光反应60 min。反应完毕后用Sephadex G25 分离纯化,每管收集5 滴(约0.6 mL)洗脱液,分别测定每管的放射性活度和核酸浓度,并绘制曲线。取高峰管以备后续实验。
1.4 99Tcm-HYNIC-ASON 探针的稳定性检测
将99Tcm-HYNIC-ASON 分别于室温(25℃)、37℃条件下在生理盐水和新鲜人血清中孵育(探针与血清或生理盐水的体积比为1∶1),于0、2、4、6、8、12 h 时 采 用 快 速 薄 层 层 析(instant thin layer chromatography,ITLC)法测定放射化学纯度。
1.5 琼脂糖凝胶电泳实验鉴定探针的完整性
配置1%的琼脂糖凝胶,依次加入稀释的ASON 样品、99Tcm-高锝酸盐溶液、纯化前的99Tcm-HYNIC-ASON、纯化后的99Tcm-HYNIC-ASON。采用电压120 V,电泳20 min,于紫外光下观察条带。
1.6 细胞培养及转染
将人脑胶质瘤U87 细胞培养在含15%胎牛血清、1%青霉素和链霉素混合液的高糖DMEM 培养基中,放置于37℃、5% CO2的培养箱中培养24 h,待细胞密度达到90%进行传代。
配制转染混合液A:取10 μg 纯化后的99Tcm-HYNIC-ASON 加入500 μL 无血清、无青霉素和链霉素混合液的DMEM 培养基;配制转染混合液B:取25 μL Lipofectamine 2000 加 入475 μL DMEM培养基中,温和震荡后室温放置5 min。随后将混合液A、B 混匀,室温放置20 min 得到脂质体包裹的99Tcm-HYNIC-ASON(即Lipo-99Tcm-HYNIC-ASON)。将人脑胶质瘤U87 细胞按每孔1.2×106个接种于六孔板中,培养24 h 后每孔加入100 μL Lipo-99Tcm-HYNIC-ASON,于37℃培养箱中培养6 h,随后吸弃培养基,换为含15%胎牛血清的DMEM 培养基,培养24~48 h 完成转染。
1.7 细胞摄取实验
将处于对数生长期的人脑胶质瘤U87 细胞按每孔1×105个接种于12 孔板中。在无青霉素和链霉素混合液、含10% 胎牛血清的DMEM 培养基中培养过夜。细胞摄取实验分为2 组:Lipo-99Tcm-HYNIC-ASON 组(转染组)和99Tcm-HYNIC-ASON组(未转染组)。转染组每孔加入200 μL DMEM培养基、500 ng99Tcm-HYNIC-ASON(37 kBq)和3 μL Lipofectamine 2000,混匀完成转染;未转染组 每 孔 加 入200 μL DMEM 培 养 基 和500 ng99Tcm-HYNIC-ASON(37 kBq),混匀。将2 组细胞放置于37℃培养箱中培养,分别于加样后1、2、3、4、5、6 h 时收集一孔培养液于EP 管中,100 μL PBS 冲洗3 遍,收集到同一EP 管中,标记为Cout;用含乙二胺四乙酸的胰酶消化细胞,每孔用100 μL PBS 冲洗3 遍,收集到同一EP 管中,标记为Cin。采用γ 放射免疫计数器检测Cin 及Cout的放射性计数,计算各个时间点细胞对探针的摄取率,细胞摄取率=Cin 的放射性计数/(Cin 的放射性计数+Cout 的放射性计数)×100%。
1.8 CCK-8 实验检测细胞的增殖能力
收集对数生长期的人脑胶质瘤U87 细胞接种于96 孔板中,每组设5 个复孔,待细胞密度达到60%,分为3 组:Lipo-99Tcm-HYNIC-ASON 组(转染组)、99Tcm-HYNIC-ASON 组(未转染组)、99Tcm-Control 组(对照组),并分别处理细胞(转染组6 h 时换一次液)。根据CCK-8 试剂盒说明书操作,将细胞培养1~5 d,每天于同一时间点加入CCK-8。为避免误差,每孔分别加入无血清、无青霉素和链霉素混合液的DMEM 培养基稀释的CCK-8 110 μL(无血清、无青霉素和链霉素混合液的DMEM 培养基100 μL、CCK-8 10 μL),于37℃、5% CO2培养箱中孵育2.5 h 后,用酶标仪检测450 nm 处的吸光度(A450值)。
1.9 细胞划痕实验评估细胞的迁移能力
按“1.8”小节中分组将细胞按每孔1.2×106个接种于6 孔板中并分别进行处理,待细胞密度达到90%时,吸弃孔内培养基,用200 μL 枪头垂直在6 孔板中央划线,PBS冲洗2 遍洗去被划下的细胞,加入无血清培养基继续培养。记录培养细胞0、24 h 时的划痕面积,计算细胞间隙融合率,细胞间隙融合率=(0 h 划痕面积-24 h 划痕面积)/0 h划痕面积×100%。
1.10 统计学分析
应用SPSS 22.0 软件进行统计学分析。计量资料 符 合 正 态分 布以±s表 示,2 组 间 比 较 采 用Studentt检验(方差齐性),多组间比较采用单因素方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 99Tcm-HYNIC -ASON 探针的制备结果
由图2 可见,纯化前(图2B)与纯化后(图2C)的99Tcm-HYNIC-ASON 的放射性滞留在同一位置。ITLC 法测得探针的标记率为(90.0±5.6)%。
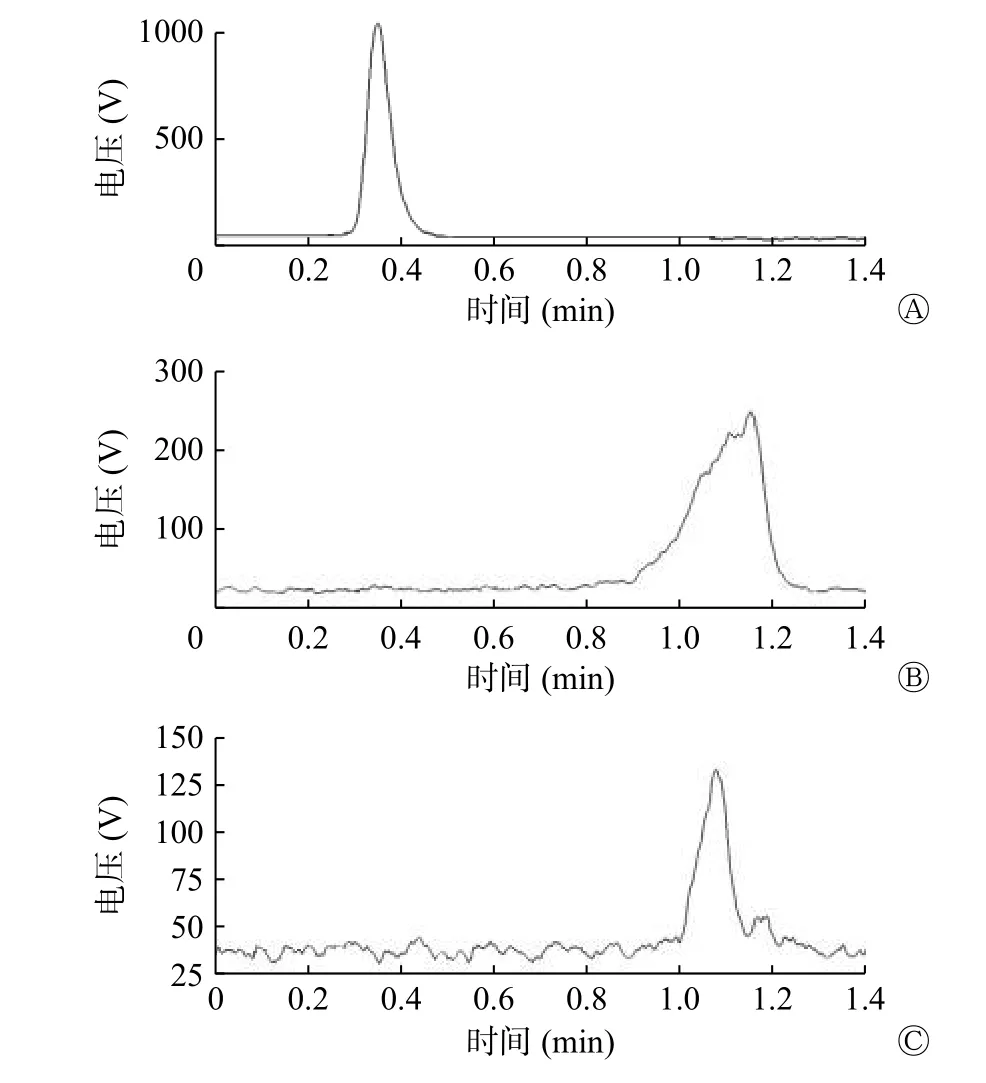
图2 99Tcm-HYNIC-ASON 探针的快速薄层层析图谱 A 为99Tcm-高锝酸盐溶液;B 为探针纯化前;C 为探针纯化后。HYNIC 为联肼尼克酰胺;ASON 为反义寡核苷酸Figure 2 Instant thin layer chromatography of 99Tcm-hydrazine nicotinamide-antisense oligonucleotides
2.2 纯化物的放射性活度及核酸浓度
分离纯化99Tcm-HYNIC-ASON 共收集到洗脱液15 管,纯化物的放射性活度及核酸浓度见图3。由图3B 可见,未结合的ASON 片段经1~5 管过滤掉;5~10 管为99Tcm-HYNIC-ASON,与图3A 的放射性活度峰值相符。
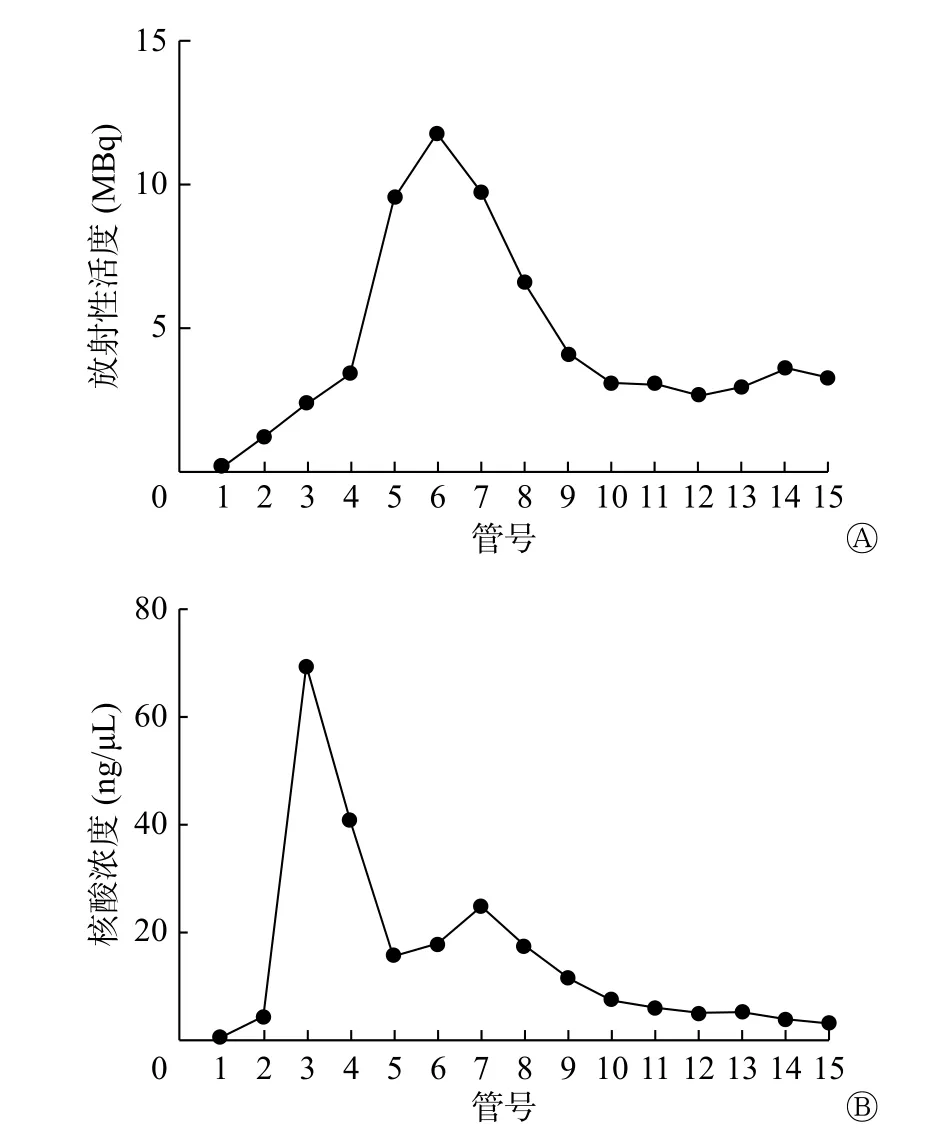
图3 99Tcm-HYNIC-ASON 探针分离纯化后收集每管的放射性活度(A)及核酸浓度(B) HYNIC 为联肼尼克酰胺;ASON为反义寡核苷酸Figure 3 Radioactivity (A) and nucleic acid concentration (B)of 99Tcm-hydrazine nicotinamide-antisense oligonucleotides after purified
2.3 99Tcm-HYNIC-ASON 探针的稳定性和完整性
由图4A 可见,99Tcm-HYNIC-ASON 探针12 h的放射化学纯度达80%以上,在生理盐水及新鲜人血清中的放射化学纯度无明显差别;由图4B 可见,99Tcm-HYNIC-ASON 探针在纯化前后都显示亮的条带,这说明探针具有完整性并且没有发生明显降解和脱靶。
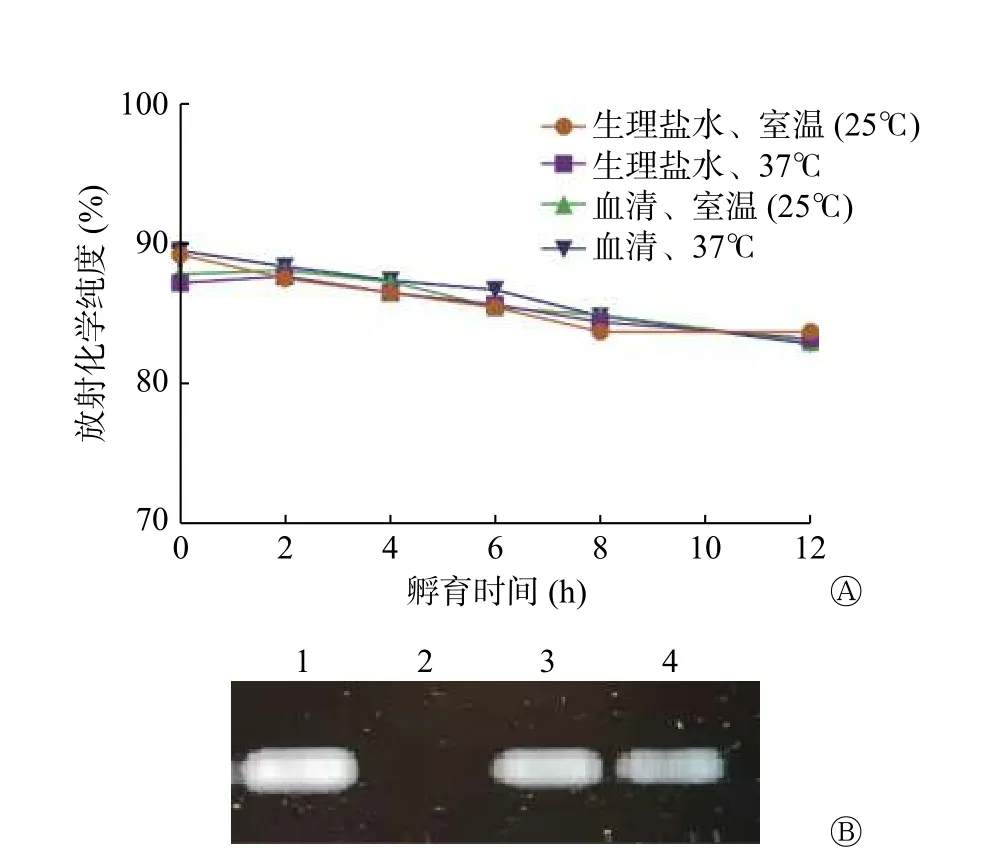
图4 99Tcm-HYNIC-ASON 探 针 的 稳 定 性 和 完 整 性 A 为99Tcm-HYNIC-ASON 于室温(25℃)和37℃条件下分别与生理盐水和新鲜人血清孵育不同时间点的放射化学纯度;B 为琼脂糖凝胶电泳实验检测探针的完整性(1~4 泳道依次为ASON 样品、99Tcm-高锝酸盐溶液、纯化前的99Tcm-HYNICASON、纯化后的99Tcm-HYNIC-ASON)。HYNIC 为联肼尼克酰胺;ASON 为反义寡核苷酸Figure 4 Stability and integrity identification of 99Tcm-hydrazine nicotinamide-antisense oligonucleotides
2.4 细胞摄取实验结果
由图5 可见,在1 h 后的任一时间点,转染组对Lipo-99Tcm-HYNIC-ASON 的细胞摄取率均高于未转染组对99Tcm-HYNIC-ASON 的细胞摄取率,且差异均有统计学意义(均P<0.01)。转染后5 h,Lipo-99Tcm-HYNIC-ASON 在人脑胶质瘤U87 细胞中的摄取率最大(0.70%),与未转染组(0.16%)相比,差异有统计学意义(t=17.81,P<0.01)。 而未转染组细胞最大摄取率出现在6 h 时,仅为0.20%。
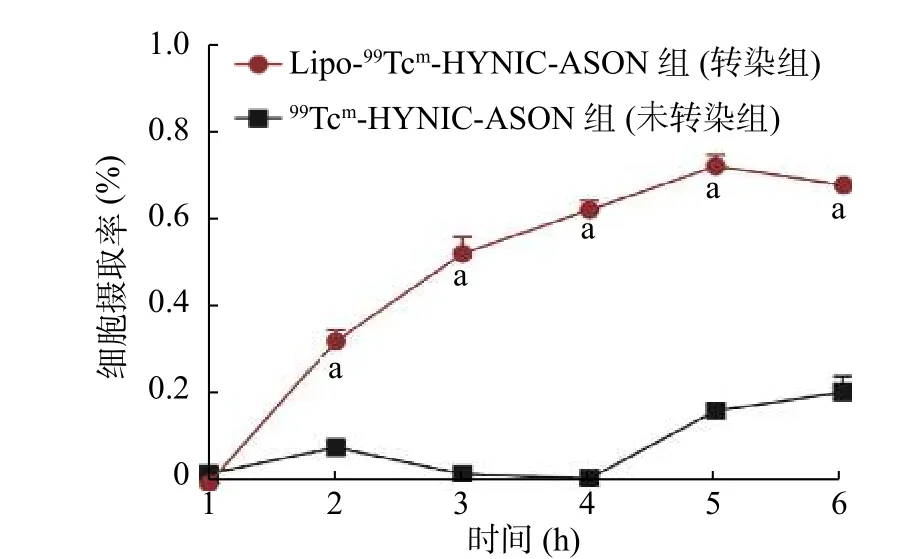
图5 转染Lipo-99Tcm-HYNIC-ASON 后不同时间点人脑胶质瘤U87 细胞的摄取率 a 表示与未转染组相比,差异均有统计学意义(t=15.60~21.56,均P<0.01)。HYNIC 为联肼尼克酰胺;ASON 为反义寡核苷酸Figure 5 Human glioma U87 cell uptake rates after transfection of Lipo-99Tcm-hydrazine nicotinamide-antisense oligonucleotides at different times
2.5 CCK-8 实验结果
由图6 可见,与未转染组和对照组相比,在转染后1、2、3、4、5 d,转染组吸光度均较低,这说明Lipofectamine 2000 可以有效地使探针进入细胞并抑制细胞的增殖能力,在各个时间点,转染组与未转染组相比,吸光度的差异均有统计学意义(均P<0.05)。
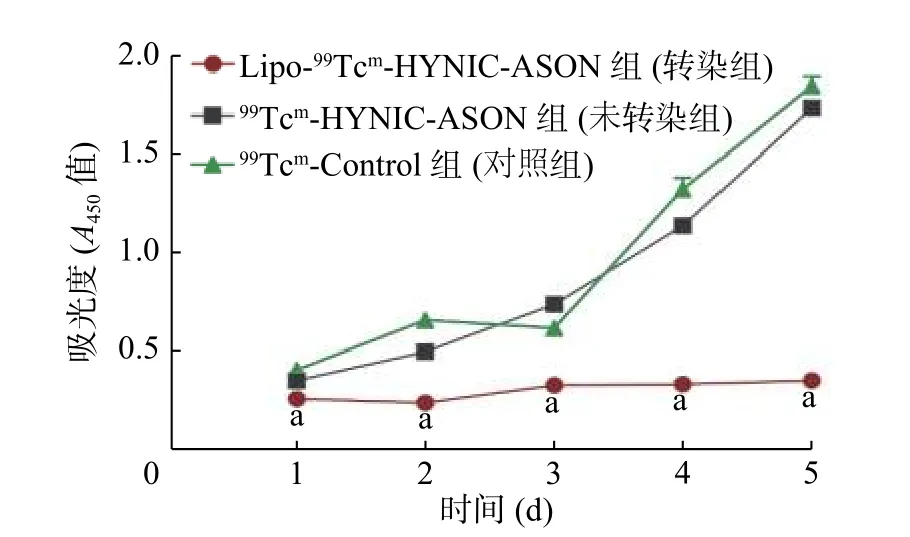
图6 转染Lipo-99Tcm-HYNIC-ASON 后不同时间点人脑胶质瘤U87 细胞的增殖能力 a 表示与未转染组相比,差异均有统计学意义(t=2.336~30.230, 均P<0.05)。HYNIC 为联肼尼克酰胺;ASON 为反义寡核苷酸Figure 6 Human glioma U87 cell proliferation after transfection of Lipo-99Tcm-hydrazine nicotinamide-antisense oligonucleotides at different times
2.6 细胞划痕实验结果
由图7 可见,转染Lipo-99Tcm-HYNIC-ASON 24 h 后细胞迁移能力下降,这说明Lipofectamine 2000 转染可以有效地使探针进入细胞并抑制细胞的迁移。3 组细胞间隙融合率的差异有统计学意义(F=331.8,P<0.01),与未转染组相比,转染组细胞间隙融合率明显降低,且差异有统计学意义(60.0%对23.6%,t=51.54,P<0.01)。
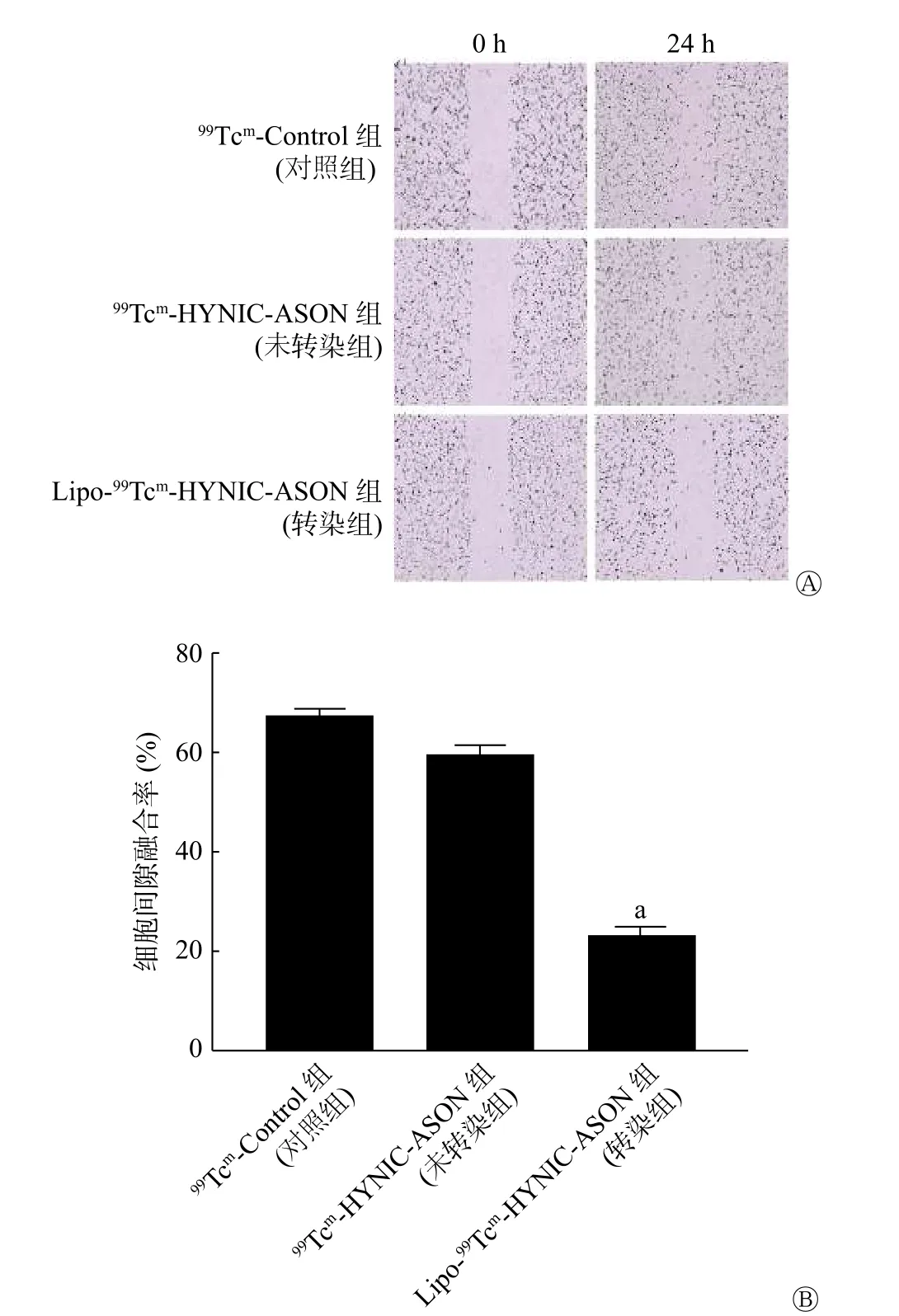
图7 转染Lipo-99Tcm-HYNIC-ASON 后人脑胶质瘤U87 细胞的迁移能力 A 为细胞划痕实验结果;B 为3 组细胞间隙融合率的比较结果(F=331.8,P<0.01)。a 表示与未转染组比较,差异有统计学意义(t=51.54, P<0.01)。HYNIC 为联肼尼克酰胺;ASON 为反义寡核苷酸Figure 7 Human glioma U87 cell migration after transfection of Lipo-99Tcm-hydrazine nicotinamide-antisense oligonucleotides
3 讨论
鉴于HOTAIR 在胶质瘤及其他恶性肿瘤中的特异性高表达,利用放射性核素标记与HOTAIR特异性结合的ASON 探针对胶质瘤的早期发现具有重要意义。本研究成功地利用HYNIC 螯合99Tcm标记靶向HOTAIR 的ASON。本研究制备探针的标记率高且12 h 内血清稳定性较好,经凝胶电泳鉴定没有发生明显的降解;细胞实验结果显示,经脂质体转染的探针可以更有效地进入细胞,并抑制人脑胶质瘤U87 细胞的增殖和迁移。
在标记实验中,首先,由于HYNIC 只有1 个或2 个99Tcm的结合位点,因此选用Tricine 为协同配体,2 个分子提供的位点可以与99Tcm形成稳定的复合物,获得较高的标记率。其次,为保护ASON 免 受 RNA 酶 的 降 解,在ASON 探 针 两 端各3 个碱基分别进行甲基化及硫代修饰,以增加其体内外稳定性。再次,与其他文献[14-16]报道的标记方法相比,我们采用自配的缓冲液(2 mol/L NaCl、0.5 mol/L NaHCO3、2 mmol/L 乙二胺四乙酸)代替碳酸氢盐缓冲液,同时提高HYNIC 与ASON 的摩尔比为25∶1,并用超滤管过滤未结合的ASON 片段。结果显示,99Tcm-HYNIC-ASON 的标记率为(90.0±5.6)%,并且没有发生明显的降解。然而,ITLC 法结果显示,99Tcm-高锝酸盐溶液中大部分99Tcm被氧化为胶体99Tcm,不能被SnCl2·2H2O还原,反应物经Sephadex G25 分离纯化后,大部分未结合的ASON 片段提前滤出,因此新鲜淋取的99Tcm对标记率有较大影响。
影响ASON 探针结合的主要因素之一是放射性标记的ASON 探针在细胞内的摄取率低[17]。脂质体可以通过静电相互作用将带负电荷的ASON包裹起来,这样亲脂性的ASON 就可以很容易地穿过细胞膜。在细胞内部,脂质体破坏了内小体的捕获,使得ASON 能够逃逸到细胞质中,与其目标mRNA 结合[18-19]。此外,脂质体还能增强探针的核定位[20]。我们选择Lipofectamine 2000 作为载体,在细胞摄取实验中,Lipo-99Tcm-HYNIC-ASON的摄取率由0.02%上升至0.70%,而未转染组6 h内最大摄取率仅为0.20%。另外,细胞划痕实验结果显示,转染组24 h 细胞间隙融合率明显低于未转染组。CCK-8 实验结果也显示,与未转染组相比,转染组细胞增殖能力明显下降。以上结果证明,脂质体能有效包裹探针穿过细胞膜进入细胞并抑制细胞的增殖及迁移能力。
本研究存在一些不足之处:(1)99Tcm与ASON片段的结合率还有待提高,目前可以采用的方法是选用新鲜淋取的99Tcm-高锝酸盐溶液和新鲜配置的SnCl2·2H2O 溶液并尽快将二者混合;(2)探针的放射化学纯度相对偏低,可以进一步改进标记方法,例如通过改变99Tcm-高锝酸盐溶液体积、SnCl2·2H2O浓度以及反应时间等进行改善[21]。
综上所述,99Tcm标记的靶向HOTAIR 的ASON探针99Tcm-HYNIC-ASON 具有较高的标记率和体外稳定性,经脂质体转染后可以进入人脑胶质瘤U87 细胞并发挥抑制作用,为U87 荷瘤裸鼠的肿瘤反义显像的应用提供了良好的实验基础。
利益冲突本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明任炯羽负责实验的实施、论文的撰写与修订;张熹元、冯薛烟负责实验的实施;张福禄负责方法的建立;赵倩负责方法的建立、论文的审阅。
