血栓弹力图监测下应用微量肝素治疗小儿脓毒症疗效及不良反应评价
2021-08-02林浩铨郭予涛黄楚君王宪耀林明祥
林浩铨,郭予涛,黄楚君,王宪耀,林明祥
0 引言
脓毒症是小儿重症监护室(Pediatric intensive care unit,PICU)最常见的危重病之一,病死率高达30%~60%。由于凝血和炎症之间存在“交叉对话”,凝血障碍不仅是脓毒症导致的多器官功能障碍综合征(Multiple organ dysfunction syndrome,MODS)在凝血系统的表现,也是脓毒症患者发生MODS的启动因素之一,形成恶性循环[1]。35%脓毒症患者继发弥散性血管内凝血(Disseminated intravascular coagulation,DIC),导致微循环灌注及器官功能障碍,直接影响预后[2]。近年研究发现,微量肝素除传统抗凝作用外,还具有抗炎症反应、保护血管内皮等作用,其在脓毒症中的应用价值受到关注[3]。血栓弹力图通过测定血栓形成速度、强度和溶解过程,实时全面反映凝血和纤溶过程的全貌,而传统凝血检测只能反映凝血或纤溶的部分过程。研究证实,血栓弹力图(Thromboelastography,TEG)能更有效地监测脓毒症患者凝血功能改变,识别高凝、低凝状态[4]。本研究对脓毒症患儿除常规液体复苏及器官功能支持外,早期应用微量肝素干预,同时应用TEG进行监测,探讨微量肝素在小儿脓毒症救治中的疗效、不良反应和TEG的辅助检查价值。
1 资料和方法
1.1 研究对象及分组 采用前瞻性研究方法,2017年1月1日至2020年5月15日收入汕头市中心医院PICU患儿共679例,其中脓毒症75例,符合本研究纳入标准脓毒症患儿共46例,随机分为干预组20例,对照组26例。两组均常规予液体复苏、抗感染、器官功能支持等,干预组采用微量肝素5~10 U/(kg·h),生命体征稳定或出血倾向严重时停用肝素,肝素使用时间5 d。根据儿童危重症评分(Pediatric clinical illness scores,PCIS)分为极危重组(PCIS≤70)、危重组(PCIS≤80)、普通组(PCIS>80)。
1.1.1 入选标准 ①1个月~14岁;②脓毒症诊断符合儿童脓毒性休克(感染性休克)诊治专家共识(2015版)诊断标准。
1.1.2 排除标准 ①先天性凝血功能障碍;②长期使用抗凝药物(肝素、华法林、抗凝血酶等)者;③血液系统肿瘤及造血干细胞移植后患者;④肝脏疾病及肝脏移植后患者;⑤明显出血倾向。
1.1.3 疗效评价 患者临床症状及体征恢复正常,血常规、炎症指标、器官功能指标、凝血功能正常以及影像学改变恢复正常为临床痊愈;上述指标未完全恢复正常为好转;住院期间病情加重自动出院,结局未明为恶化。
1.1.4 伦理学 本研究符合医学伦理学标准,经医院伦理委员会的批准(编号:科研[2016]017号),已获得患者和(或)家属的知情同意。
1.2 观察指标及方法
1.2.1 常规辅助检查项目 治疗前后采集血常规、部分器官功能[尿素(BUN)、肌酐(Cr)、丙氨酸氨基转移酶(ALT)、总胆红素(TB)、氧合指数(P/F)]、炎症指标(hs-CRP、PCT)、传统止凝血功能[凝血酶原时间(PT)、活化部分凝血酶原时间(APTT)]。
1.2.2 PCIS评分 治疗前(D1)、治疗后(D7)根据患儿的心率、血压、呼吸、动脉血氧分压(PaO2)、pH、血钠、血钾、Cr或BUN、血红蛋白浓度(Hb)、胃肠功能等情况进行评分。
1.2.3 TEG检测 TEG 检测采用乐普CFMS LEPU-8800型凝血分析仪及TEG检测盒,检测凝血反应时间(R值)、血块生成时间(K值)、血块生成率(α角)、最大宽度值(MA值)、凝血综合指数(CI值)等。
1.3 统计学分析 应用SPSS 22.0软件对数据进行统计分析,正态分布计量资料以“均数±标准差”表示,非正态分布的计量资料以M(P25~P75)表示,组间比较采用Mann-Whitney检验;计数资料以频数表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料及治疗前止凝血功能、器官功能参数、PCIS、血小板、炎症指标、TEG比较 46例脓毒症患儿中,男30例,女16例;年龄1个月~13岁,平均(1.60±0.99)岁;血流感染11例,肠道感染20例,肺部感染7例,中枢系统感染6例,蜂窝织炎1例,重症EB病毒感染1例;并发脓毒性休克30例,合并DIC 10例,脓气胸1例。根据儿童危重症评分(PCIS)分为极危重组(PCIS≤70)26例、危重组(PCIS≤80)14例、普通组(PCIS>80)6例。两组患者性别、年龄、PCIS评分间的差异无统计学意义(P>0.05)。两组治疗前的传统止凝血功能(PT、APTT)、器官功能参数(BUN、Cr、ALT、TB、P/F)、PCIS评分、PLT、炎症指标(hs-CRP、PCT)、血栓弹力图参数(CI、R、k值、α角、MA、LY30、EPL)比较差异无统计学意义(P>0.05),具有可比性。见表1。
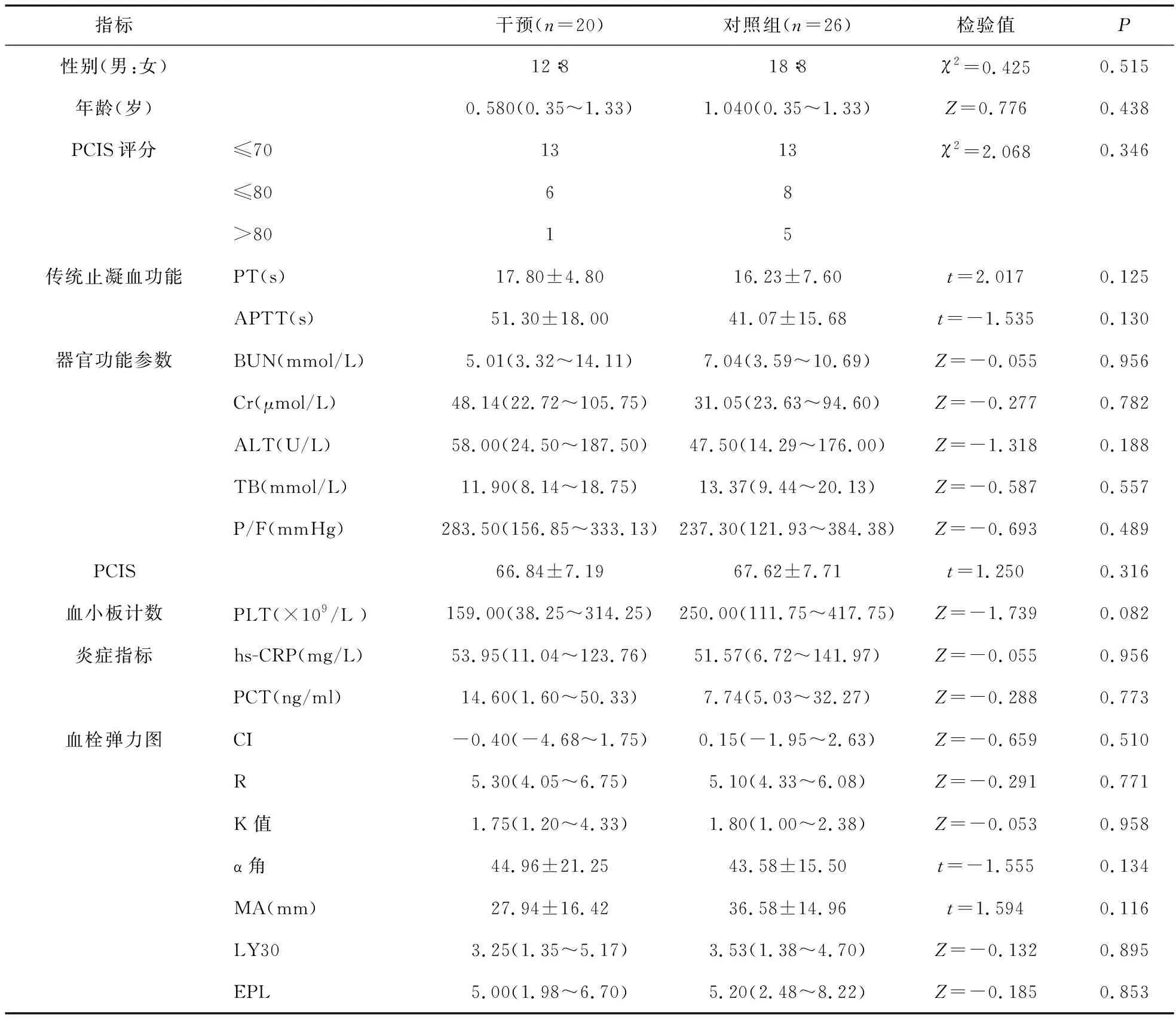
表1 两组患儿人口学资料及治疗前传统止凝血功能、器官功能参数、PCIS、血小板、炎症指标、TEG比较
2.2 治疗后两组患儿各项指标比较 治疗后,两组传统止凝血功能(PT、APTT)、器官功能参数(BUN、Cr、ALT、TB、P/F)、PCIS评分、血小板计数、炎症指标(hs-CRP、PCT)、血栓弹力图参数(CI、R、K值、α角、MA、LY30、EPL)差异无统计学意义(P>0.05)。见表2。对照组治疗后出血15例(15/26),与干预组比较差异无统计学意义(χ2=1.423,P=0.376)。
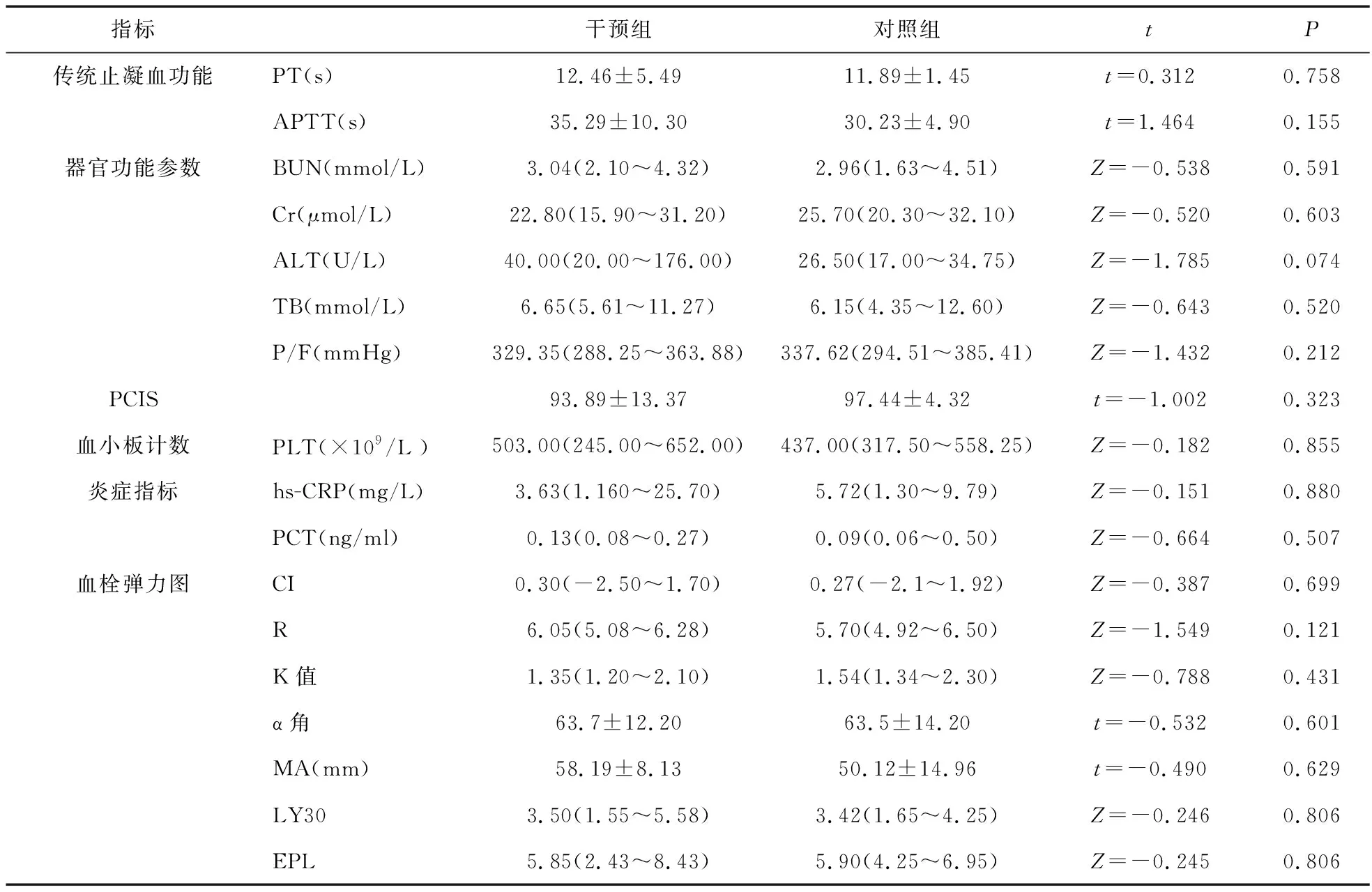
表2 两组患儿治疗后传统止凝血功能、器官功能参数、PCIS、血小板计数、炎症指标、TEG比较
2.3 干预组治疗前后各项指标变化 干预组治疗前后PT、APTT、BUN、Cr、TB、PCIS、PLT、hs-CRP、PCT、α角、MA值比较,差异有统计学意义(P<0.05),提示治疗后干预组传统止凝血功能、肾功能、PCIS评分、炎症反应情况有改善,见表3。用药前干预组出血例数12例(12/20),用药后13例(13/20),差异无统计学意义(χ2=1.129,P=0.288)。

表3 干预组患儿治疗前后传统止凝血功能、器官功能参数、PCIS、血小板计数、炎症指标、TEG比较
2.4 不同PCIS评分出血情况比较 纳入本研究的脓毒症患儿总出血率为60.1%(28/46),以消化道出血及皮肤瘀斑为主。极危重组(PCIS≤70)出血发生率高达76.9%(20/26),三组间比较差异有统计学意义(χ2=8.435,P=0.015),提示随病情加重,凝血障碍发生率明显升高。传统止凝血功能异常占43.5%(20/46),血栓弹力图异常病例占84.6%(22/26),TEG提示高凝状态9例,消耗性低凝状态7例,继发性纤溶亢进1例,血小板活性升高5例。见表4。
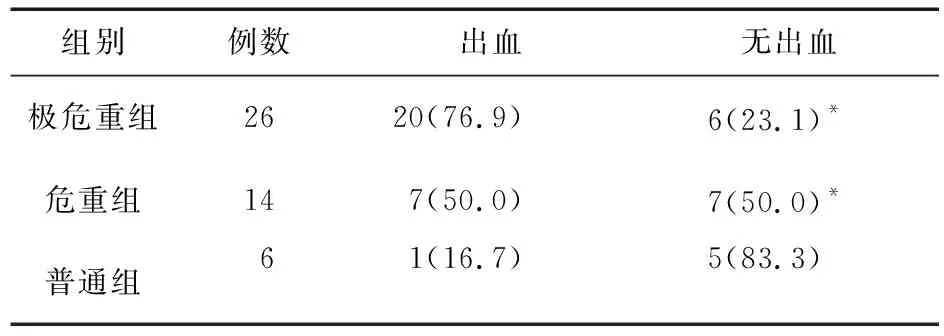
表4 不同PCIS评分组出血情况[例(%)]
2.5 两组预后比较 两组预后情况显示,干预组痊愈率(50.00%)及好转率(45.00%)均高于对照组(均为38.46%),死亡率(5.00%)低于对照组(15.38%),但差异无统计学意义(χ2=3.123,P=0.373)。见表5。

表5 两组患者预后比较[例(%)]
3 讨论
正常生理情况下,血管内皮作为微循环的核心组成部分,维持抗凝和抗炎的平衡,当感染等因素诱发脓毒症时,炎症因子风暴导致内皮细胞损伤并出现功能障碍,继而诱发器官功能障碍甚至衰竭[5]。脓毒症过程中,由于炎症系统和凝血系统之间的交叉对话,导致凝血系统和抗凝系统间的失衡,凝血障碍是脓毒症特征之一。
PCIS是适合我国国情、国内目前最常用的儿童危重症评分工具之一,广泛用于PICU患儿病情严重程度评估,与器官功能衰竭及病死率有很好的相关性[6]。本研究显示,脓毒症患儿极危重组出血发生率高达76.9%,总出血率60.1%,以消化道出血及皮肤瘀斑为主,无肢端坏死,提示随病情加重,凝血障碍发生率明显升高。
血栓弹力图主要包括以下参数:凝血指数(CI)主要反映凝血总体情况;凝血时间(R)主要反映凝血启动至纤维蛋白凝块形成之间的潜伏期,与所有凝血因子活性有关;血块强度参数MA是纤维蛋白凝块最终强度,主要反映血小板和纤维蛋白功能;血块稳定性参数LY30,MA出现后30 min血块消融比例;预测纤溶指数EPL即MA出现后预测血块消融能力,LY30和EPL是机体纤溶活性指标,血块动力参数K值及α角:K值为血凝块强度达到20 mm时的时间;α角体现纤维蛋白凝块形成及其联结速度,K值和α角均与纤维蛋白原活性有关。相比传统凝血功能检查如APTT、PT等,TEG能更好地反映机体凝血全貌,更好地指导临床用药[7]。研究显示,TEG较传统凝血功能检测,可早期发现脓毒症凝血紊乱[8]。项龙等[9]的临床研究显示,TEG呈持续低凝状态可反映患儿脓毒症和MODS严重程度,并对预测脓毒症预后有参考价值。本研究显示,传统止凝血功能异常占45.5%,血栓弹力图异常病例占84.6%,TEG提示高凝状态9例,消耗性低凝状态7例,继发性纤溶亢进1例,血小板活性升高5例,提示入院时因起病时间不同或疾病进展速度不同,患儿凝血功能障碍处于不同阶段,提示TEG为传统凝血功能检查的重要补充。
脓毒症早期,炎症风暴和内皮损伤后启动凝血系统,形成免疫血栓,为机体针对病原体重要的早期防御机制,可防止病原侵入组织及播散、并有利于机体免疫清除作用[10]。但另一方面,广泛微循环血栓形成导致微循环衰竭及重要内脏器官如心肺脑等灌注不足,继而发生休克及多器官功能衰竭、弥散性血管内凝血(DIC),因此抗凝药物的使用及时机受到关注,肝素作为最常见抗凝药物之一,已广泛用于临床。肝素主要通过与抗凝血酶III(AT)结合,改变AT的精氨酸结合位点,提高AT对凝血酶的抑制效能1 000倍以上[11]。近年来,肝素除了抗凝作用,其他药理作用也被证实,包括:①免疫调节:抑制炎症反应、抑制血小板活化、抑制白细胞募集、抑制脂多糖诱导的炎症介质等[12];②保护及修复内皮细胞表面糖萼作用:糖萼是内皮细胞表面重要的结构成分,其完整性有利于保护内皮细胞功能并抑制炎症反应。脓毒症过程中糖萼受损,肝素与糖萼中的硫酸乙酰肝素结构相似,可保护糖萼不被破坏[13]。肝素在脓毒症中的治疗价值存在很大争议,临床试验结果并不一致。2009年Jaimes等[14]的一项纳入319例患者的随机、双盲、对照研究显示,肝素与安慰剂在改善病死率方面无显著差异。日本一项多中心研究显示,抗凝药物(包括肝素)可显著降低脓毒症相关性凝血病发生率[15],显示脓毒症中极危重亚组可能是肝素治疗获益者。本组资料显示,恢复期肝素干预组治疗前后血小板计数、传统止凝血功能(PT、APTT)、部分器官功能参数(BUN、Cr、TB)、炎症指标(hs-CRP、PCT),部分TEG参数(α角、MA)、PCIS评分比较,差异有统计学意义,但与对照组比较,差异均无统计学意义。干预组治疗前后出血情况差异无统计学意义,提示肝素治疗安全性良好。两组预后的差异无统计学意义。考虑与以下因素有关:①肝素抗凝作用需依赖抗凝血酶,脓毒症过程中因机体大量消耗,抗凝血酶活性明显下降,导致肝素抗凝作用下降;②用药时机:脓毒症病情进展迅速,可处于凝血障碍不同阶段,影响肝素疗效;③原发病治疗:脓毒症控制的关键措施为感染控制及病灶彻底清除、液体复苏、适宜抗生素使用,器官功能支持等集束化治疗,部分患者早期通过上述综合治疗,随着病情好转,炎症反应改善,凝血功能可得以恢复。
脓毒症凝血功能紊乱常见,随着病情加重,凝血功能障碍发生率增高。凝血功能障碍是脓毒症病理生理学特征之一。血栓弹力图用于脓毒症治疗的监测有一定意义,对传统凝血功能监测起重要补充。微量肝素治疗安全性好,不增加出血率。本研究不足之处是病例数较少,需更大样本的临床试验进一步证实。
