头孢拉定胶囊的处方工艺及质量研究
2021-08-02胡丽娟张紫金谷海泽李亚卿王丽娜谷艺凡
胡丽娟,张紫金,谷海泽,李亚卿,王丽娜,谷艺凡
(华北制药河北华民药业有限责任公司,河北 石家庄 050000)
0 引言
头孢拉定为美国施贵宝制药公司于1972年研制成功的第一代头孢菌素,20世纪70年代投入医药市场,原研厂家为美国施贵宝制药。FDA的头孢拉定胶囊均已经退市。
日本无此产品,原研制剂已经在中国地产化。2018年6月28日国家食品药品监督管理总局(现为“国家药品监督管理局”)在《化学仿制药参比制剂目录第十五批》中公布了0.25 g头孢拉定胶囊的参比制剂为中美上海施贵宝制药有限公司生产的0.25 g的头孢拉定胶囊(商品名为泛捷复),泛捷复为原研地产化产品。
1 仪器和试药
1.1 仪器
电子天平(梅特勒XP26),溶出试验仪(Agilent 708DS+ 850DS),紫外-可见分光光度计(岛津UV2700),干法制粒机(江苏开创GL-25),高效液相色谱仪(日本岛津)。
1.2 试药
头孢拉定原料药(华北制药股份有限公司),乳糖(Molkerei MEGGLE Wasserburg GmbH & Co.KG),滑石粉(广西龙胜华美滑石开发有限公司),硬脂酸镁(安徽山河药用辅料股份有限公司),明胶空心胶囊(浙江华光胶囊股份有限公司),参比制剂:头孢拉定胶囊(泛捷复:AAY0504)。
2 处方选择依据或参考依据
在FDA网站上查到的参比制剂说明书中列出的辅料组成为辅料组分:乳糖,滑石粉,硬脂酸镁,明胶,二氧化钛,D&C红色33号,D&C黄色10号,FD&C蓝色1号,FD&C红色3号。
推测内容物中非活性成分为乳糖,滑石粉,硬脂酸镁,胶囊壳成分为明胶,二氧化钛,D&C红色33号,D&C黄色10号,FD&C蓝色1号,FD&C红色3号。
3 处方工艺筛选
3.1 参比制剂剖析
通过观察参比制剂的内容物性状,颗粒呈不规则状;根据参比制剂的处方组成,推测参比制剂为干法制粒工艺。
3.2 处方工艺筛选
工艺过程为:称量、预混、干法制粒、加入润滑剂和助流剂、总混、灌装、包装。
根据参比制剂的辅料种类(乳糖、滑石粉、硬脂酸镁),在不超过辅料的安全用量范围的基础上筛选辅料的用量;以干法制粒过程、灌装过程、溶出曲线等作为考察指标筛选填充剂、助流剂、润滑剂的用量,采用单因素的方法筛选填充剂的用量,通过干法制粒的过程,确定了填充剂乳糖的用量;在确定好的乳糖用量基础上外加常用量的润滑剂、助流剂,发现灌装过程出现粘冲,在此基础上通过单因素先筛选滑石粉的用量,将滑石粉用量调整到最大量5%后粘冲问题未改善;将滑石粉用量降低到常用量0.5%,在此基础上继续单因素筛选硬脂酸镁用量,硬脂酸镁用量增加到2%时,粘冲问题解决,测定此处方溶出曲线,在4个介质中15 min溶出度均≥85%,与参比制剂相似。
处方筛选及考察结果如表1所示,处方10溶出曲线对比如图1所示。通过筛选确定最终处方为处方10。
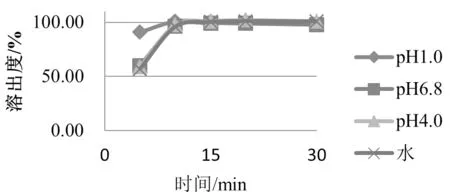
图1 最终确定处方四个介质溶出曲线(15 min均≥85%)
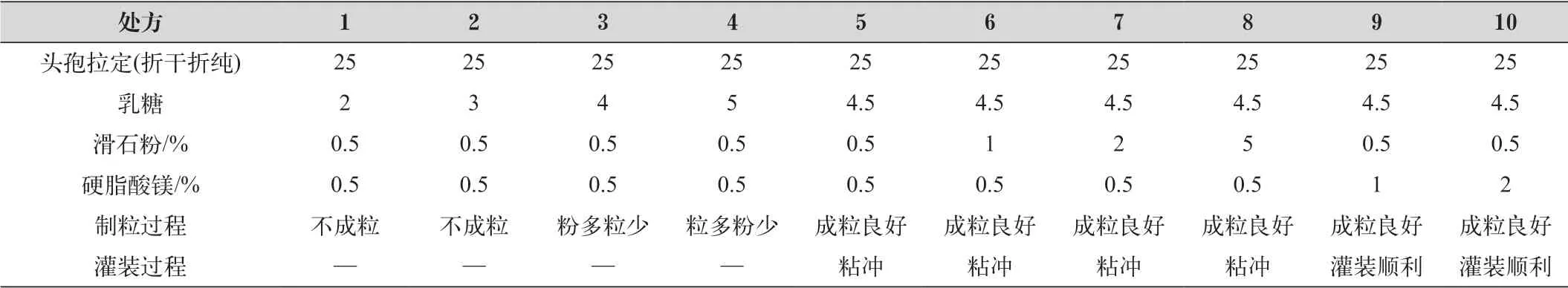
表1 处方筛选表及考察结果
4 有关物质检查
色谱条件:色谱柱:C18;流动相:水、甲醇、醋酸钠溶液和醋酸溶液的体积比为1500:400:30:6;流速:0.7~1.0 mL/min;检测波长:254 nm。
供试品溶液配制:取装量差异项下的内容物,混合均匀,精密称取适量,加流动相溶解并定量稀释制成每1 mL中约含头孢拉定1 mg的溶液,滤过,取续滤液作为供试品溶液。照头孢拉定项下的方法测定,除头孢氨苄外,按外标法以峰面积计算7-氨基去乙酰氧基头孢烷酸,7-氨基去乙酰氧基头孢烷酸不得过标示量的1.0%;按照自身对照法计算峰面积其他单个杂质峰面积不得大于对照溶液主峰面积的5倍(2.5%),按照自身对照法[1]计算峰面积其他各杂质峰面积的和不得大于对照溶液主峰面积的6倍(3.0%)。处方10有关物质检测结果如表2所示。

表2 有关物质检测结果
5 溶出度的检查
溶出度[1]与释放度测定法:篮法;溶出介质:0.1 mol/L盐酸溶液900 mL;转速:100 r/min;取样时间:45 min;供试品制备:溶液适量,滤过,精密量取续滤液适量,用溶出介质定量稀释制成每1 mL中约含头孢拉定25 μg的溶液;对照品制备:取装量差异项下的内容物,混合均匀,精密称取适量(相当于平均装量),按标示量加溶出介质溶解并定量稀释制成每1 mL中含头孢拉定25 μg的溶液,滤过,取续滤液;检测方法:紫外-可见分光光度法(通则0401),在255 nm的波长处测定吸光度;限度为80%,应符合规定。
6 稳定性考察
将本品按照上市包装(PVDC-药用铝箔泡罩包装,在40 ℃,RH75%条件下进行加速试验6个月,详细数据如表3、表4所示。
由表3、表4可以看出:各项指标均符合要求,各项指标变化趋势与参比制剂一致,并且优于参比制剂。
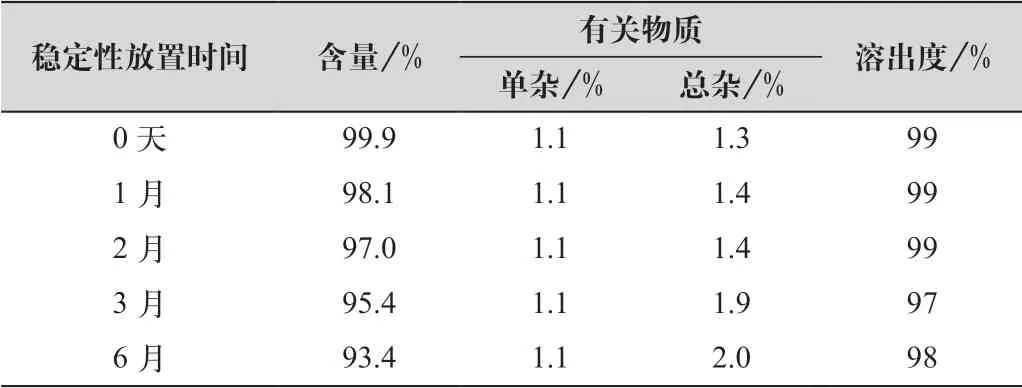
表3 稳定性考察结果(自制样品)
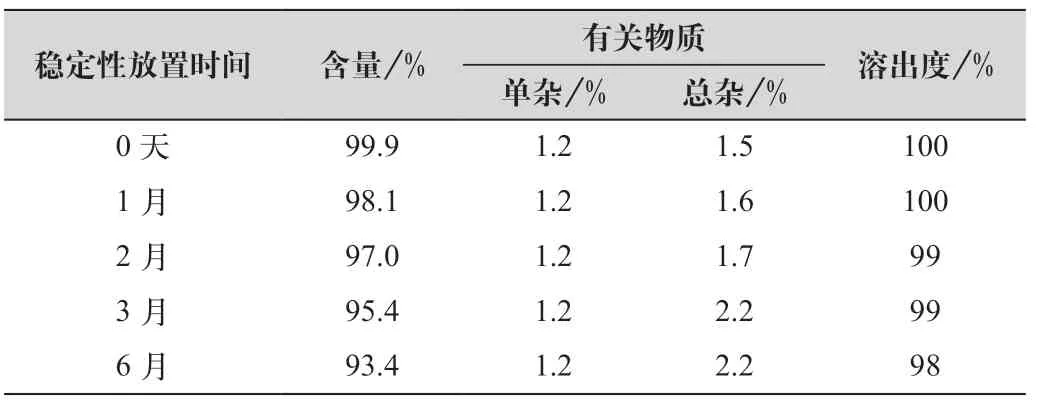
表4 稳定性考察结果(参比制剂)
7 结果分析
自制样品生产过程顺利,各项指标均符合要求,并优于参比制剂,自制样品在pH 1.0盐酸溶液、pH 4.0醋酸盐缓冲溶液、pH 6.8磷酸盐缓冲溶液、水溶液四个介质中15 min溶出度≥85%,均与参比制剂相似;在40 ℃,RH75%条件下进行加速试验6个月后,样品各项指标均符合要求,并优于参比制剂。
8 结语
本文通过对头孢拉定胶囊处方工艺的筛选,确定了最终的干法制粒工艺处方,按照确定的处方工艺制备了三批中试产品,中试过程中干法制粒过程流畅,颗粒均匀,灌装过程顺利装量差异可控;本文研究干法制粒工艺过程可控,适合工业化生产;开发的质量控制方法准确可靠,最终与参比制剂进行质量及稳定性对比,均优于参比制剂,符合仿制药质量一致性评价要求。
