摩尔气体常数测定实验综述报告的撰写
2021-08-02李茜王颖宣寒陈茜茜安徽建筑大学材料与化学工程学院安徽合肥230601
李茜,王颖,宣寒,陈茜茜(安徽建筑大学 材料与化学工程学院,安徽 合肥 230601)
0 引言
摩尔气体常数的测定是基础化学实验中最基础也是最重要的实验之一[1]。基础化学实验是为了培养学生观察实验现象、分析实验数据、解决实验问题并独立思考的能力,锻炼学生的基本动手能力,学会并掌握运用知识的能力[2-3]。通过基础化学实验,学生不仅可以获得专业技术知识,培养实践能力和创新精神,还可以培养学生科学思维和独立开展化学实验的能力[4-5]。
1 实验目的
(1)了解摩尔气体常数并知道其一种测定方法;
(2)熟悉分压定律与气体状态方程的应用;
(3)了解分析天平的操作规程和使用方法,练习测定气体体积的实验方法。
2 实验原理
气体状态方程式的表达式为:
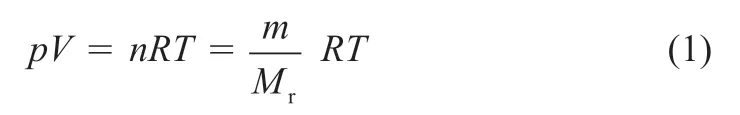
式中:p为气体的压力或分压(Pa);V为气体体积(L);n为气体的物质的量(mol);m为气体的质量(g);Mr为气体的摩尔质量(g·mol-1);T为气体的温度(K);R为摩尔气体常数(文献值:8.31 Pa·m3·K-1·mol-1或J·K-1·mol-1)。
由公式(1)可知,如果测出某温度下一气体的压力或分压p、体积V、物质的量n或质量m,就可以算出摩尔气体常数R的值。
利用活泼金属(如:镁、铝、锌)与稀酸反应生成氢气的实验,即可求出摩尔气体常数R值。例如:

将精确质量的镁条与过量稀硫酸反应,利用排水法可收集生成的氢气,就可得到氢气的精确体积V。根据式(2)以看出如果稀硫酸过量,则该反应生成的氢气与镁条的物质的量相等,即:

在已知实验温度与大气压的情况下,由量气管可精确测出该条件下反应生成的氢气体积V。
此时量气管内的氢气中水蒸气含量达到最大,即被水蒸气饱和,根据分压定律,混合气体的总压p(以100 kPa计),应是氢气的分压pH2与水蒸气分压pH2O之和,即:

将每项数据代入公式(1)即可求出R的值:

3 实验用品
仪器:温湿度气压计,分析天平,称量纸,漏斗,量气管,试管,铁架台,蝴蝶夹(滴定管夹),铁圈,橡胶塞,乳胶管,玻璃导管,砂纸,10 mL量筒,烧杯(100 mL、500 mL),剪刀。
试剂:3 mo1·L-1硫酸H2SO4,镁条(纯)。
4 实验内容
4.1 镁条称量
先用砂纸打磨已被氧化的镁条,用剪刀剪成小节,然后取其中一根放在分析天平上称出其精确质量,记录数据,用称量纸包好待用。
选用的镁条质量大小在0.030 0~0.040 0 g最为合适,要求准确至±0.000 1 g。若镁条质量过小,会导致称量不准,以及测定的实验结果误差偏大;若镁条质量过大,则生成的气体较多,可能会超出量气管的测定范围,从而导致无法准确测出其体积。
4.2 仪器的装置和检查
按图1所示装置组装仪器。注意铁圈要安装在蝴蝶夹下面,这样方便上下移动水准瓶。取下量气管上口的橡胶塞,将水从水准瓶中缓慢倒入装置,一边倒一边注意观察量气管内液面不能超过“0”刻度。检查乳胶管和量气管内是否有气泡,若有,上下移动水准瓶或挤压乳胶管,直至气泡被赶尽,最后塞紧橡胶塞。
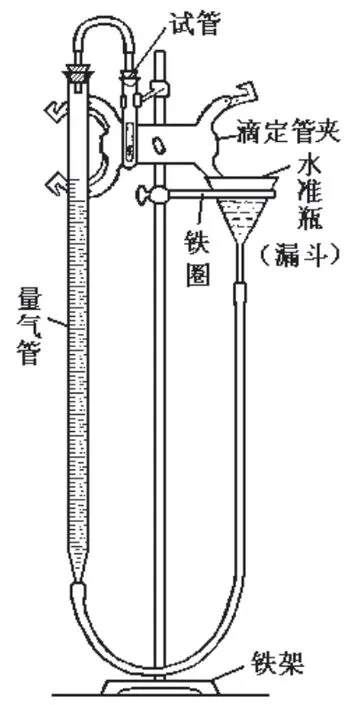
图1 摩尔气体常数测定装置
为能够准确测量实验中生成的气体体积,整个装置一定要保持良好的气密性,不能漏气,因此实验前必须检查装置气密性:将装置中所有连接处(包括橡胶塞、乳胶管、导管等)塞紧,水准瓶稍稍向上移动一点,使之与量气管两液面形成一段落差,静置片刻,仔细观察量气管液面是否发生变化。若发现量气管液面一直不动,说明整个装置不漏气,可继续实验;若发现量气管液面继续上升,说明装置漏气,必须对装置所有可能漏气的地方重新检查。检查后,必须再次检查装置气密性,直至不再漏气为止,最后将水准瓶移回原位。
4.3 金属与稀酸反应前的准备
拔下试管上的橡胶塞,从装置上取下试管,利用漏斗将4~5 mL 3 mo1·L-1硫酸小心倒入试管,小心取出漏斗,不能让硫酸碰到试管壁。略微将试管倾斜,把称量好的镁条按压平整,用镊子夹住镁条蘸取少量去离子水,轻轻贴在试管壁中上部,注意不能让镁条碰到硫酸,如图2所示。最后将试管固定在铁架台上,小心旋紧橡胶塞,整个过程要小心谨慎,防止镁条落入稀硫酸中。
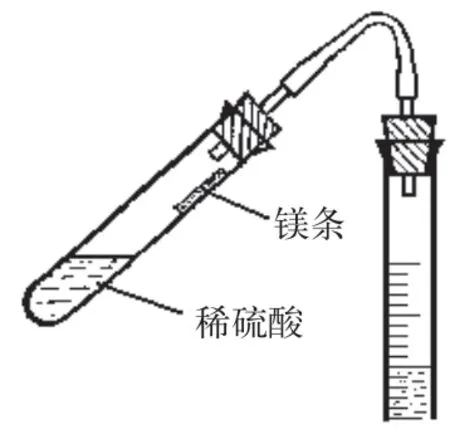
图2 镁条贴在试管壁中上部
再次检查装置的气密性。若气密性良好,移动铁圈使水准瓶与量气管尽可能靠近,调整水准瓶使两液面相平,读出此时量气管液面的读数,精确度为0.01 mL。
4.4 氢气的发生、收集和体积的量度
取下试管,稍微抬高试管底部,动作轻缓,使稀硫酸与镁条接触,不能让稀硫酸碰到橡胶塞;当镁条掉入稀硫酸中时,再次固定试管。镁条与稀硫酸反应生成大量氢气,装置内气压不断增大,使量气管液面下降。为防止装置内由于气压增大而导致漏气,此时应将水准瓶同时下移,直到反应结束。
当反应温度冷却至室温时,调整水准瓶与量气管两液面的高度使之相平,读出此时量气管内液面读数,并记下数据。每隔2~3 min后调节两液面相平,并读数,直至读数不再发生变化。以最后一次读数为准,并在温湿度气压计上读出此时的实验室温度和大气压。由表1中可查出此温度下水的饱和蒸气压。
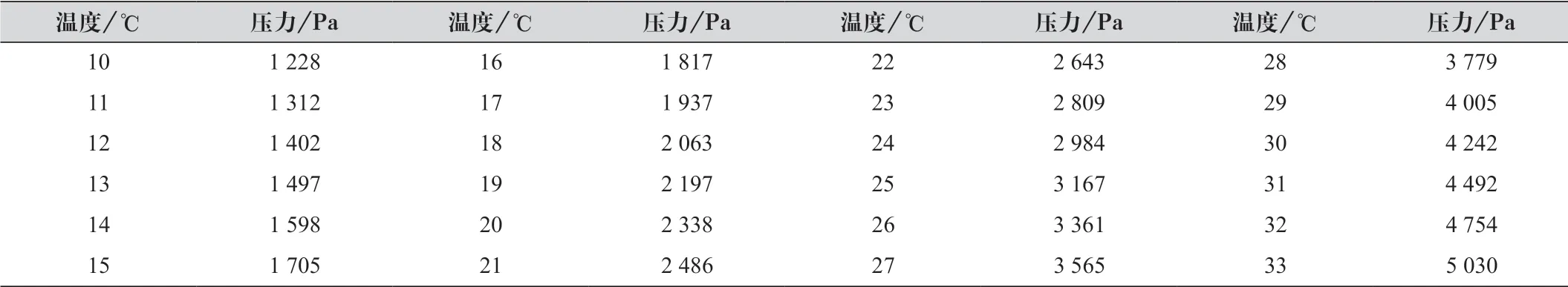
表1 不同温度下水的饱和蒸气压
实验结束后,取下试管,打开橡胶塞,倒掉试管内反应后的溶液,将试管洗涤干净,然后取另一根已称量的镁条重复以上操作再进行一次实验。并记录实验结果。
5 数据记录处理与讨论
5.1 实验数据记录与处理
摩尔气体常数测定数据如表2所示。

表2 摩尔气体常数测定数据
实验1数据处理:
反应置换出H2的体积:

由此可得:摩尔气体常数R的实验平均值:
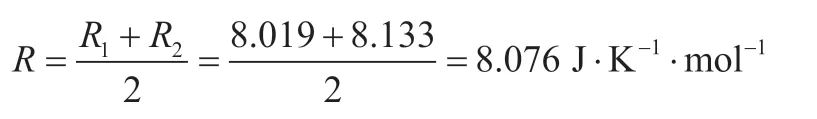
5.2 讨论
实验结果比文献值偏小,造成这个结果可能的原因有:
(1)镁条被氧化,使用前未将其表面氧化膜擦净;
(2)将镁条粘贴到试管中时,不小心使镁条碰到了稀硫酸溶液;
(3)实验装置漏气,反应前未检查,导致反应过程中氢气泄漏;
(4)反应开始前,水准瓶液面低于量气管液面,反应结束后,水准瓶液面高于量气管液面;
(5)反应开始前,仰视液面读数,反应结束后,俯视液面读数。
6 注意事项
(1)橡胶塞大小要与试管口和量气管口相吻合,不能过大或过小,防止管口塞烂或漏气;
(2)将橡胶塞拔下后,再从水准瓶中缓慢倒入自来水,使量气管内液面在0~5 mL之间;
(3)乳胶管和量气管内所有气泡要排净;
(4)气路通畅:试管与量气管间的乳胶管要保持顺畅不能折叠,反应前一定要检查装置气密性;
(5)装稀硫酸:用长颈漏斗将稀硫酸倒入试管中,取出漏斗时要小心,不能将稀硫酸沾到试管壁上;
(6)贴镁条:用镊子夹住镁条蘸取一滴去离子水小心粘在试管壁中上部,整个过程镁条不能碰到稀硫酸溶液;
(7)反应:反应之前一定要检查装置气密性,确保装置不漏气后再反应,倾斜试管时不能让稀硫酸碰到橡胶塞;
(8)读数:必须调节水准瓶和量气管两液面相平,反应结束后冷却到室温再读数(精确度为0.01 mL)。
7 结语
通过摩尔气体常数的测定实验,对结果进行分析及讨论,使学生逐渐熟悉实验基本操作要领,了解各种实验仪器的用途及操作方法,并加深学生对实验的理解,激发学生对实验的热情和兴趣。
