COL6A1高表达对肾透明细胞癌患者预后的影响
2021-07-31张元曹庆飞佟明
张元,曹庆飞,佟明
(锦州医科大学附属第一医院,辽宁 锦州 121000)
肾细胞癌(renal cell carcinoma,RCC)是世界上最常见的泌尿系肿瘤之一,约占所有成人恶性肿瘤的3%。美国癌症协会估计,2020年美国将出现新增肾癌和肾盂癌病例73 750例,死亡14 830例[1]。肾透明细胞癌(clear cell renal carcinoma,ccRCC)是肾癌最常见的亚型,在肾癌所有的组织学类型中约占75%[2],也是肾癌死亡的主要原因[3]。早期局限性肾透明细胞癌经治疗后预后良好,5年生存率大于90%[4],可一旦发生远处转移,生存期大幅缩短,发生骨转移后平均生存时间为12~28个月[5]。由于30%~50%的肾透明细胞癌患者早期缺乏临床症状,约有20%~30%的患者在初次诊断时就发现存在远处转移[6-7],因此早期准确诊断对肾透明细胞癌患者至关重要。随着高通量测序技术的发展,越来越多的新的生物标志物被发现与癌症患者的生存预后相关,寻找新的可靠的生物标志物有助于肾透明细胞癌早期诊断、估计预后及指导治疗。
VI型胶原是一种主要的细胞外基质(extracellular matrix,ECM)蛋白,它与其他细胞外基质分子相互作用,形成微丝网状,为细胞提供结构支撑[8]。既往研究表明胶原蛋白VI可以通过触发信号通路调节细胞凋亡[9]、炎症[10],甚至促进肿瘤进展[11]。胶原蛋白VI由不同基因编码的3条主要多肽链(分别为α1、α2和α3)组成。COL6A1基因编码的是α1多肽链,通常参与肿瘤转移。有研究显示下调COL6A1表达能够抑制肺癌细胞转移,而过表达COL6A1则能促进肺癌细胞转移[12]。一项全球分泌蛋白质组分析结果显示,高表达COL6A1可以促进体内肿瘤细胞骨转移[13]。 然而,在肾透明细胞癌中COL6A1的临床意义和预后价值仍然未知。
本研究旨在通过对癌症基因组图谱(the cancer genome atlas,TCGA)数据库中肾透明细胞癌样本数据进行生物信息学分析,探讨COL6A1表达在肾透明细胞癌中的预后价值。同时,我们利用基因集富集分析(gene set enrichment analysis,GSEA)探索了COL6A1 高表达表型和低表达表型中关键信号通路的差异。
1 资料与方法
1.1 患者的RNA测序数据和临床病理信息
从TCGA数据库(https://portal.gdc.cancer.gov/repository)下载肾透明细胞癌基因表达数据(共611例样本;539例肾透明细胞癌组织样本和72例正常的癌旁非癌组织样本;工作流类型:HTSeq-FPKM)以及相关的临床资料。相关的临床资料包括年龄、性别、病理分级、TNM分期和临床分期。部分临床资料缺失的样本不纳入统计。
1.2 预后模型的建立
利用R语言的生存包建立包含年龄、病理分级、临床分期、TNM分期、COL6A1表达的预后模型来预测肾透明细胞癌患者3年和5年的生存率。采用一致性指数(c-index)、校准曲线和ROC曲线评价模型性能。
1.3 基因集富集分析
将KEGG基因集数据和表型标签文件(COL6A1-high和COL6A1-low)上传至GSEA软件。我们对每个分析进行1000次基因集排列,将正常P< 0.05和FDR< 0.25的基因集定义为显著差异表达的基因集。
1.4 统计学方法
所有数据均使用R软件(V3.6.0; https://www.r-project.org/)进行分析。采用Wilcoxon秩和检验分析COL6A1 在肾透明细胞癌组和正常组中的表达差异。使用Wilcoxon符号秩检验分析肾透明细胞癌及配对邻近组织中COL6A1的表达差异。使用Wilcoxon秩和检验、Kruskal-Wallis检验评估临床及病理因素和COL6A1表达之间的关系。采用Kaplan-Meier法分析COL6A1 表达和患者总生存时间之间的关系。采用Cox回归分析COL6A1表达及其他临床特征与总生存时间的关系。
2 结 果
2.1 COL6A1在肾透明细胞癌中高表达
分析比较539例肾透明细胞癌组织和72例癌旁非癌组织中COL6A1的表达,发现COL6A1在肿瘤组织中的表达显著高于正常组织(P<0.001),见图1A。同时,我们分析了COL6A1在72对配对肾透明细胞癌组织及癌旁非癌组织中的表达,COL6A1在肾透明细胞癌组织中表达显著高于癌旁非癌组织(P<0.001),见图1B。
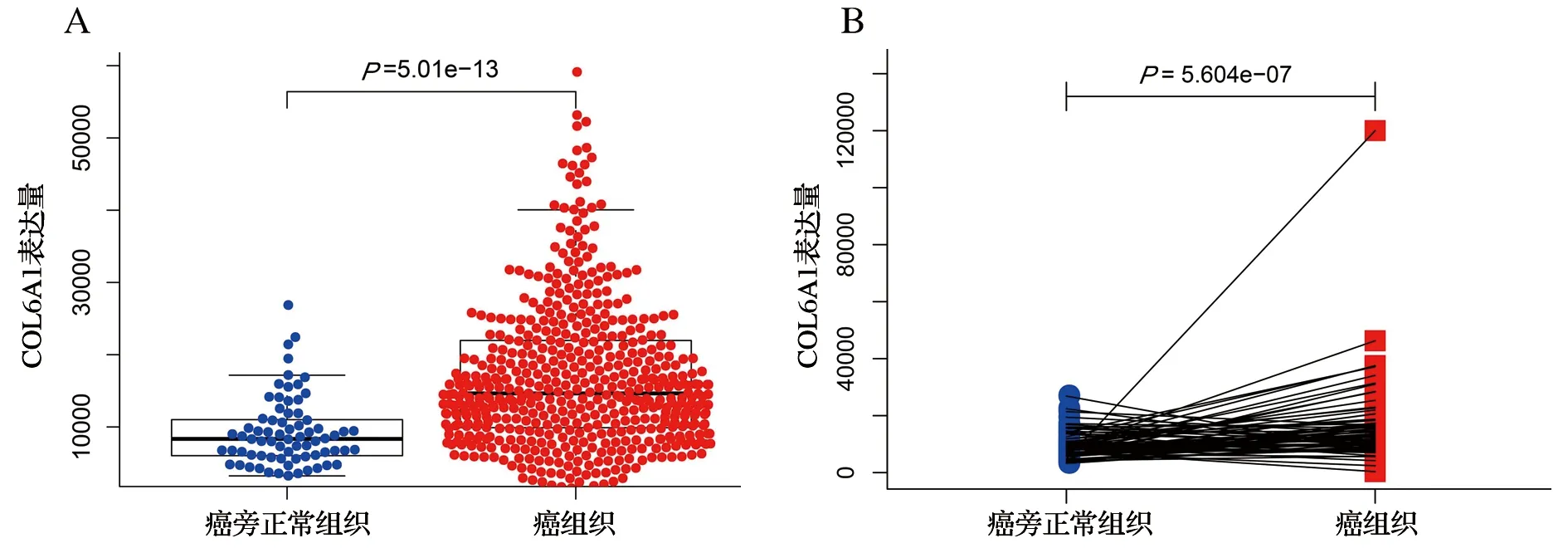
图1 COL6A1在肿瘤组织中的表达显著高于癌旁正常组织
2.2 COL6A1表达与肾透明细胞癌患者临床及病理特征的相关性分析
TCGA数据库中收集并整理患者的临床及病理资料,见表1。包括年龄、性别、病理分级、TNM分期和临床分期。采用Wilcoxon秩和检验、Kruskal-Wallis检验分析COL6A1表达量与临床病理特征之间的关系,结果显示COL6A1表达量与患者性别、M分期无关,与年龄、病理分级、T分期、N分期、临床分期显著相关,见图2~3。

表1 从TCGA获取的肾透明细胞癌患者的临床信息
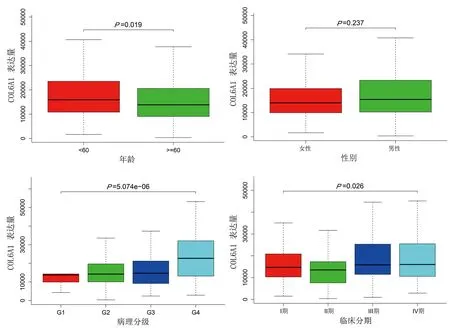
图2 COL6A1表达量与肾透明细胞癌患者年龄、性别、病理分级、临床分期之间的关系
2.3 COL6A1表达量与肾透明细胞癌患者总生存时间之间的关系
Kaplan-Meier生存分析结果显示,COL6A1高表达与患者不良预后相关(P=0.007),见图4,即COL6A1高表达患者的总生存时间较低表达患者短。COL6A1高表达组的中位生存时间为66个月,而低表达组直到随访时间截止,死亡人数都没有超过总人数的50%。为了进一步分析COL6A1以及其他临床病理因素对总生存时间的影响,我们进行了Cox回归分析。单因素Cox回归分析结果显示,COL6A1表达量、年龄、病理分级、临床分期、TNM分期与总生存时间显著相关(P<0.05),随后,将这些因素作为自变量进行多因素Cox回归分析,结果显示年龄、M分期、COL6A1表达量仍然与总生存时间密切相关(P<0.001),见图5。说明COL6A1高表达、年龄、M分期是肾透明细胞癌患者不良预后的独立危险因素。

图4 Kaplan-Meier生存分析结果显示COL6A1高表达患者的总生存时间较低表达患者短

图5 多因素Cox回归分析结果显示COL6A1高表达、年龄、M分期是影响肾透明细胞癌患者总生存时间的独立危险因素
2.4 总生存期的预后模型
为了预测肾透明细胞癌患者的3年和5年生存率,我们制作了一个包含年龄、病理分级、临床分期、T分期、N分期、M分期和COL6A1 表达量的预后模型,见图6。在这个预后模型中,每个因素都按其对生存率的风险贡献比例被分配了分数,总分越高,总生存率越低。该预后模型的一致性指数(C指数)为0.768。为了进一步评价该预后模型的准确性,我们绘制了预测校准曲线和受试者工作特性(ROC)曲线。结果显示,预测校准曲线贴近标准曲线,见图7。3年和5年生存率的ROC曲线下面积(AUC)分别为0.827和0.802,见图8。说明该预后模型预测的3年和5年生存率与实际基本相符。
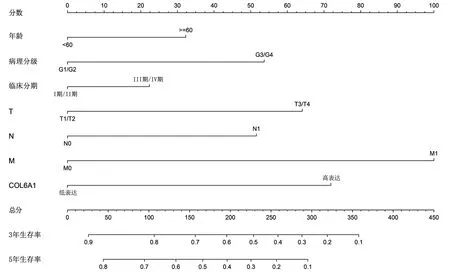
图6 肾透明细胞癌患者总生存期的预后模型

图7 预测模型的校准曲线
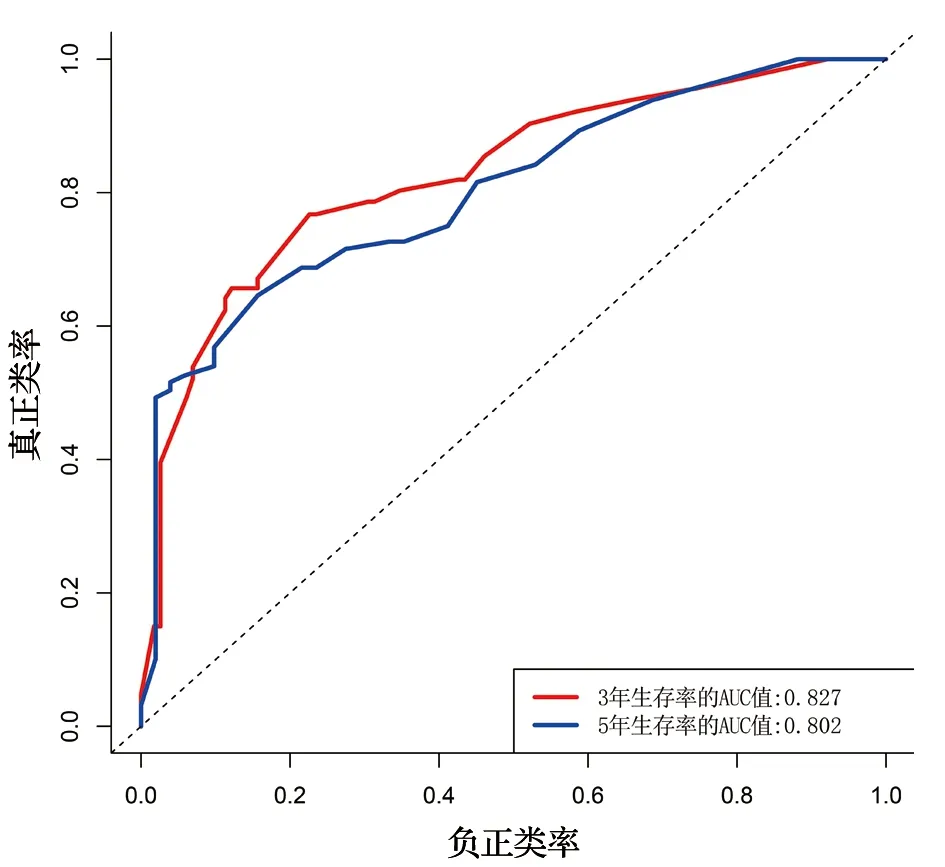
图8 预测模型的ROC曲线
2.5 基因富集分析与COL6A1相关的信号通路
为了探究肾透明细胞癌中与COL6A1高表达相关的信号通路,我们将从TCGA数据库中收集到的样本根据COL6A1表达量分为COL6A1高表达组和COL6A1低表达组进行基因集富集分析。结果显示,ECM受体相互作用、JAK STAT信号通路、MAPK 信号通路、NOTCH信号通路、p53信号通路、VEGF信号通路、WNT信号通路中基因集被富集到COL6A1高表达表型,见图9。
3 讨 论
细胞外基质为调节细胞生长和凋亡提供了必要的信号,同时它还可以通过调节化疗的途径和形成促进耐药性的物理屏障来影响肿瘤对抗癌药物的反应[14]。胶原蛋白是细胞外基质的主要蛋白之一,其中胶原蛋白VI在细胞信号转导和细胞迁移中发挥重要作用[13,15-16]1339-1355,并与一系列ECM组分相互作用[17]。COL6A1是脊椎动物中的保守基因/蛋白,存在于所有结缔组织中[18],主要编码胶原蛋白VI的α1链,被发现在星形细胞瘤中差异表达[19]。根据全球分泌蛋白质组分析,Blanco等[13,20]1339-1355研究发现COL6A1是一种新型的骨转移介质。但是,没有研究报道COL6A1在肾透明细胞癌中的表达与临床预后之间的关系。
在本研究中,我们利用生物信息学的方法分析了从TCGA数据库中获得的高通量RNA测序数据。结果显示COL6A1在肾透明细胞癌中高表达与晚期临床病理特征(高病理分级、高T分期、淋巴结转移、高临床分期)相关。Kaplan-Meier曲线显示,COL6A1高表达患者总生存时间明显少于低表达患者。多因素Cox回归分析显示,年龄、M分期以及COL6A1高表达是肾透明细胞癌患者预后不良的独立风险因素。
随着高通量测序技术的应用,越来越多的研究发现分子的异质性与肾透明细胞癌患者的预后与生存相关[21-22],所以只利用临床病理特征这些传统的指标预测肾透明细胞癌患者的生存率是不够充分的。因此我们建立了一个包含患者临床病理特征(年龄、病理分级、临床分期、TNM分期)和COL6A1表达量的预测模型来预测肾透明细胞癌患者3年和5年生存率,为临床医生提供了一个更加精确的定量工具来估计肾透明细胞癌患者的生存率。且C指数、预测校准曲线及ROC曲线均证明该预测模型与实际基本相符。
为了进一步探究COL6A1在肾透明细胞癌中潜在的分子生物学机制,我们通过基因集富集分析(GSEA)发现ECM受体相互作用、JAK STAT信号通路、MAPK 信号通路、NOTCH信号通路、p53信号通路、VEGF信号通路、WNT信号通路中基因集被富集到COL6A1高表达表型。我们推测这些信号通路与COL6A1相互作用,参与了肾透明细胞癌发生发展的过程,但是需要进一步实验验证。
虽然本研究证实了COL6A1高表达与肾透明细胞癌患者预后之间的关系,但是本文仍有一些不足之处。第一,本文的数据是从TCGA数据库得到的mRNA表达量,Guo等人[23]发现用mRNA的表达代表蛋白的表达是不够完美的,本文并没有讨论COL6A1 mRNA表达与COL6A1蛋白表达的相关性。第二,本研究数据从单一肿瘤数据库中获得,存在选择偏倚。第三,本文并没有探讨更深层的分子机制。
综上所述,我们利用生物信息学进行数据挖掘分析发现COL6A1高表达是肾透明细胞癌不良预后的独立危险因素,并且在肾透明细胞癌中ECM受体相互作用、JAK STAT信号通路、MAPK 信号通路、NOTCH信号通路、p53信号通路、VEGF信号通路、wnt信号通路可能与COL6A1相互作用促进肾透明细胞癌的发生发展。
