65例小肝细胞癌的超声造影图像特征分析
2021-07-31韩莹莹翟凌云沙红芳徐祥勇崔建巍
韩莹莹,梅 琪,翟凌云,沙红芳,徐祥勇,贺 静,倪 娟,陈 穹,崔建巍,虞 梅
1.上海市徐汇区大华医院超声影像科,上海 200237;
2.上海市徐汇区大华医院放射科,上海 200237;
3.上海市徐汇区大华医院肝科,上海 200237
肝细胞癌(hepatocellular carcinoma,HCC)大多发生在慢性肝炎或肝硬化的基础上,早期临床缺乏特异性,临床出现症状时影像学诊断多已到中晚期,常常错过最佳手术治疗时期,5年生存率较低[1]。HCC与肝组织的差异性供血是动态增强影像学检查诊断HCC的主要依据,但HCC的发生、发展是一个渐变、复杂的过程[2-3]。在HCC发生、发展的早期,由于肿瘤血供尚未完全建立,在影像学上缺乏典型的表现而难以获得准确的影像学诊断结果[3],而早期诊断HCC对于患者的预后预测有着极其重要的意义。本研究回顾并分析65例小HCC(small HCC,sHCC)的超声造影(contrast-enhanced ultrasound,CEUS)资料,旨在评估CEUS在sHCC早期诊断中的应用价值。
1 资料和方法
1.1 研究对象
回顾并分析2010年12月—2019年12月于上海市徐汇区大华医院行CEUS检查并经穿刺或手术后病理学检查证实的65例sHCC患者的资料,所有病灶直径≤2 cm。其中男性49例,女性16例,年龄11~83岁,平均(61.08±13.24)岁,病灶最大直径为0.8~2.0 cm,平均(1.47±0.38)cm。纳入标准:所有患者均为慢性肝病患者,在定期随访中行CEUS检查时发现肝内结节,并经穿刺或手术后病理学检查确诊为sHCC;术前均为单发直径≤2 cm的病灶。排除标准:合并其他组织原发性重大疾病者;伴有严重胸腹水、黄疸者;多发病灶者。
1.2 仪器与方法
采用美国GE公司的Logiq E9彩色多普勒超声诊断仪,使用腹部凸阵探头,频率为1~5 MHz。CEUS造影剂为意大利Bracco公司生产的声诺维(SonoVue),用5 mL生理盐水配制成微泡混悬液。根据患者体重抽取微泡混悬液1.5~2.5 mL经肘前静脉团注,同时启动计时器。以实时、动态视频的形式储存CEUS全过程,并作定性及定量分析。探头置于感兴趣区,清晰显示目标病灶全貌及周围肝脏组织,行常规超声记录存储病灶的大小、形态、边界、回声和血流信号等情况;然后进入CEUS状态,全程观察病灶的增强形态、增强类型等。
1.3 图像分析
肝CEUS时期分为动脉期(15~30 s)、门脉期(31~120 s)及延迟期(>121 s)[3]。sHCC的CEUS特征:典型增强模式为“快进快出”型,即动脉期病灶均匀或不均匀高增强,门静脉期或延迟期消退为低增强[2-3];不典型增强模式为“快进同出或慢出”型,即动脉期快速增强、门脉期及延迟期无明显减退。当CEUS表现为肝内病灶区等于或慢于肝实质增强,门脉期与延迟期呈等回声与肝实质同步减退,则提示为肝良性结节[4]。
1.4 统计学处理
2 结 果
2.1 sHCC的直径大小与超声声像图表现分析
65例sHCC的超声声像图表现分为3种(图1~3):低回声40例(61.54%)、等回声14例(21.54%)及高回声11例(16.92%),其中低回声为sHCC的主要表现形式(表1)。经统计学分析,肿瘤的大小与超声声像图表现无相关性,差异无统计学意义(P>0.05)。

表1 sHCC大小与声像图类型分析
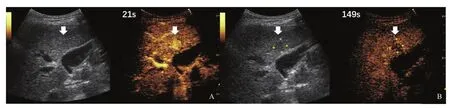
图1 典型病例1(患者,女性,70岁,乙肝病史40多年)肝内等回声CEUS表现

图2 典型病例2(患者,男性,65岁,乙肝伴肝癌家族史)肝内高回声CEUS表现
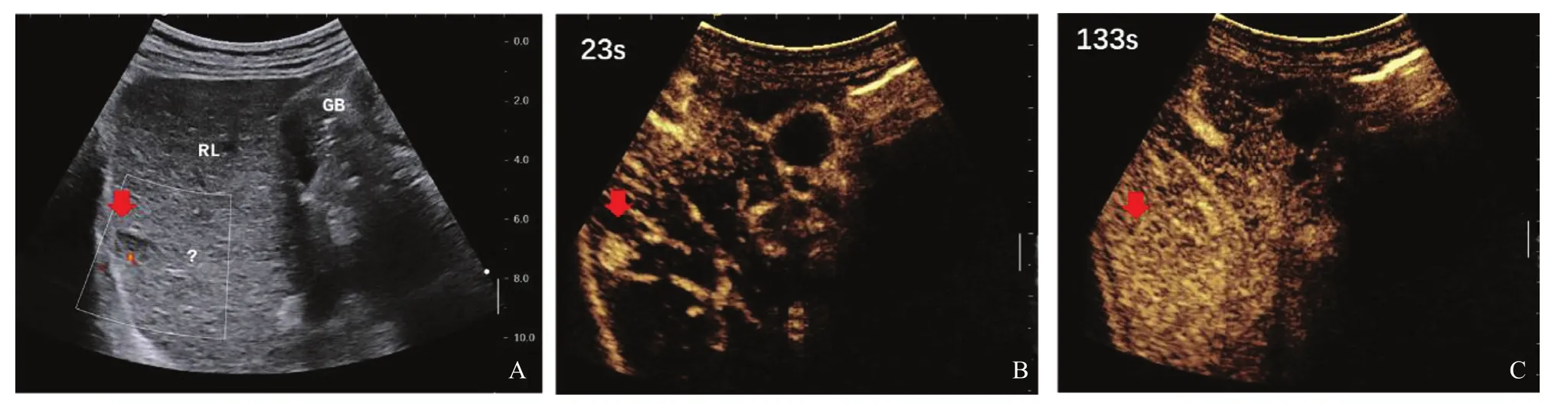
图3 典型病例3(患者,男性,60岁,乙肝病史30多年)肝内低回声CEUS表现
2.2 不同声像图sHCC病灶与CEUS增强模式的关系分析
65例sHCC中常规灰阶超声图像上表现为低回声40例、等回声14例和高回声11例。
经CEUS检查后,不同回声的病灶CEUS模式分布见表2,经统计学分析,不同声像图的病灶与CEUS增强模式无明显的相关性。
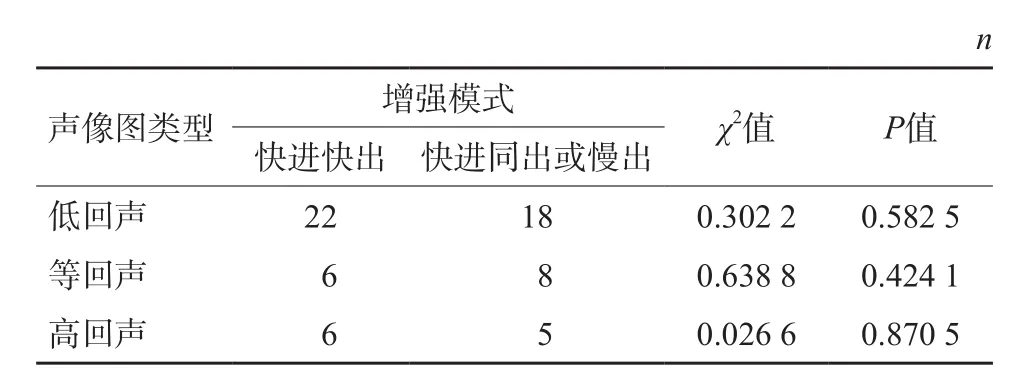
表2 sHCC不同声像图与CEUS增强模式的关系
2.3 sHCC的大小与CEUS增强模式相关性分析
65例sHCC中,34例表现为“快进快出”型(52.31%),其中<1.5 cm病灶占4例;31例表现为“快进同出或慢出”型,均发生在<1.5 cm病灶中(表3),两者差异有统计学意义(P<0.01),即对于<1.5 cm的病灶,当CEUS表现为“快进同出或慢出”的模式时,高度提示恶性可能。

表3 sHCC大小与CEUS增强模式的关系
2.4 sHCC病灶大小与CEUS始增时间、消退时间及持续增强时间的关系分析
不同直径的sHCC CEUS开始增强时间、消退时间、增强持续时间见表4。从统计表分析中可以看出,造影剂的消退时间、增强持续时间与病灶大小呈负相关(r=-0.34,图4),即结节越小,造影剂消退时间越晚,CEUS增强持续时间越长。而病灶的CEUS增强开始时间与病灶大小没有直接关系,差异无统计学意义(P=0.527)。
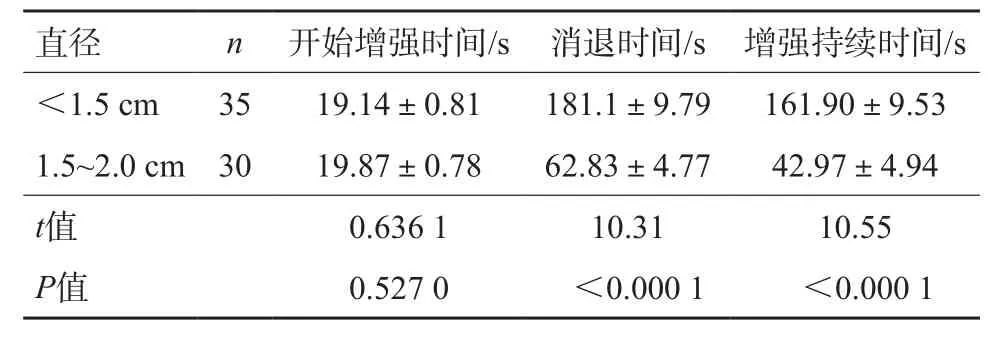
表4 sHCC的大小与CEUS开始增强时间、消退时间、增强持续时间的关系
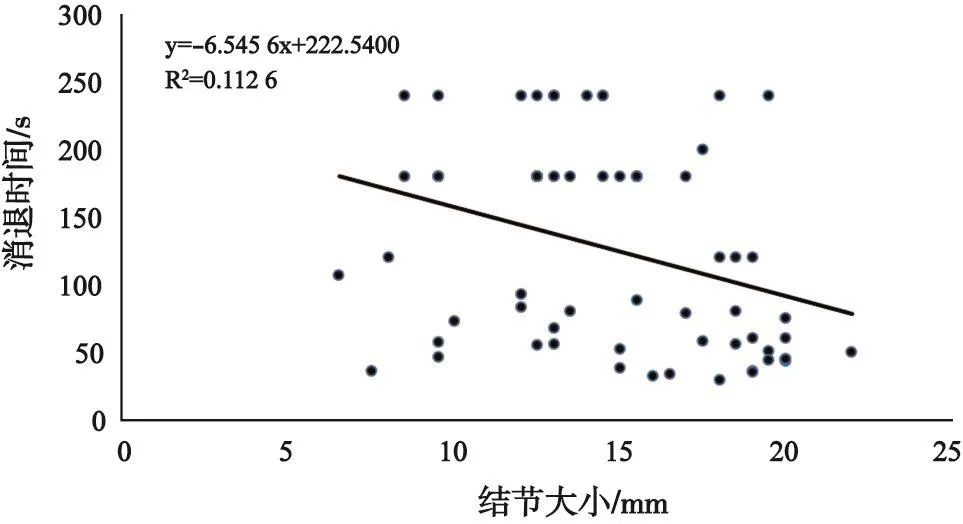
图4 sHCC大小与CEUS消退时间的相关性分析
3 讨 论
临床上的sHCC多在肝硬化的基础上形成,超声检查受粗糙的肝病背景的影响,很难鉴别毫米级大小的硬变结节,因肝硬化结节的多样性和复杂性,致使普通超声诊断小肝癌的准确度较低[4]。90%的sHCC以低回声结节为主要表现,具有以下特点:圆形或椭圆形,细薄包膜,侧壁回声失落,后壁和后方回声轻微增强,内部低回声分布较均匀,其中心部位常具花蕊样点状增强;肿瘤内多见线状、分支状彩色血流穿入,多数可测及动脉流速曲线,阻力指数较高(>0.60)[5]。本组65例≤2.0 cm病灶二维声像图均不典型,表现为低回声、等回声及高回声等3种形式,虽以低回声居多(占61.54%),但结节周围“声晕”不明显,周边及内部血流信号稀少,常规超声诊断准确度低于41%。本组中sHCC病灶最小直径约8 mm表现为极低回声,彩色多普勒超声未显示血流信号,而CEUS时病灶早期快速整体增强,门静脉期及延迟期呈等增强,最终病理学检查证实为sHCC Ⅱ级。研究[6]指出,CEUS鉴别诊断sHCC是基于其显示病灶的血流动力学表现,适用于大多数的肝肿瘤,可能会漏诊部分血供表现极不典型的肝癌病例。而本研究患者中部分血供不典型的病灶,依据CEUS动脉期高增强的特点,能有效提高sHCC的诊断准确度。
典型的肝癌表现为动脉期快速整体增强、门静脉期和延迟期减退呈低回声的动态改变,以此特征诊断肝癌具有较高的灵敏度和准确度[7-8]。本组65例sHCC中34例CEUS增强模式为“快进快出”型,31例CEUS增强模式为“快进同出或慢出”型。有研究[9]显示,约90%的HCC患者其HCC的发展是多级路径演变而成的:再生结节—低或高分化的不典型增生结节—不典型增生结节伴灶性癌变—高分化的HCC—中到低分化的HCC。多数研究[10]认为,肝癌发生、发展伴随着其内血流动力学的一系列变化,随着肝硬化病程的进展,肿瘤新生动脉血流逐渐增多,异型增生结节以不断减少的肝动脉血流为特征,门静脉血供可保留直至癌变阶段。此外,小肝癌的瘤内血供类型还与瘤体分化程度密切相关。早期肝癌或分化程度较高的肝癌,CEUS增强模式多呈“快进慢出”型或呈“快进同出”型[11-12];本组31例“快进同出或慢出”型均为直径<1.5 cm病灶,表明sHCC的CEUS增强模式与病灶的大小及分化程度有相关性。故不同分化程度的sHCC均表现为动脉期高增强,这些变化对于肝硬化基础上的肝细胞结节的定性诊断至关重要。
《中国超声造影临床应用指南》[9]指出,HCC和其他原发肿瘤或肝脏转移癌相比,HCC的廓清一般较晚,通常发生在注射造影剂60 s后,约25%的患者廓清甚至在180 s以后。对本组65例sHCC患者CEUS的回顾性分析显示,病灶大小与CEUS开始增强时间无相关性,差异无统计学意义(P=0.527),平均CEUS增强时间为(19.48±4.52)s;病灶大小与CEUS消退时间及CEUS增强持续时间有密切相关性(P<0.000 1),65例患者廓清的平均时间为(126.52±74.42)s,其中35例<1.5 cm的病灶廓清平均时间为(181.1±9.79)s。不同直径sHCC的CEUS消退时间差异有统计学意义,直径<1.5 cm倾向于“快进同出或慢出”,>1.5 cm则倾向于“快进快出”,对临床有一定的指导意义更有助于sHCC的早期诊断。
总之,CEUS具有良好的血流灌注显像功能,能实时不间断观察肝内结节病灶增强特点,能实时动态观察病灶与肝实质的血流灌注时相和灌注模式的变化规律,尤其是对于直径≤2 cm的早期病灶,实时CEUS能捕捉增强过程中有助于诊断的所有细节,能显著提高鉴别诊断肝内结节良恶性的准确度[13],对于慢性肝病的长期监控具有良好的应用前景。
