前列腺增生经会阴激光消融技术的初步临床应用(附2例报告)
2021-07-31孟哲颖陆奇杰
郭 倩,张 蔚,孟哲颖,陆奇杰,陈 磊,胡 兵
上海交通大学附属第六人民医院超声医学科,上海超声医学研究所,上海 200233
良性前列腺增生(benign prostatic hyperplasia,BPH)是老年男性常见多发病,随着中国社会老龄化的到来,BPH的发病率越来越高。BPH是引起中老年男性排尿障碍最为常见的一种良性疾病,临床表现为下尿路症状,例如尿频、尿急、尿流变细、尿流间断、尿踌躇、排尿费力、尿滴沥等,给患者的生活带来诸多不便,影响其生活质量。美国泌尿学会(American Urological Association,AUA)指南[1]指出,当BPH导致的下尿路症状影响患者的生活质量时则需要治疗干预,目前BPH治疗的金标准仍然是经尿道前列腺切除术(transurethral resection of prostate,TURP),其他微创治疗方式如经尿道钬激光前列腺剜除术(transurethral holmium laser enucleation of prostate,HoLEP)或经尿道铥激光前列腺剜除术(transurethral thulium laser enucleation of prostate,ThuLEP)能够达到与TURP相当的治疗效果。由于激光具有良好的止血性能,可以在组织内形成凝固区,因此对于出血风险更高的BPH患者来说,使用激光进行微创手术是其更好的选择[2-4]。但是以上激光治疗在临床应用中均需要通过尿道对增生的前列腺组织进行切除,所以无法避免地会对尿道产生损伤,术后均会出现不同程度的血尿、尿道狭窄及膀胱颈瘢痕狭窄等并发症[5-7]。
本文主要介绍一种新的不经过尿道治疗BPH的微创激光治疗技术,即经直肠超声引导下经会阴激光消融(transperineal laser ablation,TPLA)。通过经直肠高分辨率超声的实时引导,精准地将直径300 µm的钕钇(Nd:YAG激光)光纤自会阴部置入前列腺增生的移行区,消融尿道旁增生的前列腺组织,以达到解除前列腺部尿道梗阻的目的。本研究旨在分析TPLA治疗前列腺增生的有效性及安全性,对其临床疗效及术后并发症进行初步评估。
1 资料和方法
1.1 患者资料
纳入于上海交通大学附属第六人民医院就诊的2例BPH患者,其中1例患者56岁,诊断BPH 3年,药物治疗1.5年,疗效不理想,患者自述尿频、尿不尽、间断性排尿、排尿费力、夜尿多等症状,治疗前国际前列腺症状评分(international prostate symptom score,IPSS)26分,属于重度下尿路梗阻症状。另外1例患者86岁,诊断BPH 10余年,患者症状包括尿流间断、排尿费力等,治疗前IPSS 26分,属于重度下尿路梗阻症状。术前检查2例患者前列腺特异性抗原(prostate specific antigen,PSA)<4 ng/mL,影像学检查包括经直肠超声及前列腺磁共振成像均提示为BPH,最大尿流率(maximum urine flow rate,Qmax)均<15 mL/s,残余尿量(residual urine volume,RUV)在50 mL以上(表1)。术前患者均签署知情同意书。本研究获得上海交通大学附属第六人民医院伦理委员会批准。
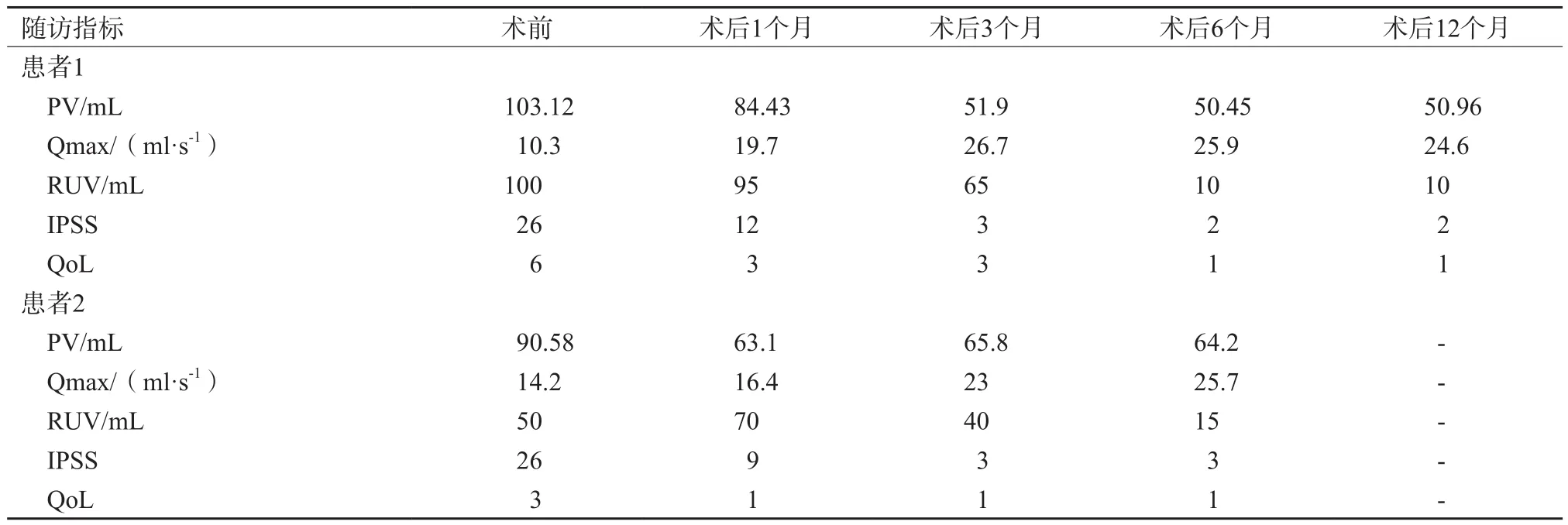
表1 BPH患者术前及术后随访指标
1.2 仪器与设备
超声诊断仪为意大利Esaote公司的MyLab Twice eHD,使用TRT33电子凸-线阵双平面腔内探头(线阵及凸阵探头的中心频率分别为7.5及5.0 MHz,能够纵切面及横切面切换,对定位、引导光纤置入及判断光纤与膀胱及尿道的距离非常重要),激光治疗系统为意大利Esaote公司的EchoLaser X4一体化超声诊断及激光消融系统,搭配一次性使用无菌激光光纤(德国Asclepion公司),光纤直径为300 µm,发射Nd:YAG激光,波长为1 064 nm,该激光治疗系统可支持1~4根光纤同时消融(图1)。穿刺过程中使用的其他器具包括21 G穿刺引导针、辅助进针探头支架等。

图1 TPLA使用的仪器及光纤
1.3 方法和步骤
治疗前完成生命体征、心电图、血常规、尿常规、血生化(包括出凝血时间、肝肾功能)、PSA等检查,评估患者IPSS、QoL,并测量Qmax、RUV,以及经直肠前列腺超声测量前列腺上下径(L)、左右径(W)及前后径(H),计算前列腺体积(prostate volume,PV),计算公式:PV=0.52×L×W×H。IPSS最早在1992年由AUA提出[8],将BPH症状评分作为评估患者病情的轻重程度,总的评分范围为0~35分,并按以下标准分为轻、中、重:0~7分(轻度)、8~19分(中度)、20~35分(重度)。QoL主要用于评估排尿症状对生活质量的影响,从非常好到很痛苦分为0~6分:0(高兴)、1(满意)、2(大致满意)、3(还可以)、4(不太满意)、5(苦恼)、6(很糟)。QoL通常和IPSS联合应用,评估BPH患者病情及比较治疗前后疗效情况[9]。
患者取膀胱截石位,尿道留置三腔导尿管,激光消融过程中采用室温生理盐水对三腔导尿管持续开放冲洗,以保护膀胱及尿道。常规消毒、铺巾后,给予患者静脉麻醉、会阴部组织及前列腺包膜周围利多卡因局部麻醉,麻醉医师全程监测生命体征。在经直肠超声纵切面图像实时引导下先置入21 G穿刺引导针,切换横切面超声图像测量穿刺针与尿道距离,重复上述过程调整穿刺针位置直至穿刺针与尿道距离10 mm以上,然后置入光纤,纵切面超声图像实时观察光纤自穿刺针内穿出进入前列腺组织,光纤裸露段长度为10 mm,随后回退穿刺针直至光纤前端距离膀胱壁至少20 mm。初学者也可采用定位针辅助以便于更快速地掌握光纤布针技巧,即先将1根19 G穿刺针置入前列腺内,将该针位置作为定位的依据,然后根据定位针的位置来调整光纤穿刺引导针的进针路径。
本研究2例患者PV均超过40 mL,因此在其前列腺两侧各布2根光纤分别消融,2根光纤之间距离为10~15 mm,如图2A、B所示。依据Patelli等[10]的报道,采用3~5 W固定能量方案,每次消融保持每根光纤总能量在1 800 J,根据PV采取后退光纤1 cm补充消融1 200 J的方法形成体积更大的消融灶,如图2C所示。当超声图像上气体覆盖所需治疗区域或单根光纤单次治疗达到最高能量1 800 J时终止治疗。全程超声图像实时监控密切关注消融过程,术后三腔导尿管持续冲洗以带走尿道旁组织热量,并于术后10 min予以超声造影,对造影剂灌注缺损的消融灶进行观测。
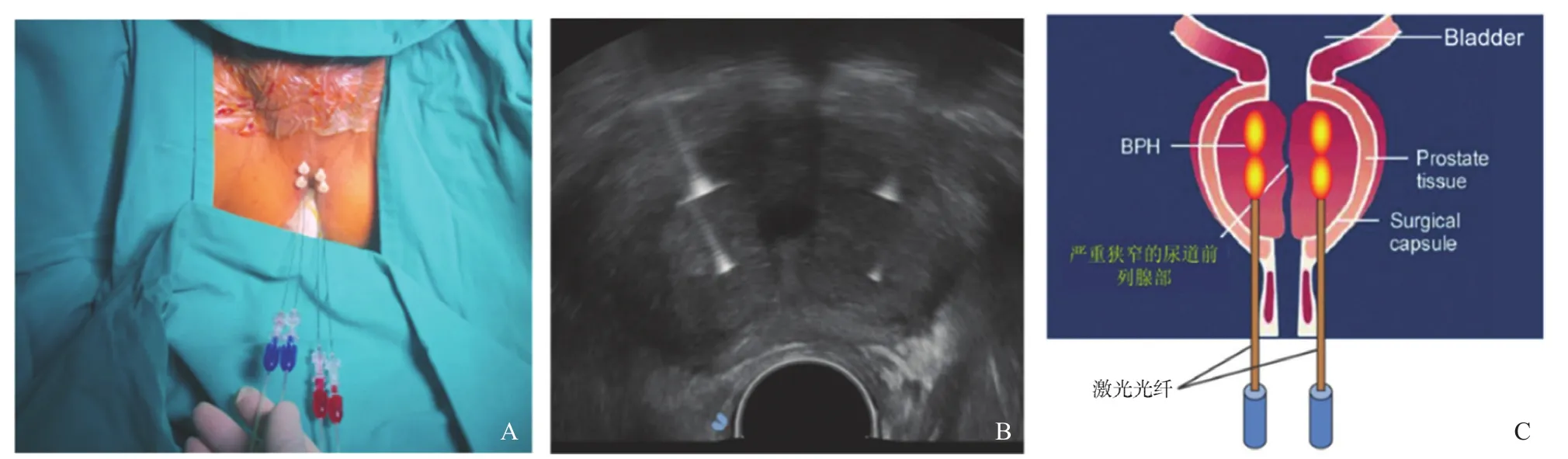
图2 TPLA手术场景及治疗方法示意图
治疗结束后对患者进行生命体征监测及血常规、尿常规、血生化、血电解质检查。术后1、3、6及12个月时回到医院进行随访,观察指标包括消融灶体积、尿常规、Qmax、RUV、PV、IPSS、QoL,并记录患者不良事件及其转归情况。
2 结 果
2.1 疗效观察
疗效观察指标包括PV、Qmax、RUV、IPSS及QoL。术后1个月第1次随访结果显示,2例患者的PV较术前略缩小,Qmax也较术前有所增加,RUV尚未有明显改善,但IPSS及QoL已明显降低,患者主观感觉明显好转。在术后3个月时各项评估指标均有明显改善,在术后6及12个月随访时基本稳定(表1)。
目前第1例患者已随访至15个月,第2例患者随访至8个月,均排尿顺畅,无明显不适感。TPLA治疗后,患者夜尿次数从治疗前6~8次减至1、2次,尿流间断、排尿费力等症状消失,IPSS由重度下尿路梗阻症状下降至轻度,Qmax由术前10 mL/s左右提高至术后20 mL/s以上,RUV由50 mL以上减少至20 mL以下,截至最后1次随访时PV缩小率分别为50.6%及29.1%。
2.2 消融灶大小
2例BPH患者全部成功完成手术。术后10 min超声造影显示消融灶呈不规则椭球形的造影剂灌注缺损区,根据采用的不同消融功率及消融总能量,消融灶体积亦不相同。患者1两侧前列腺各布针2根,两侧分别消融,每侧均后退消融1次,形成的消融灶体积分别为右侧5.13 mL、左侧9.09 mL,术后随访发现灌注缺损区域随着术后随访时间延长逐渐缩小,其中右侧的消融灶在术后3个月完全吸收,超声造影未显示灌注缺损区,左侧消融灶在术后12个月也完全吸收。患者2两侧前列腺各布针2根,两侧分别消融,每侧均后退消融1次,形成的消融灶体积分别为右侧18.18 mL、左侧14.41 mL,术后随访至6个月右侧消融灶完全吸收,左侧消融灶体积缩小程度明显(表2,图3)。
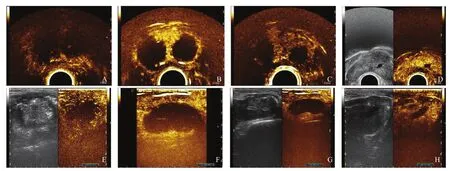
图3 BPH患者2TPLA术后10 min及术后随访前列腺超声造影图像

表2 2例BPH患者TPLA术后消融灶情况
2.3 安全性观察
2例患者手术过程顺利,术中均未出现不良事件。通过实时超声图像可以观察到激光消融后回声增强的汽化区域,消融灶范围可控。治疗后患者未见尿道狭窄、尿潴留、尿失禁、膀胱颈瘢痕狭窄、前列腺包膜穿孔、感染、脓毒症等并发症。
2.3.1 术中出血
激光消融具有出血少、创伤小的独特优势,2例患者术中失血量分别为7.48及15.2 mL,术后血常规较术前无明显变化。激光消融对患者一般情况影响小,尤其适合于年老体弱及轻度贫血患者。
2.3.2 术后前列腺肿胀、继发感染
术后采用激素类药物联合非甾体抗炎药控制局部炎性反应及水肿,能够有效缩短组织水肿期。常规预防性静脉滴注抗生素3 d,控制尿路感染。本研究2例患者术后留观期间均出现尿中白细胞及红细胞增高,出院后注意导尿管护理,1例患者术后1个月时尿常规恢复正常,另1例患者术后1个月时仍有尿路感染,经药物控制后在术后3个月复查时已恢复正常,后期随访中未发现与TPLA治疗相关的尿路感染。
2.3.3 疼痛
TPLA治疗中采用静脉麻醉联合会阴部局部麻醉,治疗过程无痛苦,患者耐受性好,术后留观期视觉模拟评分法(visual analogue scale,VAS)对术后疼痛评分均为0分,即无疼痛感。
2.4 留置导尿管时间观察
由于消融灶对尿道的热刺激以及组织水肿造成的挤压导致患者留置导尿管时间略长,约13及16 d,随访过程中通过反复进行夹管训练,患者可顺利拔管并自主排尿。
3 讨 论
TPLA采用的Nd:YAG激光为连续波的近红外光,波长为1 064 nm,水或血红蛋白对它的吸收率较低,主要被组织蛋白质所吸收,其组织穿透深度较其他激光也更强[11],Nd:YAG激光的光能转换为热能,消融尿道周围增生的前列腺组织以达到解除尿道梗阻的目的。
TPLA治疗的优点:首先,穿刺入路经会阴部组织进入前列腺内,对尿道刺激小。其次,通过直肠腔内高频超声探头的引导,医师可以在超声图像上准确定位光纤置入位置及其与膀胱或尿道的相对位置关系,能够保证治疗时与膀胱及尿道的安全距离。最后,治疗时通过超声图像对激光消融的范围进行实时观测,能保证对增生的前列腺组织达到充分消融。
TPLA的禁忌证主要包括直肠术后或肛门封闭、严重凝血障碍或感染、尿道狭窄的患者。存在膀胱功能障碍的患者也不适合TPLA治疗,如长期导尿管留置导致的膀胱废用或膀胱逼尿肌无力等。另外目前TPLA治疗暂不考虑以中叶增生为主(超声图像上膀胱内前列腺突出度≥10 mm)的BPH患者,一方面当前列腺中叶突向膀胱明显时,其尿流动力学改变的原因较为复杂;另一方面光纤自会阴部进入,若要消融中叶部分可能会对射精管、精阜等结构造成损伤。
通过对以上2例BPH患者TPLA治疗的研究,我们发现激光消融在前列腺组织内能够形成近椭球形消融灶,消融灶体积大小与布针数量、激光消融时的功率及总能量有关。消融灶横切面的前后径略大于左右径,这可能与持续尿道冲洗有关。术后消融灶的吸收以短轴的缩小更显著,因此随着消融灶的吸收缩小,逐步解除了尿道周围的内腺组织对尿道的压迫,从而改善BPH引起的一系列尿路梗阻症状。
为了保证形成足够大的消融灶,对于体积小于40 mL的前列腺,推荐使用2根光纤,两侧各1根,双侧同步消融;对于体积40~70 mL的前列腺,可单侧使用1~2根光纤,两侧同时或分别进行;对于体积70~100 mL前列腺,可单侧使用2根光纤,两侧同时或分别进行消融。使用单侧2根光纤时,光纤之间距离10~15 mm。对前列腺内腺上下径较大者,如超过30 mm,可考虑后退光纤1 cm后补充消融1 200 J。若前列腺左右不对称,可根据内腺实际大小调整布针方案。
本研究采用了多参数对TPLA治疗BPH的疗效进行客观评估。IPSS作为全世界公认的BPH患者的症状评分方法,能够定量地反映BPH症状、指导BPH干预措施的选择并且能够作为治疗后疗效评价的指标。IPSS联合QoL,能够量化BPH患者治疗前后自觉症状以及生活质量的变化。PV、RUV及Qmax指标的变化则客观真实地反映了激光消融后PV的缩小以及患者小便情况的改善,这也进一步印证了IPSS及QoL的改变。
TPLA术中出血少,本研究的2例患者术后都无疼痛感。需要注意术后积极用药缓解前列腺组织的肿胀以及局部炎性反应,在前列腺组织水肿消退前不要过早拔除导尿管。我们目前的用药方案为激素类联合非甾体抗炎药。2例患者术后导尿管留置2周左右均能够顺利拔管实现自主排尿。拔除导尿管后行尿常规检查,如有尿路感染则口服抗生素1周后复查尿常规。术后1个月内如有尿路刺激症状,则采取对症治疗。
综上所述,本研究介绍了一种经直肠双平面超声引导下TPLA治疗BPH的新技术。本研究的2例BPH患者成功接受了TPLA治疗,临床症状获得了改善。日后需要通过扩大样本量的多中心临床研究对其疗效进行验证,并进一步探讨消融灶体积与激光能量的关系,以及对患者术前及术后尿道内压力的变化进行研究,以阐明激光消融治疗BPH的机制。
