Nb0.12-TiO2对脑胶质瘤的光热治疗及乏氧微环境的影响
2021-07-31赵凌舟龚佳丽陈志钢赵晋华
孙 娜,耿 鹏,赵凌舟,龚佳丽,邢 岩,陈志钢,赵晋华
1. 上海交通大学附属第一人民医院核医学科,上海 200080;
2. 东华大学材料科学与工程学院,上海 201620
脑胶质瘤是最常见的颅内原发性恶性肿瘤,呈浸润性生长,术后复发率高,且易对放化疗产生抵抗,目前临床治疗效果不佳[1-3]。纳米材料二氧化钛(TiO2)是金属钛(Ti)最常见的化合物。既往研究[4]发现,TiO2在正电子核素18F的切伦科夫辐射下可产生大量的活性氧类(reactive oxygen species,ROS),能有效地杀伤肿瘤细胞,具有优异的光动力治疗效果。2017年,Yu等[5]向TiO2中掺杂元素铌(Nb)合成了铌-二氧化钛(Nb0.12-TiO2),发现Nb0.12-TiO2可在近红外光(near-infrared light,NIR)的激发下将光能迅速转换为热能,有潜力用于肿瘤的光热治疗。此外,Cheng等[6]的研究表明,光敏剂用于肿瘤的光热治疗时,或许可以在有效杀伤肿瘤细胞的同时下调低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)的表达,改善肿瘤的乏氧微环境,进而抑制肿瘤细胞的转移。乏氧是脑胶质瘤微环境的主要特点之一,与脑胶质瘤细胞的增殖、侵袭、转移和放化疗抵抗密切相关[7-9]。本研究拟初步评估Nb0.12-TiO2对脑胶质瘤的光热治疗效果,并同时探讨其对HIF-1α表达水平的影响。
1 材料与方法
1.1 一般材料
人脑胶质瘤细胞(U87细胞)购自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心,将U87细胞置于含10%胎牛血清的DMEM高糖培养基中,于37 °C、CO2体积分数为5%、饱和湿度的培养箱中静置培养。
1.2 试剂与仪器
Nb0.12-TiO2由东华大学纤维材料改性国家重点实验室提供。二硬脂酰基磷脂酰乙醇胺-聚乙二醇{1, 2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[square(polyethylene glycol)],DSPE-PEG}购自上海炎怡生物科技有限公司,油酸、十八烯、十八醇、氯化铌购自Sigma-Aldrich(上海)贸易有限公司,四乙醇钛、氯仿、丙酮、甲醇购自国药集团化学试剂有限公司,X射线衍射仪(X-ray diffractometer,XRD)购自布鲁克(北京)科技有限公司,透射电子显微镜(transmission electron microscope,TEM)购自美国FEI公司,电感耦合等离子体原子发射光谱仪(inductively coupled plasma-atomic emission spectrometer,ICP-AES)购自美国Leeman Labs公司,胎牛血清、DMEM培养基、胰蛋白酶、磷酸盐缓冲生理盐水(phosphatebuffered saline,PBS)购自美国Gibco公司,细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自东仁化学科技(上海)有限公司,活死细胞双染试剂盒购自上海碧云天生物技术有限公司,TRIzol总RNA提取试剂盒购自美国Sigma公司,引物和实时荧光定量聚合酶链反应(realtime fluorescence quantitative polymerase chain reaction,RTFQ-PCR)试剂盒购自上海冠泰生物科技有限公司(BioTNT)。激光器购自西安赫胥尔镭得激光科技有限公司,酶标仪购自德国Thermo Fisher Scienti fic公司,激光扫描共聚焦显微镜购自美国Thorlabs公司,PCR仪购自美国Bio-Rad公司。
1.3 方法
1.3.1 Nb0.12-TiO2的制备和表面改性
在连续的干燥氮气流中,将油酸(3 mL)、十八烯(7 mL)和十八醇(20 mmol)混合物加热至130 ℃并保持30 min,去除残存的水汽和氧气。然后将溶液冷却至80 ℃,先后加入四乙醇钛(2 mmol)和氯化铌甲醇溶液(0.4 mmol)。待甲醇完全蒸发后,在30 min内将上述溶液升温至280 ℃以上,并在此温度下保持60 min使纳米晶体生长,溶液变成蓝色。随后,将体系自然冷却至80 ℃,加入适量丙酮,快速离心(5 000 r/min,5 min)后得到深蓝色沉淀,即Nb掺杂TiO2纳米晶。当前驱体中氯化铌和四乙醇钛的摩尔比为20%,使用ICP-AES确定合成的纳米晶样品中的Nb/(Nb+Ti)摩尔比为12.2%,该样品命名为Nb0.12-TiO2。所合成的Nb0.12-TiO2纳米晶表面是油酸配位,不能分散在水中。为了获得亲水性,将20 mg Nb0.12-TiO2纳米晶与50 mg DSPE-PEG分散在10 mL氯仿溶液中,超声10 min后,在室温条件下持续磁力搅拌氯仿分散液,使其缓慢蒸发。随后,将5 mL去离子水加入到脂质膜中并超声处理10 min,将水分散液低速离心(3 500 r/min,20 min)以除去可能形成的大聚集体,高速离心(10 000 r/min,10 min)以纯化可能的过量脂质,最终得到磷脂包裹的纳米晶体(记为Nb0.12-TiO2/PEG)。之后对Nb0.12-TiO2的表征、分散性能和光热转换性能等进行分析。
1.3.2 CCK-8法测定Nb0.12-TiO2对U87细胞的毒性
取对数生长期的U87细胞,以每孔5×103个接种于96孔板上,在37 ℃、CO2体积分数为5%的无菌细胞培养箱内培养过夜,吸弃96孔板各孔内的旧培养基,加入含不同Nb0.12-TiO2质量浓度(0.02、0.10、0.50、1.00、5.00 g/L)的新鲜完全培养基,同时设立PBS对照组和空白对照组,以上各组均设立5个复孔,加样结束后置于37 ℃、CO2体积分数为5%的无菌细胞培养箱中继续静置温育24 h,之后按照CCK-8说明进行测定。以上实验重复3次以确认结果。
1.3.3 活死细胞染色评估Nb0.12-TiO2对U87细胞的杀伤作用
取对数生长期U87细胞,以每孔1×104个接种于6孔板上,在37 ℃、CO2体积分数为5%的无菌细胞培养箱中静置培养过夜,弃去各皿内的旧培养基,加入新鲜的完全培养基,随机分为PBS组、Nb0.12-TiO2组、PBS + NIR组和Nb0.12-TiO2+NIR组,PBS作为对照组,Nb0.12-TiO2组和Nb0.12-TiO2+NIR组的终质量浓度为0.2 g/L,之后继续在无菌细胞培养箱中静置培养4 h,PBS+NIR组和Nb0.12-TiO2+NIR组均以功率密度为1.0 W/cm2的1 064 nm波长NIR照射10 min,之后各组细胞按照活死细胞双染色试剂盒说明进行染色,并置于激光共聚焦显微镜下488 nm处观察各皿内细胞的荧光亮度,在同一放大倍数(×20)下拍摄图像并存储。以上实验重复3次以确认结果。
1.3.4 Nb0.12-TiO2介导的光热治疗对U87细胞HIF-1α基因表达水平的影响
取对数生长期U87细胞,以每孔1×105个接种于6孔板上,在37 ℃、CO2体积分数为5%的无菌细胞培养箱中静置培养过夜,弃去各皿内的旧培养基,加入新鲜的完全培养基,随机分为PBS组、Nb0.12-TiO2组、PBS+NIR组和Nb0.12-TiO2+NIR组,PBS作为对照组,Nb0.12-TiO2组和Nb0.12-TiO2+NIR组的终质量浓度为0.2 g/L,之后继续在无菌细胞培养箱中静置培养4 h,PBS+NIR组和Nb0.12-TiO2+NIR组均以功率密度为1.0 W/cm2的1 064 nm波长NIR照射10 min,之后对各组细胞提取RNA,RTFQ-PCR法评估各组细胞HIF-1α的基因表达水平,引物序列见表1。以上实验重复3次以确认结果。

表1 RTFQ-PCR引物序列
1.4 统计学处理
2 结 果
2.1 Nb0.12-TiO2的表征分析
使用XRD研究TiO2纳米晶的晶相,如图1A所示,纯的TiO2纳米晶和Nb掺杂的TiO2纳米晶样品都显示出同样的衍射峰图形,且所有衍射峰与锐钛矿相TiO2标准卡片[粉末衍射标准联合委员会(the Joint Committee on Powder Diffraction Standards,JCPDS)标准卡片编号为21-1272]的衍射峰匹配一致,表明两者具有相同的TiO2纳米晶。对于Nb0.12-TiO2掺杂样品,并没有发现任何其他杂峰,结果表明,Nb5+离子被成功地掺杂到了TiO2的晶格中,但是因为两种元素离子半径比较接近,所以掺杂并未明显改变TiO2基质晶格。
动态光散射(dynamic light scattering,DLS)结果显示,去离子水中Nb0.12-TiO2的平均动力学直径约为30 nm,最终修饰改性后的Nb0.12-TiO2/PEG的直径约为80 nm(图1B),两者均显示出较小的纳米级水动力学直径。
TEM结果表明,Nb0.12-TiO2样品由直径约为20 nm的纳米颗粒组成,这些小纳米颗粒没有具体的形状(图1C)。Nb0.12-TiO2纳米晶表面是油酸配位,不能分散在水中,而经过改性后的Nb0.12-TiO2/PEG可以很好地分散在水溶液中(图1D),且与本课题组之前已发表的研究[5]报道一致,Nb0.12-TiO2纳米晶的光热转换效率为40.6%,高于典型的半导体。这么高的光热转换效率应归因于Nb掺杂TiO2纳米晶的强近红外吸收和高效的非辐射跃迁。以上结果证实Nb掺杂的TiO2纳米晶体具有优异的光热性能和激光稳定性,赋予其在光热治疗中的巨大潜力。
2.2 CCK-8法检测
Nb0.12-TiO2(0.02~5.00 g/L)与U87细胞共培养24 h后,各组细胞活性均大于90%,与PBS组的组间差异无统计学意义(P>0.05,图2)。由此可见Nb0.12-TiO2在0.02~5.00 g/L质量浓度范围内对U87细胞无明显的毒性作用。

图2 CCK-8法检测不同质量浓度的Nb0.12-TiO2对U87细胞活性的影响
2.3 活死细胞染色
PBS组、Nb0.12-TiO2组和PBS+NIR组未出现明显的细胞凋亡,而Nb0.12-TiO2+NIR组出现大量细胞死亡(图3),说明Nb0.12-TiO2对脑胶质瘤具有显著的光热治疗效果。

图3 活死细胞染色评估Nb0.12-TiO2对U87细胞的杀伤作用
2.4 RTFQ-PCR实验
Nb0.12-TiO2+NIR组HIF-1α的表达大幅下调,与PBS组(0.52 ± 0.20vs1.00±0.00,P<0.001)、Nb0.12-TiO2组(0.52±0.20vs0.99±0.07,P<0.001)和PBS+NIR组(0.52±0.20vs1.01±0.03,P<0.001)的组间差异均有统计学意义(图4)。
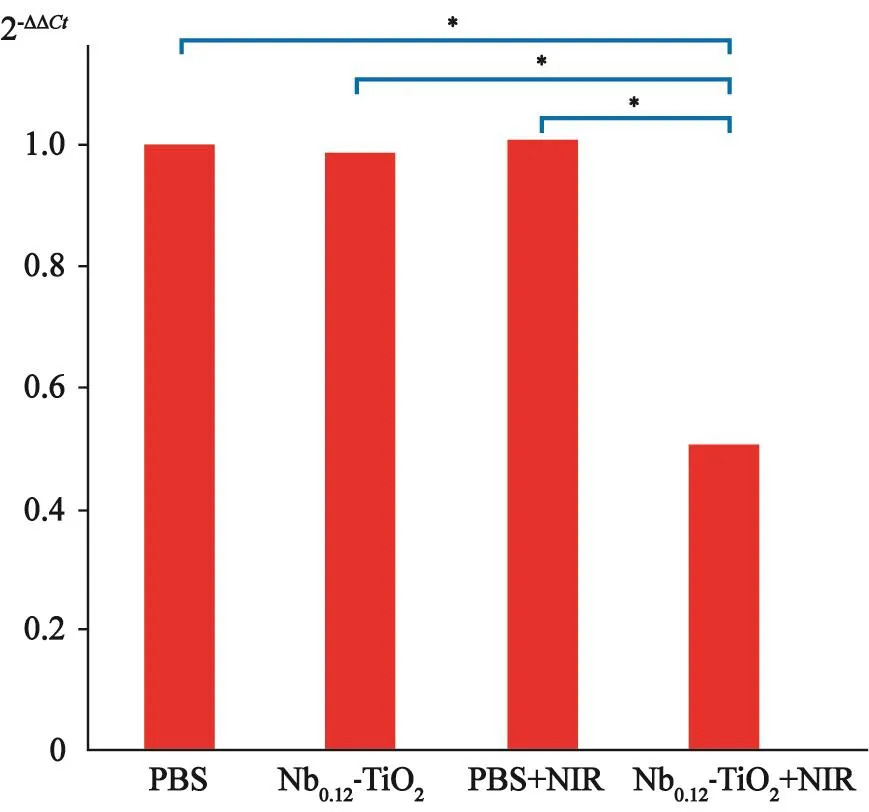
图4 RTFQ-PCR评估Nb0.12-TiO2光热治疗后U87细胞的HIF-1α基因水平
3 讨 论
脑胶质瘤是最常见的颅内原发性恶性肿瘤,但目前尚无有效的治疗方法。光动力治疗与光热治疗是近年来新兴的治疗方法,因其具有创伤小、治疗时间短且不易产生耐药性等优点而引起了研究者的广泛关注[10-12]。
纳米材料TiO2作为金属钛最常见的化合物,合成简便、结构稳定、价廉易得,且与已经广泛应用于医用植入物的金属Ti相似,具有优异的生物相容性[13-14]。Yamaguchi等[15]将TiO2纳米颗粒与脑胶质瘤细胞共培养3 h后,在紫外光照射下超过90%的脑胶质瘤细胞出现死亡或生长抑制,治疗效果显著。然而紫外光穿透能力弱,且长时间紫外光照射会损伤机体DNA甚至诱发癌变,因而限制了TiO2在脑胶质瘤中的进一步应用。Kotagiri等[4]以正电子核素18F的切伦科夫辐射可激活TiO2的光动力学效应开展研究,体内治疗试验显示纤维肉瘤裸小鼠移植瘤模型的肿瘤体积在18F激发的TiO2的光动力治疗后第3天缩小40%左右,1个月后肿瘤完全消失,4个月后达到完全缓解,说明光动力治疗效果显著。2017年Yu等[5]合成了Nb0.12-TiO2,发现Nb0.12-TiO2在常温条件下NIR光照10 min即可快速升温至50 ℃以上,说明光热转换能力显著优于传统的光敏剂。本研究结果表明,TiO2在掺杂Nb后仍有很高的生物相容性,且Nb0.12-TiO2在NIR照射下可有效地杀伤脑胶质瘤细胞,光热治疗效果显著。
肿瘤的发生、发展与肿瘤微环境的变化密切相关,乏氧是脑胶质瘤微环境的主要特点之一。乏氧不仅使脑胶质瘤自身更具侵袭性,而且与脑胶质瘤的放化疗抵抗密切相关。HIF-1α在细胞内的表达受氧浓度的调节,在常氧条件下,HIF-1α会被快速降解,但在乏氧条件下,HIF-1α保持稳定并进入细胞,激活多种下游基因如血管内皮生长因子(vascular endothelial growth factor,VEGF)、葡萄糖转运蛋白-1(glucose transporter-1,Glut-1)等的表达,促进肿瘤的生长、增殖和迁移[16-19]。Gillespie等[20]在颅内原位脑胶质瘤模型中利用HIF-1α siRNA抑制HIF-1α的表达,结果发现治疗50 d后肿瘤体积较对照组减少了79%,且HIF-1α的转录靶向分子VEGF、Glut-1的表达也显著降低。由此可见,改善脑胶质瘤的乏氧微环境有利于脑胶质瘤的治疗。本研究结果表明,光敏剂Nb0.12-TiO2在对脑胶质瘤细胞发挥光热治疗作用的同时显著下调了HIF-1α的表达,或可改善脑胶质瘤的乏氧微环境。
综上所述,Nb0.12-TiO2作为一种新型光敏剂,具有优异的光热治疗效果,并可在发挥光热治疗时抑制HIF-1α的表达,改善脑胶质瘤的乏氧微环境,有望在将来用于脑胶质瘤的临床治疗。
