紫杉醇衍生物(TAH)脂质体的处方工艺优化及初步质量评价研究
2021-07-30张辛宁刘杨佳叶田田牟良玉刘东春王淑君
张辛宁,刘杨佳,吴 悦,叶田田,牟良玉,刘东春*,王淑君*
(1.沈阳药科大学 中药学院,辽宁 沈阳 110016;2.沈阳药科大学 药学院,辽宁 沈阳 110016)
近年来,肿瘤分子靶向技术已成为肿瘤治疗的热点,因其特异性强、耐受性好、疗效高、毒性及不良反应低等特点而备受瞩目[1]。紫杉醇是从紫衫属短叶紫衫茎皮中提取出的具有四环二萜结构的类紫杉烷天然药物组分,在多种癌症,如乳腺癌、非小细胞肺癌、卵巢癌等的临床治疗中已经得到了应用。紫杉醇水溶性差、口服生物利用度低[2],所以国内外上市的紫杉醇注射液在制备时,需加入聚氧乙烯蓖麻油和无水乙醇作为增溶剂才能供临床使用。由于溶解度和选择性较差等特点,紫杉醇存在着很多缺陷,例如毒副作用大、使用不便、易产生耐药性,且无法透过血脑屏障[3]。
药物科学家们试图通过改变紫杉醇的结构和剂型以解决上述问题[4-6],因其分子结构的复杂性,通过改变 PH 值、成盐法、助溶剂都不能很好地解决其溶解度问题[7]。研究者们从提高药物的溶解性和改造药物化学合成途径两方面入手,试图通过改造官能团或结构来合成全新的化合物[8-9]。紫杉醇衍生物(TAH)是一种新型紫杉醇衍生物,是通过改造紫杉醇的官能团和结构合成的新化合物,结构如图1 所示,目前正在处于开发研究阶段。本试验旨在对紫杉醇衍生物 TAH 进行制剂学性质研究,筛选出最佳处方及工艺,对 TAH 脂质体(TAH-Lip)的理化性质等进行系统考察。
Fig.1 The chemical structure of TAH图1 TAH的化学结构
1 仪器与材料
EX125DZH 十万分之一天平(奥豪斯仪器有限公司);超声波清洗器(上海声彦超声波仪器有限公司);恒温水浴锅(上海亚荣生化仪器厂);RE52CS 旋转蒸发仪(上海生化亚荣仪器厂);DF-101S 集热式恒温磁力搅拌器(巩义市英峪予华仪器);UV-9100 紫外分光光度计(北京瑞利分析仪器有限公司);TBL80-2B 低速台式离心机(上海安亭科学仪器厂);Zetasizer Nano 纳米粒度和 Zeta 电位仪(马尔文仪器有限公司);Waters2695/2996 高效液相色谱仪(Waters 公司);高压均质机(安拓思纳米技术有限公司);101-3 电热鼓风干燥箱(天津市泰斯特仪器有限公司)。
TAH 原料药(沈阳鑫泰格尔医药科技开发有限公司,纯度 ≥ 98%);蛋黄卵磷脂(PL100M、PC98T,上海艾韦特医药科技有限公司);大豆卵磷脂(S100,德国利宝益公司);大豆卵磷脂(SPC,上海太伟药业有限公司);胆固醇(艾伟拓医药科技有限公司);维生素 E(大连美仑生物技术有限公司);维生素 C(陕西圣瑞医药科技有限公司);BHT、BHA(西安悦来医药科技有限公司);赖氨酸(广州仁信生物科技有限公司);甲醇(色谱纯,天津富宇精细化工有限公司)、无水乙醇(分析纯,天津康科德公司);甲酸(色谱纯,迪马科技有限公司);乙酸铵(色谱纯,上海创赛科技有限公司);葡聚糖凝胶 G-50(上海源叶生物科技有限公司)。
2 方法与结果
2.1 制备方法的筛选
TAH 适用于被动载药法制备脂质体。薄膜分散法和乙醇注入法是实验室常用的被动载药法。本实验分别考察了这两种制备方法,对所得脂质体外观和包封率进行比较。
2.1.1 薄膜分散法
称取 TAH 20 mg、胆固醇(Chol)50 mg、磷脂(PC)400 mg 溶于 5 mL 无水乙醇中,超声溶解,于 60 ℃ 真空旋转蒸发至无水乙醇挥干,形成干燥薄膜,向烧瓶中加入 10.0 mL 注射用水,在 40 ℃ 水浴水化 30 min,用超声细胞粉碎机 400 W 探头超声 10 min(工作3 s,间歇3 s),依次过 0.45、0.22μm 的微孔滤膜整粒,测定脂质体包封率。

Fig.2 Flow diagram for TAH liposomes prepared by thin film dispersion method图2 薄膜分散法制备TAH 脂质体的工艺流程图
2.1.2 乙醇注入法
按处方量称取 TAH 20 mg、Chol 50 mg、PC 200 mg 溶于 3 mL 无水乙醇中,超声溶解,用注射器吸取乙醇液,缓慢注入 10.0 mL 注射用水中。在 60 ℃ 下恒温磁力搅拌至无醇味,约 1 h,冷却至室温,用超声细胞粉碎机 400 W 探头超声 10 min(工作3 s,间歇3 s),依次过 0.45、0.22μm 的微孔滤膜整粒,测定脂质体包封率。

Fig.3 Flow diagram for TAH liposomes prepared by ethanol injection method图3 乙醇注入法制备 TAH 脂质体的工艺流程图
2.1.3 制备方法的确定
结果见表1。该结果表明,在制备过程中发现乙醇注入法有时会有结晶析出,出现絮凝、分层现象,且脂质体不成形。薄膜分散法工艺稳定,制备脂质体的包封率高于乙醇注入法,薄膜分散法在旋转蒸发过程中,圆底烧瓶内壁上形成一层脂质薄膜,在此过程中可能发生了一定的相互作用,增加了相互间亲和力,经水化后得到的脂质体混悬液均匀、稳定,获得了较高的包封率。因此,最终选用薄膜分散法制备 TAH 脂质体。

Table 1 The entrapment efficiencies of liposomes prepared by different methods (n = 3)表1 不同制备方法制得脂质体包封率结果(n = 3)
2.2 制备工艺考察
脂质体的成膜温度及时间、水化温度及时间、均质次数及压力对脂质体性状和稳定性影响较大。因此,对这些工艺条件进行单因素考察,根据单因素实验结果,最终确定脂质体的工艺条件。
2.2.1 成膜温度考察
固定其它因素不变,考察成膜温度分别为 40、50、60 ℃ 制备的脂质体对其包封率的影响,结果见表2。结果表明,成膜温度在 40~60 ℃ 之间对其包封率无影响,脂质体的稳定性较好,但制备脂质体时温度应在相转变温度以上,此时脂质体双分子层排列将更为紧密,脂质体稳定性增强[10],温度的升高会加快不饱和磷脂的氧化,故成膜温度选择 40 ℃。
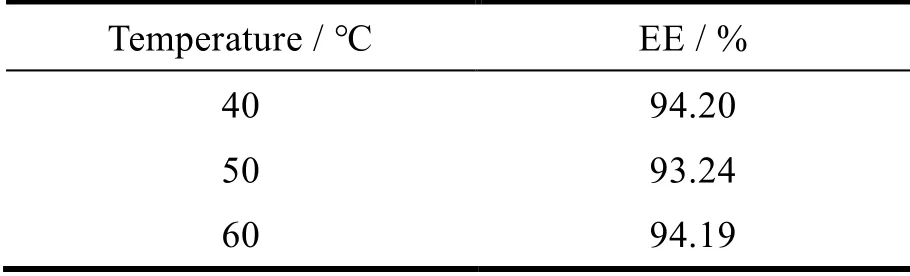
Table 2 Effects of film-forming temperature on the quality of liposomes表2 成膜温度对脂质体质量的影响
2.2.2 水化条件考察
固定其它因素不变,考察水化温度分别为 40、50、60 ℃,水化时间分别为 20、30、40 min制备的脂质体对包封率和粒径的影响,结果见表3。结果表明,水化温度为在 40~60 ℃ 之间对其包封率无影响,结合磷脂的相变温度,考虑制剂稳定性,最终选择水化温度为 40 ℃。水化 20 min 时,不能水化完全。水化 30、40、50 min 结果无明显差别,因此,最终选择水化时间为 30 min。

Table 3 Effects of hydration conditions on the quality of liposomes表3 水化条件对脂质体质量的影响
2.2.3 高压均质法考察
固定其它因素不变,考察均质次数分别为 4、7、10 次和均质压力 600、700、800 bar 对制备的脂质体粒径的影响,结果见表4。结果表明平均粒径和均质次数成反比,均质超过 7 次后继续增加均质次数所得脂质体的平均粒径变化不大,当均质 10 次时,PDI < 0.3,因此,将均质次数定为 10 次。当均质压力为 700~800 bar 时,PDI < 0.3,800 bar 可获得更理想的粒径。因此,将均质压力定为 800 bar。
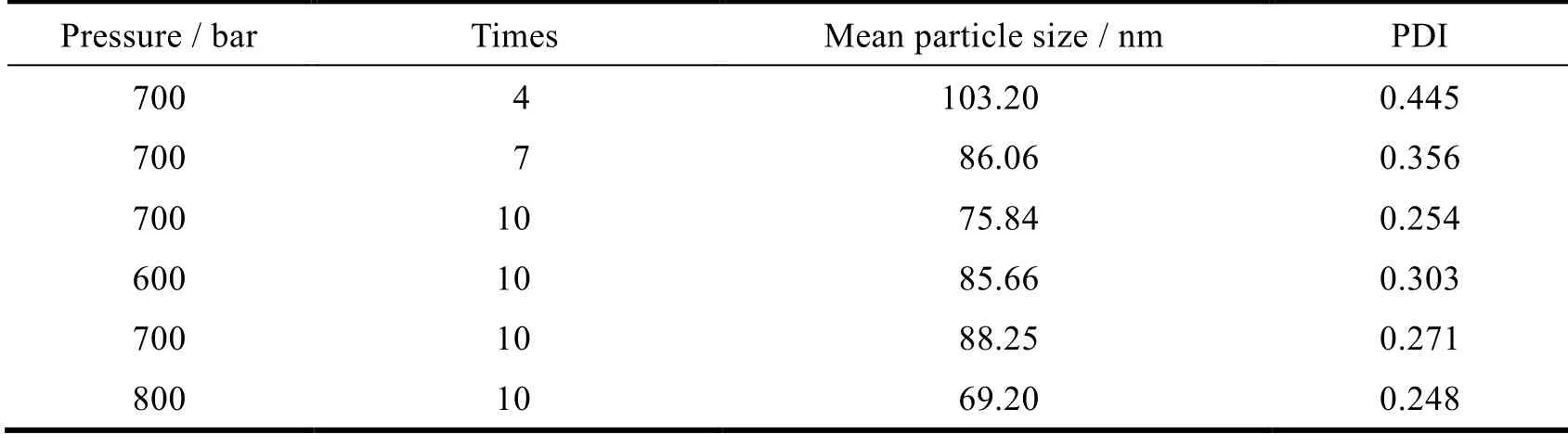
Table 4 The effects of times and pressures of homogenizing on the particle sizes of TAH liposomes (n = 3)表4 均质次数和压力对 TAH 脂质体粒径的影响(n = 3)
2.3 处方筛选
根据脂质体常用的辅料及种类,以包封率为重点考察指标,对辅料的种类及用量进行筛选,根据处方单因素实验结果,最终确定脂质体的处方组成。
2.3.1 磷脂种类的考察
固定其它因素不变,分别使用不同厂家的磷脂制备脂质体,测定其包封率。结果见表5。结果表明,两种蛋黄卵磷脂制备的脂质体外观浑浊,包封率低,而大豆卵磷脂制备的脂质体均匀、稳定,且大豆卵磷脂 S100 制得的脂质体包封率最高。因此,选用德国利宝益公司生产的 S100大豆卵磷脂。

Table 5 The effects of phospholipid species on the quality of liposomes (n = 3)表5 磷脂种类对脂质体质量的影响(n = 3)
2.3.2 药脂比的考察
固定其它因素不变,分别以 TAH : PC(w / w)为 1 : 10、1 : 15、1 : 20、1 : 25、1 : 30,按“2.1.1项”方法制备脂质体,测定脂质体包封率,结果见表6。结果表明,随着脂质量的增加,包封率随之上升,当药脂比为 1 : 20(w / w)时,包封率达到最大值。当药脂比为 1 : 30 时,水化后的脂质体较为浑浊,放置一段时间后出现药物沉淀,稳定性不好。

Table 6 The effects of drug to lipids mass ratio on the quality of liposomes (n = 3)表6 药脂比对脂质体质量的影响(n = 3)
2.3.3 PC 与 Chol 比例的考察
固定其它因素不变,分别以PC : Chol(w/w)为3 : 1、5 : 1、8 : 1、10 : 1:12 : 1,按“2.1.1项”方法制备脂质体,测定脂质体包封率,结果见表7。结果表明,当PC : Chol(w/w)为3 : 1时,有絮状沉淀,脂质体未能能成型。后随着PC比例的增加,包封率随之上升,当PC : Chol为10 : 1(w/w)时,包封率达到最大值,继续提高PC比例,包封率反而降低。

Table 7 The effects of phospholipid to cholesterol ratio on the quality of liposomes (n = 3)表7 磷脂与胆固醇比例对脂质体质量的影响(n = 3)
2.3.4 抗氧剂的考察
磷脂是制备脂质体使用的主要膜材,但其不稳定,容易氧化,导致脂质体的稳定性下降。因此在脂质体制备过程中,常常会添加抗氧剂,抑制磷脂的游离基反应从而防控氧化,常用的抗氧剂有维生素 E(VE)、维生素 C(VC)、赖氨酸等。TAH 脂质体氧化程度采用氧化指数,即A233与A215的比值作为检测磷脂氧化的评价指标。
2.3.4.1 不同抗氧剂的抗氧化效果考察
磷脂是制备脂质体使用的主要膜材,但其不稳定,容易氧化,导致脂质体的稳定性下降。因此在脂质体制备过程中,常常会添加抗氧剂,抑制磷脂的游离基反应从而防控氧化,常用的抗氧剂有维生素 E(VE)、维生素 C(VC)、丁基羟基茴香醚(butyl hydroxyanisole,BHA)、二丁基羟基甲苯(butylated hydroxytoluene,BHT)、赖氨酸。氧化程度拟采用氧化指数,即A233与A215的比值作为检测磷脂氧化的评价指标。将含有 0.02% 不同抗氧化剂的空白脂质体于 40 ℃ 加热 15 h后,用氧化指数作为评价指标,试验结果如图4 所示。结果表明,空白组的氧化程度较大,吸光度由刚制备时的 0.202 增加至 0.634,而添加不同抗氧剂实验组的氧化指数都小于空白组。抗氧剂作用效果顺序为:BHT > VE> BHA > VC> 赖氨酸,添加 BHT 的实验组抗氧化效果最好。
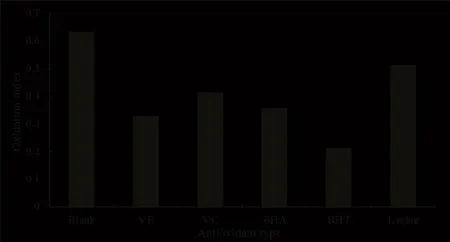
Fig.4 Antioxidant effects of different antioxidants on liposomes图4 不同抗氧化剂对脂质体的抗氧化效果
2.3.4.2 抗氧剂用量考察
分别配制不同浓度的 BHT 乙醇溶液(0.01%、0.02%、0.05%、0.1%、0.15%、0.20%)替代无水乙醇制备空白脂质体。于 40 ℃ 加热 15 h 后,分别于 3、6、9、12、18 h 测定氧化指数,结果见图5。结果表明,加入 BHT 后可以有效防控脂质体氧化。3 h 内各氧化指数相差不大,随着 BHT 加入量的增加,氧化指数随之减小,在 BHT 浓度为 0.10% 及 0.15% 时,BHT 抗氧化效果基本一致,因此选用浓度为 0.10% 的 BHT 作抗氧剂。
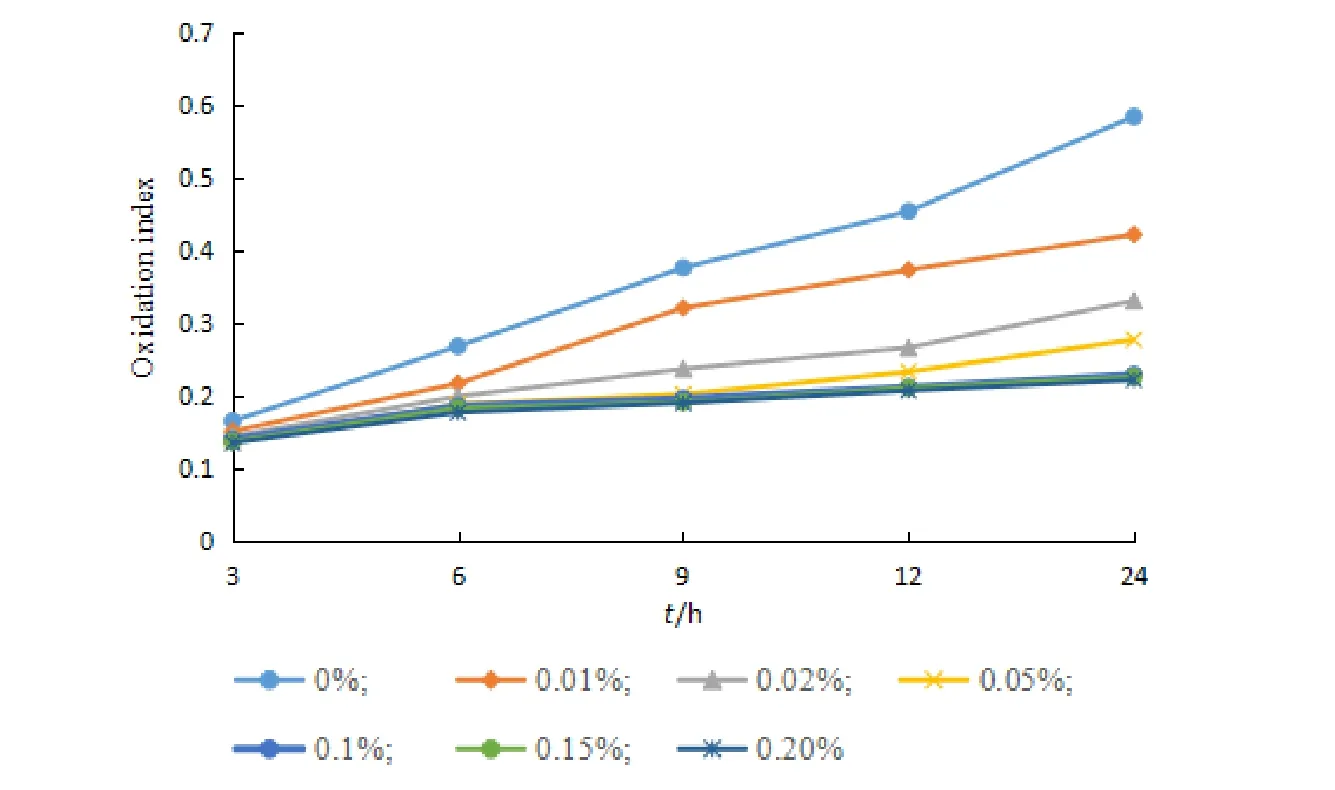
Fig.5 Effects of different BHT dosages on the antioxidant effect of liposomes图5 不同BHT用量对脂质体抗氧化效果的影响
2.4 脂质体含量、有关检测
2.4.1 检测波长的确定
精密称取 TAH 适量,加甲醇溶解并稀释,配制成浓度为 0.02 g·L-1的溶液,选取甲醇溶液作为空白对照,测定结果表明,TAH 在波长 283 nm 有最大吸收峰,而辅料在此处无吸收,故确定测定波长为 283 nm。
2.4.2 色谱条件
色谱柱:Welch Ultimate®Plus C18(150 mm × 4.6 mm,3.5μm);流动相:5 mmol·L-1乙酸铵为水相,以水相 : 乙腈(V/V)= 60 : 30为流动相A相,以水相 : 乙腈(V/V)= 20 : 80为流动相B 相;检测波长:283 nm;流速:1.0 mL·min-1;柱温:30 ℃;进样量:20μL;进样盘温度:10 ℃。按表8进行梯度洗脱。

Table 8 Mobile phase gradient elution program表8 流动相梯度洗脱程序
2.4.3 标准曲线的绘制
精密称取 TAH 适量,配成质量浓度为 0.5 g·L-1的储备液。分别精密移取该储备液 0.5、0.8、1.0、1.2 和 1.5 mL 于 10 mL 量瓶中,加入甲醇稀释至刻度,摇匀,配制成质量浓度为 25、40、50、60 和 75 mg·L-1的标准溶液。按“2.4.2色谱条件”进样测定。以浓度(ρ,mg·L-1)与峰面积(A)进行线性回归处理,求得线性回归方程为A= 2.476 9 × 104ρ- 1.065 × 103(r= 0.999 9)。
2.4.4 回收率与精密度试验
按处方配比制备空白脂质体,加入到含处方量药物溶液的量瓶中,用甲醇破乳,并稀释定容,使药物质量浓度分别为 25、50、75 mg·L-1,离心,取上清液进行含量测定,并计算回收率。同法制备上述溶液,于日内及日间测定吸光度并计算药物含量,考察方法的精密度。低、中、高质量浓度(25、50、75 mg·L-1)药物的方法回收率为(100.11 ± 0.76)%;低、中、高质量浓度药物的日内 RSD 分别为 0.85、0.79、0.62;日间 RSD 分别为 0.95、0.89、0.70。
2.4.5 样品测定
精密吸取脂质体供试品 5.0 mL 于 20 mL 量瓶中,加甲醇破乳,并定容至刻度,超声 3 min,于 4 000 r·min-1离心 10 min,取上清液得有关物质待测样品;精密吸取有关物质待测样品 1 mL至 10 mL 量瓶中,稀释并定容至刻度,得含量待测样品。按“2.4.2项”方法检测,计算脂质体中药物的含量及有关物质。测定脂质体中 TAH 含量为(1.90 ± 0.22)g·L-1,总杂为(0.24 ± 0.17)%。
2.5 脂质体包封率与载药量的测定
按照最优处方及工艺制备 TAH 脂质体,将样品加于微型凝胶柱的顶端,3 000 r·min-1离心3 min,继续加入 0.2 mL 蒸馏水于凝胶柱的顶端,按上述条件离心洗脱,重复操作 4 次,合并洗脱液至 20 mL 容量瓶中,加少许甲醇超声 2 min,使其破乳,静置至室温,甲醇定容至刻度,在紫外 283 nm 测定吸光度,代入线性方程计算吸光度C1;另精密量取 0.2 mL 脂质体至 20 mL容量瓶中,加少许甲醇超声 2 min,使其破乳,静置至室温,甲醇定容至刻度,在紫外 283 nm 处测定吸光度,代入线性方程计算浓度C2。计算 TAH 脂质体包封率(entrapment efficiency,EE),包封率的计算公式为:包封率 EE% =C1/C2× 100%。载药量指脂质体中药量与载体材料的重量之比。载药量的计算公式为:载药量 LC% =mTAH× EE% /m脂质× 100%。测定三批样品,结果表明冻干制剂包封率为(92.89 ± 1.32)%,载药量为(4.03 ± 1.00)%。
2.6 高温加速试验
分别制备含抗氧剂及不含抗氧剂的 TAH 脂质体混悬液,避光,置于高温 60 ℃ 条件下贮存 15 天,分别于试验期间的第 0、5、10、15 天时取样,对其各项外观、粒径、包封率、含量、有关物质进行考察,结果见表9和表10。
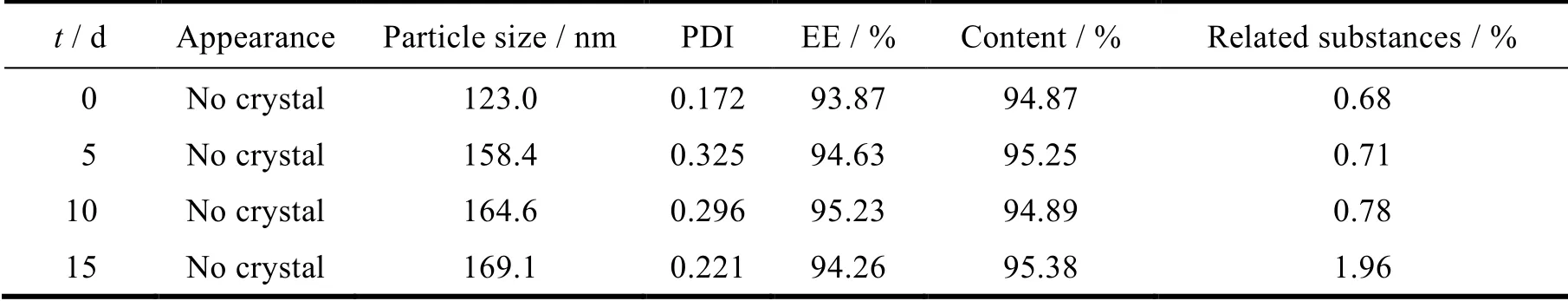
Table 9 Accelerated test results (containing antioxidants)表9 加速试验结果(含抗氧剂)

Table 10 Accelerated test results (without antioxidants)表10 加速试验结果(不含抗氧剂)
结果显示,两批 TAH 脂质体加速 10 天内,外观性状均未发生显著变化,包封率、粒径、PDI、含量、有关物质均无明显差异。当加速第 15 天时,不含抗氧剂的 TAH 脂质体产生少量降解产物及杂质,而含抗氧剂的 TAH 脂质体,降解产物较少,相对较稳定。从高温加速试验可以看出,含抗氧剂,用最佳处方及工艺制备的 TAH 脂质体安全稳定,质量可控。
2.7 形态观察
用透射电镜(TEM)进行形态观察。脂质体样品经适量去离子水稀释后,滴在喷碳铜网上,用 2% 磷钨酸染色,用滤纸转移多余的液体后风干,于透射电子显微镜下观察其形态,并拍摄照片,结果见图6。由图6 可见所制备的脂质体样品多为圆形或类圆形,粒径大约在 70 nm 左右。

Fig.6 The transmission electron microscope (TEM) image of liposomes图6 脂质体透射电镜图
2.8 脂质体的粒径和 Zeta 电位测定
将最优处方及工艺制备的脂质体经适当稀释,测定平均粒径和 Zeta 电位,见图7 和 8。测得供试品的平均粒径为 78.24 nm 左右,PDI 为 0.240,平均 Zeta 电位为 -0.150 mV,接近电中性。
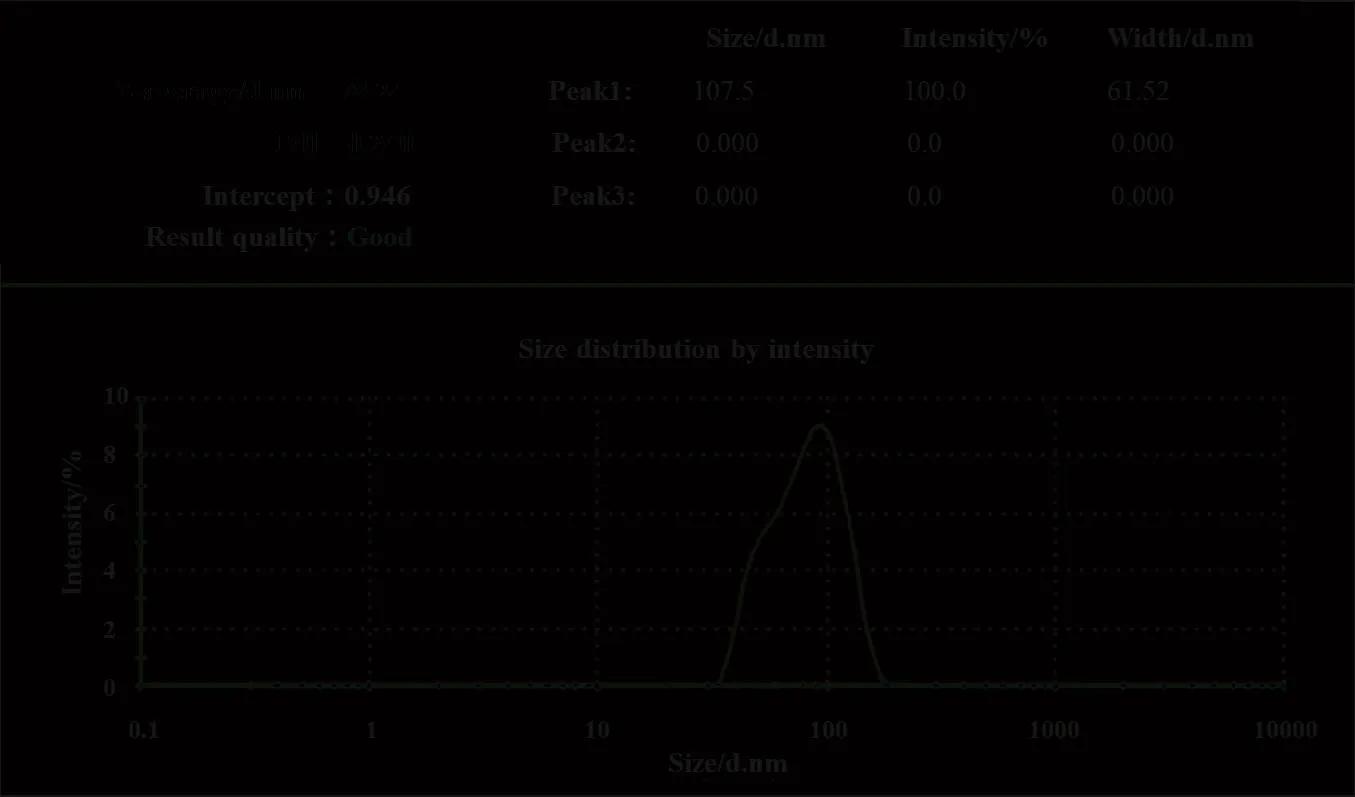
Fig.7 The size distribution of TAH liposomes图7 TAH 脂质体的粒径分布
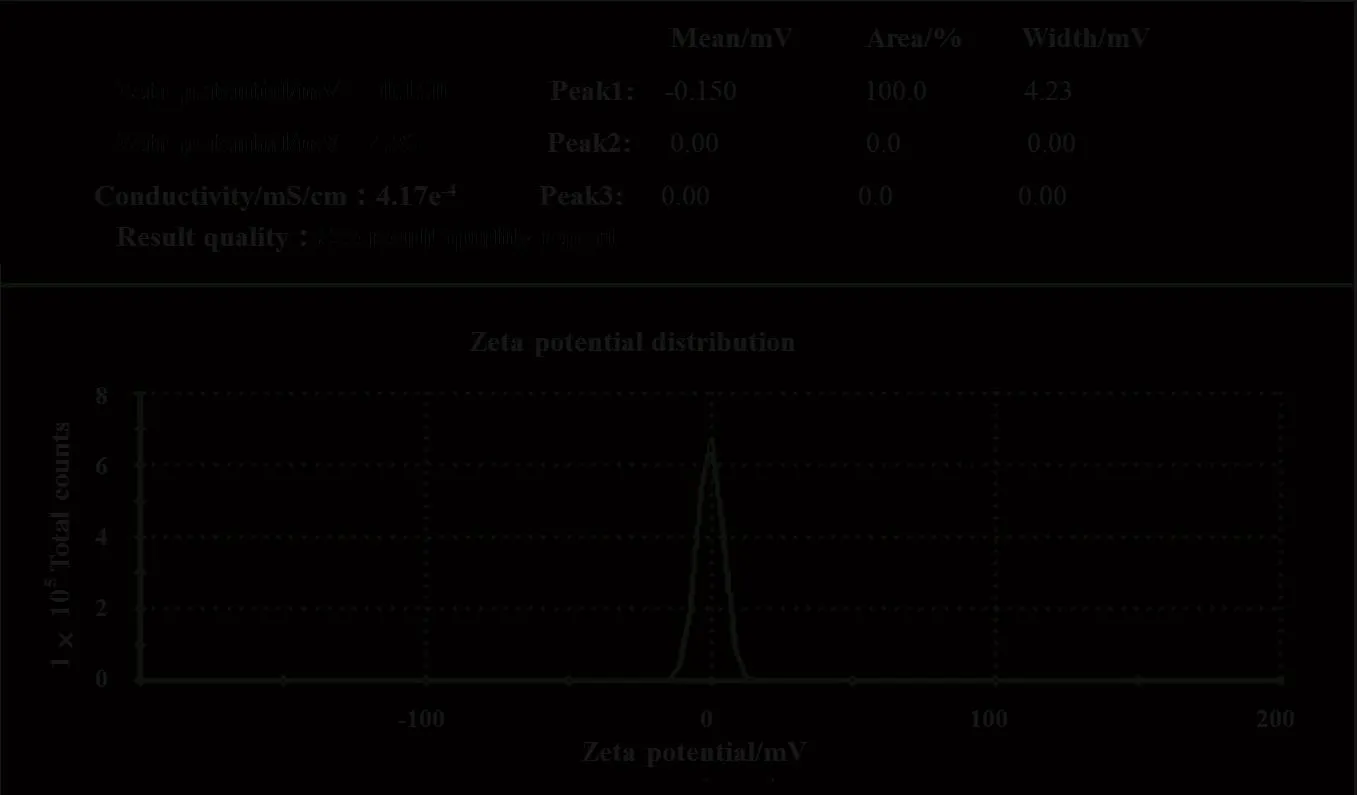
Fig.8 The Zeta potential of TAH liposomes图8 TAH 脂质体的 Zeta 电位
2.9 体外释放试验
按照释放度测定方法篮法(通则 0931 第一法)进行体外释放的测定。剪取 6 份同样长度(约6 cm)的透析袋,用注射用水将里外均清洗干净,用鱼线捆绑一端,复溶后的冻干成品混悬液 4 mL,置于透析袋中,再用鱼线将另一端扎紧放入装有 1 000 mL 释放介质的溶出杯中,尽量保证有效释放的透析袋长度一致,将透析袋置于转篮中,本文模拟体内环境,(37 ± 0.5)℃、100 r·min-1,由于 TAH 为脂溶性药物,因此添加吐温 80 增溶,提供了漏槽条件,释放介质为 0.5% Tween-80水溶液。在转篮接触液面的一刻开始计时,于 0、0.5、1、2、4、6、8、10、12、24 h 取样 10 mL释放介质,同时补充 10 mL 新鲜释放介质,取出的释放介质经 0.45μm 有机微孔滤膜过滤,弃去 5 mL 初滤液,取续滤液 1 mL 于液相小瓶中,进行液相检测,计算累积释放量,绘制体外释放曲线,结果见图9。结果表明,TAH 脂质体有一定的缓释效果,释放速率显著低于对照组。脂质体累积 24 h 释放药物量为 48% 左右,可能部分药物包裹在脂质体中未被释放出来,进一步说明了脂质体具有一定的缓释性和稳定性,在溶出介质中具有一定的稳定性。
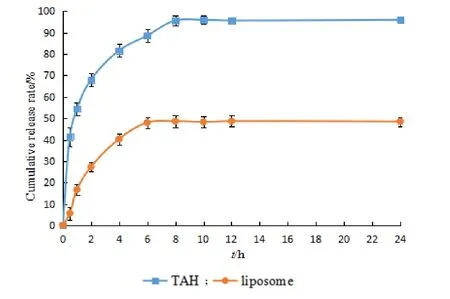
Fig.9 In vitro release of TAH and TAH liposomes (n = 3)图9 TAH 及其脂质体的体外释放
3 讨论
a.本文考察了乙醇注入法和薄膜分散法两种脂质体的制备方法。乙醇注入法是将脂质和药物溶解在少量的乙醇中,再注入水化介质,并挥去乙醇。在此过程中,脂质和药物遇水溶解度降低从而析出,脂质自发形成亲水端朝向水相的脂质双层膜形成脂质体囊泡,而药物由于其疏水性而进入双层膜中间的疏水层,药物析出晶体的几率较大。因此,乙醇注入法对于很多脂溶性药物包封率较低,在制备过程中容易析出晶体,且在制备脂质体时,有机溶剂比较难去除,要求制备温度高,耗时长,与此同时对药物及脂质的稳定性有很大影响。而薄膜分散法是在水化之前,将药物以分子状态均匀分散在脂质体膜中,不以晶体状态析出。加入水化介质振摇时,在机械力和水化力的作用下将脂质膜水化下来,药物保留在脂质中,脂质直接成为双分子囊泡,对脂溶性药物来说有利于得到较高的包封率。本文采用薄膜分散法制得的脂质体,外观均匀,为伴有淡蓝色乳光的混悬液。
b.胆固醇属于两亲性物质,对脂质体膜流动性起调节作用。在相变温度以上时,它能抑制脂质分子的旋转异构,降低膜的流动性;在相变温度以下时,它又能增加脂质双分子膜的不对称性,增加膜的流动性[11]。且胆固醇能够提高脂质体双分子层薄膜的有序排列,因而在脂质体的制备过程中,较高的胆固醇含量能够降低膜的流动性,从而可能会降低脂溶性药物对脂质双分子层的插入[12]。TAH 为脂溶性药物,药物大部分嵌入磷脂双分子层膜之间。因此,胆固醇的量对脂质体的包封率影响很大。膜面积越大,药物包封量就越多。没有胆固醇,脂质双层膜硬度差,不够稳定。胆固醇的适当加入,能使脂质体膜的刚性增强,提高稳定性。但当胆固醇量较大时,脂质体膜的刚性过强,容易破裂,药物易渗漏。
c.在工业化生产中,脂质体在放置过程中极易发生氧化,导致脂质体贮存一直是难以解决的问题。一般在制备过程中添加抗氧化剂从而防止氧化。制备脂质体的 PC 主要来源于成本低、来源广的大豆卵磷脂,因为制备脂质体效果好而被广泛应用。但大豆卵磷脂含有大量不饱和脂肪酸,尤其是亚油酸的含量大于 50%,极其容易氧化,从而影响了脂质体的保存及应用。抗氧剂的选择及用量直接影响制剂质量。抗氧剂需具有低毒性、安全性好、用量小、适合静脉给药等特点,分析利弊,进行处方筛选实验,再优化确定最佳抗氧剂及用量。维生素 E、维生素 C、丁羟茴醚、氨基酸等作为抗氧剂被广泛应用在医药技术领域[13-15]。WHO 规定生育酚作为抗氧剂用时的日允许摄取量为 0.15~2.0 mg/kg[16]。FDA《非活性成分指南》中标注注射用维生素E最大使用剂量为0.064%,抗坏血酸的最大使用剂量为 0.2%,赖氨酸的最大使用剂量为 0.22%。药用辅料手册中记载抗坏血酸以 0.001%~0.1% 的浓度用作水性液体药物制剂的抗氧剂[17]。BHA 常用浓度为0.005%~0.02%,其用量为 0.02% 时比 0.01% 的抗氧效果提高 10%,当用量超过 0.02% 时抗氧化效果反而下降。抗氧剂 BHT 的添加量为 0.01%~2%。曾有文献记载 BHT 对菜籽油有一定的抗氧化性,单独使用 BH T的最佳使用浓度为 0.2‰[18]。Riisom 等[19]测定了氨基酸在在红花油乳液体系种的氧吸收率,发现甲硫氨酸、苏氨酸、赖氨酸和组氨酸均体现出较强的抗氧化活性。且在南京绿叶制药有限公司的发明专利“一种注射用紫杉醇脂质体组合物的冻干工艺”中用到了赖氨酸[20]。因此,本文选用合适剂量,即 0.02% 的 VE、VC、BHA、BHT 及赖氨酸作为抗氧剂进行考察,确定 BHT 效果最好。对抗氧剂 BHT 用量做进一步考察,确定了 BHT 浓度在0.10%时抗磷脂氧化作用较好。接下来,做两批脂质体(加入抗氧剂及不加入抗氧剂)的高温加速试验,以包封率、粒径、含量及有关物质为评价指标,能快速预测脂质体的稳定性。综合考量,其中含BHT 浓度为 0.10% 的 TAH-Lip 稳定性较好,质量可靠,工艺稳定,提高制剂稳定性,且不影响含量、有关检测结果,适用于工业化生产。
d.TAH 脂质体 Zeta 电位 -0.150 mV,接近电中性。可能因为本文所用的磷脂为中性磷脂,或 TAH 的药物性质导致电位较小。理论上脂质体属于热力学不稳定系统,负电荷越大越稳定,但抗氧剂 BHT 的加入,大大改善磷脂氧化程度,起到增强制剂稳定性的作用。
4 结论
本文作者应用薄膜分散法制备了紫杉醇衍生物(TAH)脂质体,其制备工艺简单,以包封率和粒径为评价指标,对各处方及工艺进行单因素考察,确定最优处方及工艺的质量比为m(药):m(大豆卵磷脂):m(胆固醇)= 1 : 20 : 2,抗氧剂 BHT 质量浓度为1 g·L-1,成膜温度为 40 ℃,水化温度为 40 ℃,水化时间为 30 min,均质次数为 10 次,均质压力为 800 bar。按照上述条件制备的脂质体包封率和载药量较好,粒径较小且分布均匀。
