芸苔素内酯·吲哚乙酸·赤霉酸在不同氮浓度下对小白菜产量和品质的影响
2021-07-30王庆彬彭春娥孟慧王洪凤王晓琪贾春花李泽丽李洋耿全政刘之广张民
王庆彬,彭春娥,孟慧,王洪凤,王晓琪,贾春花,李泽丽,李洋,耿全政,刘之广*,张民*
(1.土肥资源高效利用国家工程实验室,山东农业大学资源与环境学院,山东 泰安 271018;2.山东蓬勃生物科技有限公司,山东 泰安 271018;3.作物生物学国家重点实验室,山东农业大学生命科学学院,山东 泰安 271018)
我国是世界上最大的蔬菜生产国和消费国,国家统计局数据显示,2017 年我国蔬菜播种面积为1 953.33 万hm2,总产量约为7.89 亿t。白菜起源于中国,是我国栽培面积和生产供应数量最大的蔬菜作物,在我国周年生产、供应和稳定蔬菜市场等方面发挥重要作用,作为叶菜,其生产过程中需要投入大量的氮肥[1]。在小白菜生产中氮素发挥关键作用,适当提高供氮浓度可提高小白菜产量[2]和可溶性蛋白的含量,但是供氮浓度过高则会造成小白菜减产,品质下降[3-6],抗病性减弱,同时还会造成土壤酸化和板结、水体富营养化、温室效应等一系列环境问题[7]。提高氮肥利用率,进而提升作物产量和品质,是我国蔬菜产业健康发展过程中亟需解决的问题。
碧护(BHG)是复合型的植物源生长免疫诱导剂,主要成分为0.136%的芸苔素内酯·吲哚乙酸·赤霉酸,含有黄酮类催化平衡成分、氨基酸化合物、抗逆诱导剂等多种植物活性物质[8]。在提高作物氮肥利用率方面具有显著效果,可提高水稻、苹果、小麦、花生等作物产量和品质[9-14]。芸苔素内酯(BR)可通过与受体BAK1 的结合激活BR 信号转导路径中BSK3 激酶,调节作物根系生长[15];可通过BZR1信号激发作物体内自噬相关基因(ATGs)的转录和自噬体的形成,增强叶绿素含量,减少泛素化蛋白的积累,进而提高植物获取氮营养能力[16]。外源BR 显著影响作物内源激素吲哚乙酸(IAA)、赤霉素(GA)、脱落酸(ABA)相关基因MdBAK1、MdBRI1、MdBZR1等的表达和转录,显著提高关键生长素合成和转运基因,促进根和茎内生长素含量,降低ABA 和GA3含量,影响侧根发育[17-20]。Zhang 等[21]研究指出外源IAA、GA 对玉米的内源激素合成路径同样有显著影响。Haruta 等[22]报道指出激素途径的变化显著影响植物体内有机酸的分泌。而有机酸一方面显著影响作物的外观品质和食味品质[23],另一方面通过改善植物生长环境,促进植物对矿质养分的吸收利用,提高植物对养分的利用效率,且能在用肥量过大时缓解肥害[24]。
激素信号反馈控制氮素调控、代谢的分子网络路径,而激素的合成、耦合、降解、转运和信号转导又受外源氮素的调控,这是由于氮素除了作为营养物质外,还作为植物生长发育调控通路的重要触发因子与激素路径交叉互作[25]。但是氮素用量和BHG 耦合对蔬菜作物产量、品质的影响及作用机理研究鲜有报道,本研究以水培为培养条件,小白菜为研究对象,探讨其产量、品质与不同外源氮水平条件下BHG 的响应关系,为实现氮肥的减肥增效和小白菜的高产高质提供依据。
1 材料与方法
1.1 试验材料和培养方法
试验于2019年5月2日—2019年6月3日在山东农业大学土肥资源高效利用国家工程实验室人工智能光照培养箱(GXZ,宁波江南)中进行培养。供试小白菜(Brassica chinensisL.)品种“速生绿秀”。BHG 由上海拜诺国际生物科技进出口公司提供。
小白菜培养:小白菜种子在纯净水中浸泡12 h,70%乙醇灭菌1 min,在无菌蒸馏水中洗涤3 次。2%的次氯酸钠浸泡5 min,在无菌蒸馏水中漂洗5 次,播种于128格海绵块育苗盘。参数设置如下:日/夜温度25 ℃/20 ℃,光强380 μmol·m−2·s−1,由日光灯提供,光照周期为12 h,日/夜湿度60%/40%。小白菜幼苗在两叶一心期移栽到水培培养箱中,水培营养液内含有2 mmol·L-1KH2PO4,4 mmol·L-1CaCl2,1.4 mmol·L-1MgSO4·7H2O,2 mmol·L-1K2SO4,0.4 μmol·L-1CuSO4·5H2O,0.1 μmol·L-1NaMoO4·2H2O,8 μmol·L-1H3BO3,10 μmol·L-1MnCl2,1 μmol·L-1ZnSO4·7H2O,18.3 μmol·L-1FeSO4·7H2O,5 μmol·L-1Na2EDTA,pH 调整为6.2。氮源为甘氨酸和硝酸铵混合液(摩尔比为1∶1),根据设计的氮水平添加相应氮源剂量[26]。通气泵无间隔通气,第10 d和第20 d分别调节pH为6.2,处理时间为30 d。
1.2 试验设计
培养液设计1、3、10 mmol·L-13个氮浓度,在每个氮浓度培养液中分别添加去离子水和BHG(5 μg·L-1),共6个处理(表1),6次重复。
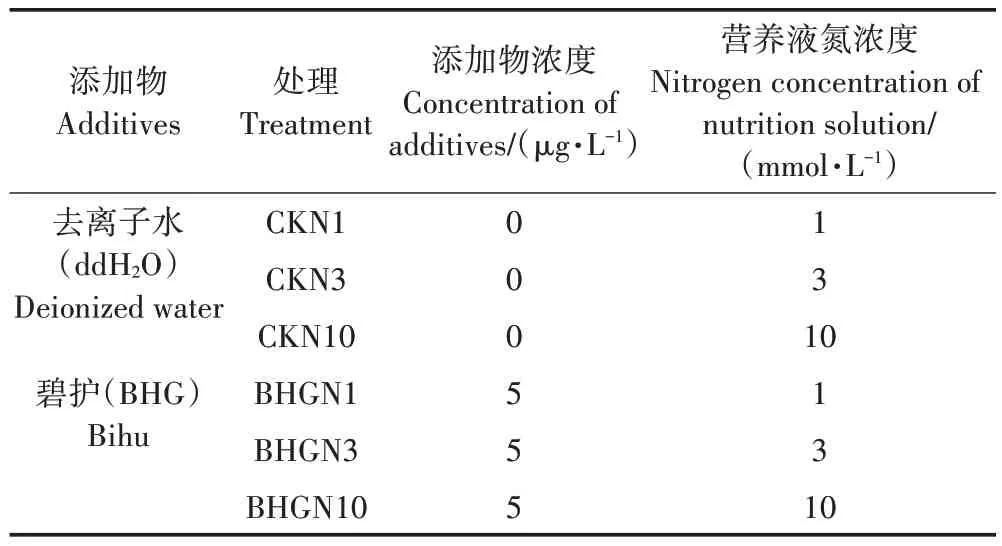
表1 试验处理Table 1 Treatments for experiment
1.3 测定项目和方法
1.3.1 小白菜长势指标
小白菜移栽30 d 后,统计叶片数量,地上部及根鲜质量、长度分别由电子天平和直尺测得,计算根冠比;鲜样在烘箱内105 ℃杀青30 min,85 ℃烘干至恒质量,称量干质量。
1.3.2 叶片可溶性蛋白和可溶性糖
小白菜收获后,硫酸-蒽酮比色法测定可溶性糖含量,考马斯亮蓝法测定可溶性蛋白含量[27]。
1.3.3 小白菜氮磷钾含量
干样磨碎过0.25 mm 筛,称取0.20 g,H2O2-H2SO4消煮,测定氮、磷、钾含量,氮含量根据凯氏定氮法测定,磷含量根据钼锑抗比色法测定,钾含量根据火焰光度计法[28]测定。
1.3.4 有机酸
高效液相色谱法检测叶片、根部及营养液中草酸的含量。液氮研磨处理后,称取0.20 g 样品,4 mL 超纯水悬起,超声15 min,4 ℃下15 000g离心20 min;用0.22 μm 滤膜抽滤上清液用于上样。流动相A:10 mmol·L-1磷酸氢二铵,pH 2.45(用磷酸调节),流动相B:甲醇,分析柱:Inertsil ODS-3(150 mm×4.6 mm,5 μm),柱温为30 ℃,检测波长为210 nm。流速0.4 mL·min-1,洗脱程序如下:0~5 min,甲醇比例由3%线性增加至8%;5~15 min,甲醇比例由8%线性降至3%。有机酸标准品购自美国Sigma公司。
1.3.5 叶片激素
高效液相色谱法测定内源激素的含量,称取0.20 g 叶片,加入2 mL pH 7.2 的磷酸缓冲盐(Phos⁃phate buffer saline,PBS,pH7.2)溶液,冰浴研磨,4 ℃下15 000g离心10 min,取上清。流动相为甲醇∶乙腈∶0.6%乙酸=50∶45∶5(V/V),分析柱为Symmetry C18(150 mm×4.6 mm,5 μm),柱温25 ℃,流动相流速0.6 mL·min-1,检测波长为264 nm。GA、IAA、ABA、玉米素(ZT)、水杨酸(SA)标准品均购自美国Sigma 公司[29]。
1.4 数据处理
采用Excel 2007 软件对数据进行整理,采用SAS V8 数据处理系统进行方差分析,采用Duncan 新复极差法进行差异显著性检验(α=0.05)。采用Origin 8.0绘制图表。
2 结果与分析
2.1 不同氮浓度下BHG对小白菜产量及品质的影响
2.1.1 氮水平和BHG互作对小白菜产量的影响
氮浓度对小白菜产量和干质量均影响显著(表2),不添加BHG 处理随着氮浓度的升高,小白菜产量和干质量呈现增加趋势。CKN1 比CKN3 处理减产33.86%。CKN10比CKN3增产13.65%。BHGN3较CKN3 增产14.87%,与CKN10 产量相当;BHGN1 与CKN1产量无显著差异,BHGN10 较CKN10减产7.69%,但差异不显著。BHGN3 较CKN3 总干质量增加5.32%,BHGN1和BHGN10较相同氮水平清水处理总干质量显著降低9.02%和16.91%。
2.1.2 氮水平和BHG互作对小白菜品质的影响
由图1 可知,随着氮浓度的提高,CK 处理叶片中可溶性糖含量逐渐降低,有机酸含量逐渐升高,糖酸比逐渐降低,可溶性蛋白先降低后升高。BHG 处理可溶性糖先降低后升高,有机酸含量逐渐升高,糖酸比先降低后保持稳定,可溶性蛋白先升高后降低,与CK 处理的变化趋势不同。BHGN3较CKN3小白菜中可溶性糖的含量显著降低0.26个百分点,有机酸含量显著提高91.28%,糖酸比降低75.46%,可溶性蛋白含量显著升高0.05个百分点;BHGN1较CKN1有机酸和可溶性蛋白分别显著降低85.14%和0.04 个百分点,糖酸比显著升高637.86%;BHGN10 较CKN10 小白菜中可溶性糖、有机酸含量分别显著升高0.09个百分点和12.97%,可溶性蛋白显著降低0.07个百分点。
对小白菜根部和营养液中有机酸检测结果如图2 所示,小白菜根部和培养液内有机酸的含量随着氮浓度升高均明显升高,水培条件下,成熟小白菜内有机酸主要为草酸,而酒石酸、苹果酸、柠檬酸、琥珀酸含量极少,未检出(图2C)。BHGN3 较CKN3 根部和营养液内的有机酸显著提高23.89%、149.18%,BHGN10 较CKN10 根部和营养液内的有机酸显著升高36.18%、16.21%。
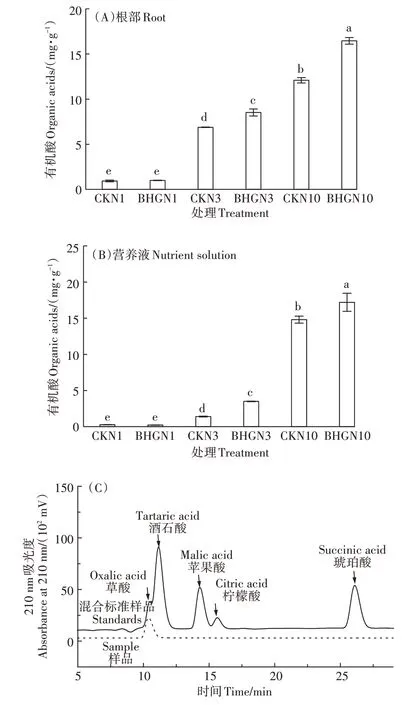
图2 不同处理小白菜根系及营养液内有机酸的含量Figure 2 Organic acids content in pakchoi root and nutrient solution with different treatments
由图3 可知,随着氮浓度的提升,小白菜叶内生长相关激素IAA、GA、ABA、ZT 含量均表现为先升高后降低,而抗病相关激素SA 含量呈现逐渐降低的趋势。BHGN3 处理较CKN3 处理的IAA、ABA、GA、SA显著降低12.55%、44.96%、66.13%、50.65%,ZT 含量显著升高8.79%;BHGN1 处理较CKN1 处理中IAA 和SA 的含量显著下降17.50%、89.45%,GA、ABA、ZT 含量显著升高204.85%、98.11%、68.02%;BHGN10 处理较CKN10处理中IAA、ZT、SA的含量显著升高17.74%、11.62%、23.57%,ABA、GA 的含量显著降低19.40%、38.87%。BHGN1、BHGN3、BHGN10 处理的IAA/ABA 分别为等氮条件下对照处理的41.67%、158.88%、146.08%,ZT/ABA 比值分别为等氮条件下对照处理的84.81%、197.66%、138.50%。
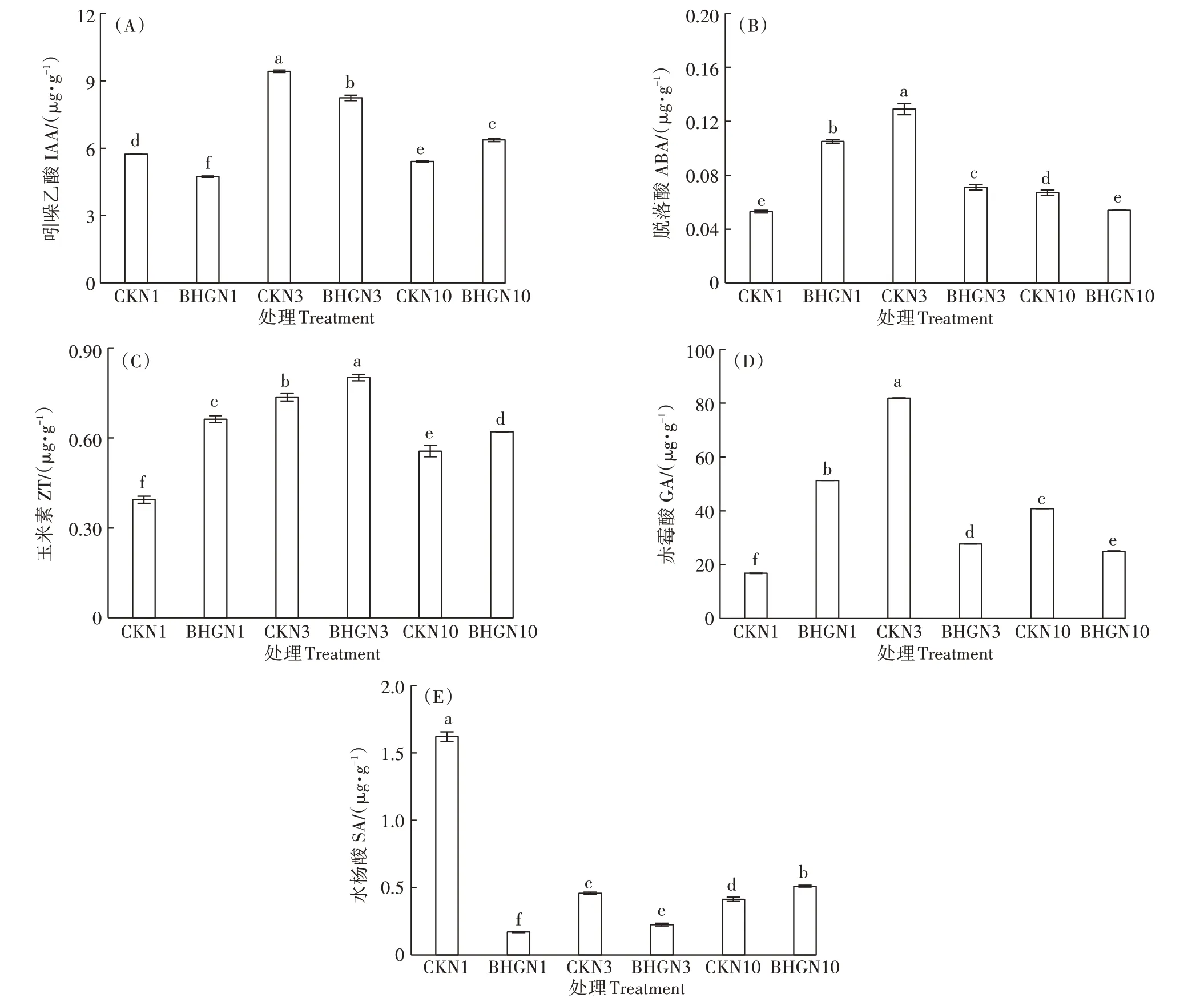
图3 不同处理小白菜激素的含量Figure 3 Hormone content in pakchoi with different treatments
2.2 氮水平和BHG互作对小白菜表型的影响
CKN3 处理较CKN1 处理小白菜株高显著增高(表3),CKN10 处理与CKN3 处理间,株高无显著差异;随着氮浓度提高,小白菜根冠比显著减小,根长显著变短。BHGN3处理较CKN3处理根鲜质量、根干质量显著增加22.95%、25.00%;BHGN1 处理较CKN1 处理的根长、根鲜质量、根干质量显著下降12.50%、15.16%、21.21%;BHGN10 处理较CKN10 处理叶片数量显著增加9.80%,根长显著增加20.84%。

表3 不同处理下小白菜表型指标Table 3 Phenotypic characteristics of pakchoi with different treatments
2.3 氮水平和BHG 互作对小白菜养分吸收和利用的影响
随着氮浓度的升高,CK 处理小白菜叶片和根部中氮、磷、钾总含量先升高后保持稳定,添加BHG 后叶片中氮、磷、钾总含量先升高后下降,根部变化趋势与CK 处理一致(图4A、图4B);BHG 的添加显著促进了3 mmol·L-1氮水平下小白菜氮、磷、钾总量的积累,显著降低了10 mmol·L-1氮水平下氮、磷、钾总量的积累。小白菜中氮的含量随着供氮水平的升高显著升高(图4C),各处理磷的含量无显著差异(图4D),钾的含量随着供氮水平的升高先升高后降低(图4E);添加BHG的处理中,在3 mmol·L-1氮水平时小白菜钾的含量显著提高了2.64个百分点,但氮的含量显著降低0.37 个百分点,在1 mmol·L-1和10 mmol·L-1氮水平下小白菜钾的含量分别显著降低了0.36、0.70个百分点。
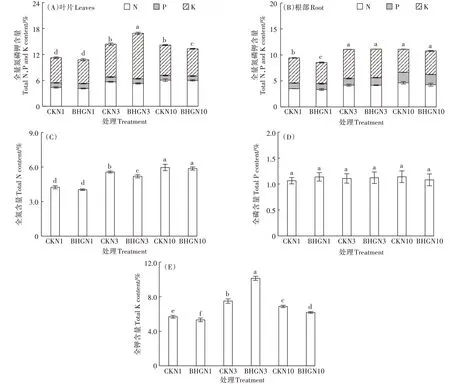
图4 不同处理小白菜氮磷钾的含量Figure 4 NPK contents in pakchoi with different treatments
3 讨论
BHG 的主要成分为0.136%的芸苔素内酯·吲哚乙酸·赤霉酸,这些外源激素的添加显著影响小白菜内源激素的含量。而植物内源激素是植物体内可自身合成的微量有机物,可通过与其他激素的互作在非常低的浓度条件下调控植物生长发育[30]。植物内源激素同样受外源氮素含量波动的影响[31]。在低氮环境下植物通过NRT1.1转运出侧根内IAA 来抑制侧根的伸长,促进主根的发育[32];高氮条件下,植物体内氮素的积累提高了β-糖苷酶1的表达量,降解了储存在根分生区内ABA-糖苷酯,释放出ABA,进而抑制根系的伸长和发育[33];高氮水平下作物还会降低高亲和力蛋白基因NRT1.1、NRT1.2等表达,减少氮源的摄入,同时通过ZT信号反馈途径抑制根系吸收氮,如抑制根系摄取硝酸盐和木质部转运的AtNRs基因表达,上调地上部氮吸收、转运AtNRTs基因表达,增强硝酸盐在茎叶中的分配和转运[34]。植物内其他激素,如GA,可与氮相互协调来调控作物开花周期[35]。本研究中,BHG 在与3 mmol·L-1氮耦合互作下,显著影响了激素间的平衡关系,而这些平衡关系显著影响作物的生长,如ZT/ABA 值的改变会影响植物的生长势[36],IAA/ABA 值的改变会影响作物根体积、根质量[37]。因此,BHGN3的IAA/ABA和ZT/ABA值分别为等氮条件下对照的158.88%和197.66%时,根鲜质量、根干质量显著增加22.95%、25.00%。邹晓霞等[37]发现IAA/ABA、ZR/ABA 与作物根系干质量、总长度、体积和表面积呈显著或极显著正相关,这与本研究的结果相一致。说明BHG 的添加在适宜氮水平下有利于小白菜根系的生长,改变了作物表型。可能原因是BHG 对IPS1、PHT1、1 LPR1b、KRPs、EXPB1-4等根系发育相关基因的表达产生显著影响,进一步影响根部轴向根伸长、侧根密度和长度,调控作物根系形态。
BHG 改变的激素途径对植物内有机酸的分泌影响显著[22],而根系分泌的有机酸具有改善作物品质、增强抗逆性、提高肥料利用率等生物功能[38-41]。戢林等[39]、常二华等[41]研究表明水稻根系分泌的草酸、柠檬酸对稻米食味品质有明显影响。本研究中,BHGN3 处理较CKN3 处理根部和营养液内的有机酸显著提高23.89%、149.18%,显著改变了小白菜品质,小白菜中有机酸含量显著提高91.28%,糖酸比降低75.46%,可溶性蛋白含量显著升高0.05 个百分点。这与贾春花等[8]研究BHG 对樱桃萝卜产量和品质影响得出的BHG 降低樱桃萝卜品质的结论不同,这可能是因为栽培方式和肥料施用水平有差异。陈露等[42]研究表明紫色小白菜内有机酸主要为苹果酸、柠檬酸、丙二酸、琥珀酸和酒石酸,而本试验条件下,供试小白菜分泌积累的有机酸主要是草酸,与其存在差异,可能是由于小白菜品种不同。
BHG 同样可调控激素路径,进而影响作物对营养的吸收利用,如基质培养BR 可通过BZR1 信号激发作物体内自噬体的形成,增强叶绿素含量而减少泛素化蛋白的积累,进而提高植物获取氮营养能力[16]。IAA 可提高大田正常供钾植株的根系Vmax值(根系钾吸收动力学参数)和内流型钾离子通道基因NKT2、NtKC1的表达量,显著增加地上部和地下部干质量6.05%、8.54%[43]。Zhang 等[21]研究指出外源IAA、GA通过影响IPS1、PHT1、1 LPR1b、KRPs、EXPB1-4等根系发育相关基因的表达,调控玉米根系形态,提高大田玉米对磷的吸收和积累。本研究中BHG 的添加,在3 mmol·L-1氮水平时小白菜内钾的含量显著提高了2.64 个百分点,但氮的含量显著降低0.37 个百分点。可能原因是不同培养环境下,不同作物的氮、磷养分吸收状况对BHG 的响应存在差异,而BHG 使植物体内有机酸含量提高,显著促进作物对钾素的吸收利用。BHG 可提高水稻、苹果、小麦、花生等作物产量[9-14],本研究发现BHGN3较CKN3显著增产14.87%,干质量增加5.32%;BHGN1 较CKN1 增产不显著,干质量显著降低9.02%。可能原因是1 mmol·L-1氮水平下,氮素成为限制小白菜产量的主要因子,BHG 内激素过分刺激小白菜引起了小白菜的早衰。10 mmol·L-1高氮条件下,添加BHG 的处理中,小白菜ZT/ABA、IAA/ABA 值 比CKN10 升 高38.50% 和46.08%,根长显著增加20.84%,根系有机酸、体内SA含量显著提高36.18%、23.57%,但产量无显著差异。可能的原因是作物在不同氮水平下启动的氮吸收、转运蛋白的分子网络和激素调控途径不同[44],高氮水平下BHG 激发SA 路径,提高作物抗胁迫能力需要消耗更多营养和能量[22,31]。综上说明作物对BHG 的响应与施氮水平密切相关。
4 结论
(1)BHG 对小白菜产量、品质的影响与施氮水平密切相关,主要机理为调控小白菜内源激素含量。
(2)与对照相比,BHG 在3 mmol·L-1氮水平显著增产,小白菜ZT/ABA、IAA/ABA 值提高97.66%、58.88%,根鲜质量、根干质量提高22.95%、25.00%,根部有机酸含量增加23.89%,植株有机酸含量91.28%,钾含量增加2.64 个百分点,最终产量提高14.87%;BHG 在1、10 mmol·L-1氮水平下对小白菜产量无显著影响。
因此,针对养分状况合理施用BHG 是小白菜优质高产的有效手段。
