孕妇胎儿神经管缺陷易感性与MTHFR基因C667T位点突变、TYMS基因rs3819102位点突变及血清SAP水平的关系*
2021-07-29唐明霞解春宝
唐明霞,解春宝
1.四川省雅安市人民医院检验科,四川雅安 625000;2.四川省医学科学院·四川省人民医院临床医学检验中心,四川成都 610031
神经管缺陷又称神经管畸形,是一种严重的出生缺陷,危害严重,对家庭和社会造成沉重的负担[1]。据统计我国胎儿神经管缺陷发生率约为2.74%,农村较城市高,北方较南方高,秋冬季出生的婴儿较春夏季出生的婴儿高[2]。随着医疗设备更新及医疗技术发展,胎儿神经管缺陷检出率不断上升。因此,筛查胎儿神经管缺陷的高危因素,对指导育龄期女性优生优育具有十分重要的意义。血清淀粉样P物质(SAP)为血清正常糖蛋白,亦为正五聚体蛋白家族中的重要成员,具有调控染色质降解、参与细胞凋亡、参与先天性免疫应答、参与创伤修复等作用[3]。已有研究显示,神经上皮细胞过度凋亡与胎儿神经管缺陷密切相关,而SAP具有调控神经上皮细胞凋亡的作用[4],因此推测SAP与胎儿神经管缺陷可能有所关联。叶酸代谢是妊娠过程中重要的生化反应,涉及DNA合成、DNA甲基化、蛋白质甲基化,如叶酸代谢失衡,可导致体内生化反应的紊乱,诱发胎儿神经管缺陷形成[5]。5,10-亚甲基四氢叶酸还原酶(MTHFR)和胸苷酸合成酶(TYMS)基因合成的蛋白均为叶酸代谢通路上的关键酶,都能影响叶酸代谢[6]。有文献报道,MTHFR基因C667T位点突变、TYMS基因rs3819102位点突变均可导致叶酸代谢紊乱[7],因此推测胎儿神经管缺陷易感性与MTHFR基因C667T位点及TYMS基因rs3819102位点突变可能有所关联。因此,本文探讨了孕妇胎儿神经管缺陷易感性与MTHFR基因C667T位点突变、TYMS基因rs3819102位点突变及血清SAP水平的关联性,希望为临床筛查神经管缺陷高危人群提供理论基础,现将研究结果报道如下。
1 资料与方法
1.1一般资料 选择2017年12月至2019年12月在四川省雅安市人民医院(下称本院)产检的159例胎儿神经管缺陷的孕妇作为观察组,159例胎儿健康的孕妇作为对照组。观察组:年龄20~38岁,平均(27.85±3.65)岁;平均体质量指数(28.50±2.36)kg/m2;孕周8~16周,平均(12.35±2.43)周;孕次1~4次,平均(2.57±0.72)次;产次0~3次,平均(1.23±0.38)次。对照组:年龄20~38岁,平均(28.11±3.12)岁;平均体质量指数(28.44±2.25)kg/m2;孕周8~16周,平均(12.47±2.32)周;孕次1~4次,平均(2.66±0.83)次;产次0~3次,平均(1.30±0.41)次。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。纳入标准:(1)观察组孕妇胎儿神经管缺陷经超声检查确诊;(2)依从性好,能够配合完成本研究内容;(3)无精神系统疾病;(4)心、肝、肾、肺、脑等重要脏器功能正常;(5)两组受试者及其家属对本研究充分知情并签署知情同意书。排除标准:(1)合并妊娠期并发症、传染性疾病、凝血系统疾病、恶性肿瘤、感染性疾病、自身免疫性疾病、甲状腺功能异常、内分泌疾病、心脑血管疾病、代谢性疾病;(2)双胎或多胎妊娠;(3)非自然妊娠;(4)入院资料不全;(5)有早产、死产等不良妊娠史;(6)生殖器官异常;(7)宫颈功能不全。排除标准:(1)中转至上级医院;(2)孕妇和(或)胎儿意外死亡。本研究经本院医学伦理委员会批准同意。
1.2方法 两组受试者入院后,记录其年龄、体质量指数、饮酒史、民族、吸烟史、文化程度、孕周、孕次、产次、等一般资料,采集次日清晨肘静脉血2 mL,采用SpectrafugeTM6C血液离心机(北京兰博康斯科技有限公司),3 000 r/min离心15 min,分离血清,于-80 ℃条件下保存,采用酶联免疫吸附试验法(ELISA)检测血清SAP水平,仪器为上海昆士兰生物科技发展有限公司提供的TECAN M1000多功能酶标仪,试剂为上海晶抗生物工程有限公司提供的SAP检测试剂盒。另采集次日清晨肘静脉血4 mL于乙二胺四乙酸(EDTA)抗凝管(上海圻明生物科技有限公司)中,采用聚合酶链式反应-限制性片段长度多态性(PCR-RLFP)法对MTHFR基因C667T位点、TYMS基因rs3819102位点多态性进行检测,其具体操作如下:采用血液基因组DNA提取试剂盒(广州吉赛生物科技股份有限公司)提取DNA,采用NanoUV-3000紫外分光光度计(东莞市谱标实验器材科技有限公司)对DNA定量,以DNA为模板,参照引物序列见表1,进行PCR扩增。PCR反应体系:10×缓冲液2.5 μL,MTHFR C667T位点上下游引物各1 μL,TYMS rs3819102位点上下游引物各1 μL,10 mmol/L dNTPs 1 μL,DNA 1 μL,ddH2O 16.5 μL,总反应体系25 μL;PCR反应条件为:94 ℃预变性30 s,94 ℃变性5 s,52 ℃退火5 s,80 ℃延伸5 s,循环45次。PCR扩增结束后,取3 μL PCR扩增产物,用ExoI、FastAP纯化,进行延伸反应,取1 μL延伸引物加至10 μL HiDi DNA Polymerase(深圳欣博盛生物科技有限公司)中,95 ℃变性3 min,立即冰水浴,采用3500XL测序仪(北京埃克森科技有限公司)进行测序,应用Typer4.0软件(深圳华因康基因科技有限公司)进行分析,获得目标基因MTHFR、TYMS的基因型检测结果。

表1 引物序列
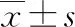
2 结 果
2.1两组血清SAP水平 观察组血清SAP水平为(31.19±0.45)mg/U明显低于对照组的(42.05±0.69)mg/U,差异有统计学意义(t=32.154,P<0.001),见图1。
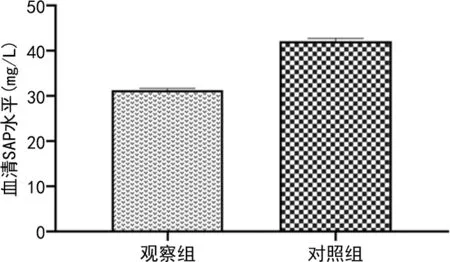
图1 两组血清SAP水平比较
2.2两组MTHFR基因C667T位点的基因型和等位基因分布频率 观察组MTHFR基因C667T位点的CC、CT、TT基因型频率与对照组比较,差异有统计学意义(P<0.05);观察组MTHFR基因C667T位点的T、C等位基因频率与对照组比较,差异有统计学意义(P<0.05),见表2。

表2 两组MTHFR基因C667T位点的基因型和等位基因分布频率[n(%)]
2.3两组TYMS基因rs3819102位点的基因型和等位基因分布频率 观察组TYMS基因rs3819102位点的AA、GG、AG基因型频率较对照组差异有统计学意义(P<0.05);观察组TYMS基因rs3819102位点的A、G等位基因频率较对照组差异有统计学意义(P<0.05),见表3。

表3 两组TYMS基因rs3819102位点的基因型和等位基因分布频率[n(%)]
2.4MTHFR基因C667T位点突变、TYMS基因rs3819102位点突变及血清SAP水平与孕妇胎儿神经管缺陷的Spearman相关性分析 血清SAP水平与孕妇胎儿神经管缺陷呈负相关关系(r=-0.647,P<0.05);MTHFR基因C667T位点TT基因型频率及T等位基因频率与孕妇胎儿神经管缺陷呈正相关关系(r=0.205,P<0.05);MTHFR基因C667T位点CC基因型频率、CT基因型频率及C等位基因频率与孕妇胎儿神经管缺陷无相关性(r=0.050,P>0.05);TYMS基因rs3819102位点的GG基因型频率及G等位基因频率与孕妇胎儿神经管缺陷呈正相关关系(r=0.204,P<0.05);TYMS基因rs3819102位点AA基因型频率、AG基因型频率及A等位基因频率与孕妇胎儿神经管缺陷无相关性(r=-0.083,P>0.05)。
2.5孕妇胎儿神经管缺陷危险因素的Logistic回归分析 血清SAP低水平、MTHFR基因C667T位点T等位基因突变、TYMS基因rs3819102位点G等位基因突变是孕妇胎儿神经管缺陷的危险因素(P<0.05),见表4、5。
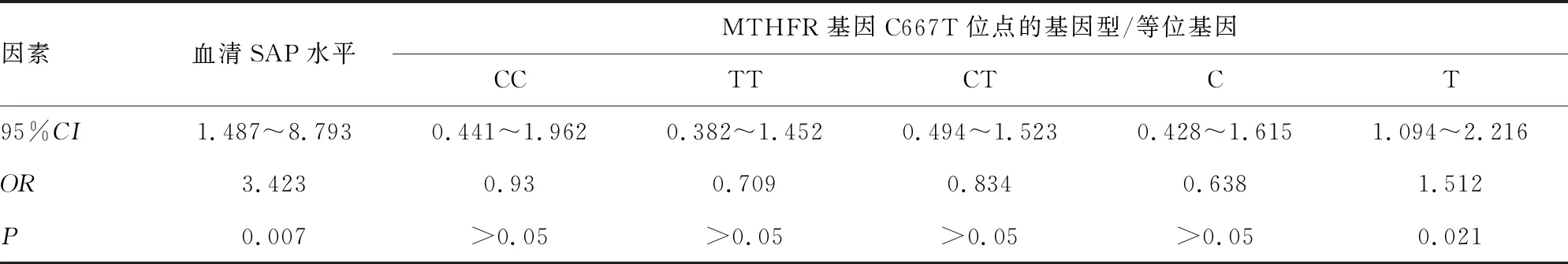
表4 孕妇胎儿神经管缺陷时血清SAP水平及MTHER基因的对比
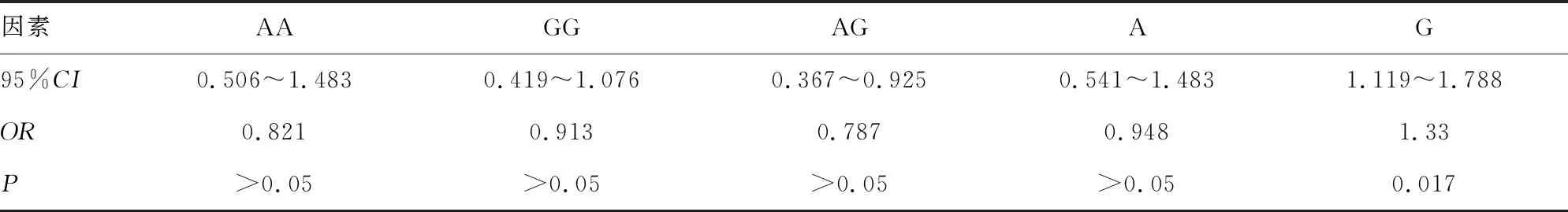
表5 孕妇胎儿神经管缺陷时TYMS基因的对比
3 讨 论
神经管是胎儿的中枢神经系统,神经系统在胚胎形成15~17 d开始发育,至胚胎形成22 d左右,神经褶两侧互相靠拢而形成1个管道,称为神经管,其尾端称为神经管后孔,其前端称为神经管前孔,在胚胎形成24~26 d时,前孔及后孔相继关闭。神经管缺陷是一种严重的神经系统先天性畸形的疾病,病因涉及遗传易感性、基因突变(如转录因子类基因、生长因子及其受体基因、同型半胱氨酸代谢相关基因、蛋白激酶C相关基因、细胞连接类基因、细胞骨架类基因等)、妊娠早期人绒毛膜促性腺激素(HCG)合成减少、维生素B12缺乏、叶酸缺乏、妊娠早期用药不当、妊娠早期长期高热(>38.5 ℃)、妊娠合并糖尿病酮症酸中毒、妊娠早期剧烈呕吐等。胎儿神经管缺陷主要表现为唇裂、腭裂、无脑儿、脑脊髓膜膨出、脑膨出、脊柱裂/隐性脊柱裂等,危害甚重。目前临床多采用彩色多普勒超声、核磁共振技术等对胎儿神经管缺陷进行筛查和诊断,但存在漏诊、误诊等不足,局限性明显。因此,如何更有效地评估胎儿神经管缺陷的发生风险,仍需进一步探讨。
SAP为血清正常糖蛋白,能够调控染色质降解,还能与凋亡细胞结合参与细胞凋亡进程。有序的细胞凋亡对胚胎正常发育过程具有调节作用,如神经管背腹构型,但细胞凋亡极易受到各种因素干扰,引起胚胎发育异常而导致缺陷或畸形的发生。既往研究显示,神经上皮细胞过度凋亡与胎儿神经管缺陷密切相关[8],因此推测SAP在胎儿神经管缺陷的孕妇外周血中水平下降可能源于细胞过度凋亡。有研究报道[9],SAP在细胞凋亡后可与核抗原结合而发挥清除致病性细胞碎片的作用,当胎儿发生神经管缺陷时,细胞大量凋亡,细胞碎片增加,大量SAP与这些细胞碎片结合,导致外周血中SAP水平降低。SAP亦为正五聚体蛋白家族中的重要成员,是体内的急性时相蛋白,能够参与先天性免疫应答和创伤修复。有研究发现,在慢性中枢神经系统退行性疾病中,补体C4d、C3d激活少突神经胶质细胞,而受损脑组织中的SAP水平与包覆少突神经胶质细胞的C4d、C3d补体水平相平行[10],因此推测SAP参与补体激活途径。另有研究发现,SAP在先天性心脏病房室间隔缺损患者外周血中呈低表达,其表达水平与先天性心脏病房室间隔缺损患者免疫功能呈正相关关系,且SAP表达下调可提示肺部疾病易感性增加[11]。固有免疫在胚胎正常发育过程中发挥着十分重要的作用,有研究推测SAP可能与固有免疫系统共同参与了胎儿神经管缺陷形成[12]。本研究显示,观察组血清SAP水平明显低于对照组,血清SAP低水平是胎儿神经管缺陷的危险因素,这与既往研究一致[13],提示SAP在胎儿神经管缺陷的孕妇外周血中呈低表达,SAP在胎儿神经管缺陷形成过程中发挥着一定作用,SAP有望成为无创产前诊断胎儿神经管缺陷的血清生物标志物。叶酸是一类亲水性的小分子,也称维生素B9,由蝶啶、对氨基苯甲酸、谷氨酸构成,以8种辅酶形式存在于人体中,人体自身不能合成叶酸,需要外源性摄入,如从绿色蔬菜、柑橘类水果、动物内脏、马铃薯等食物中摄取,吸收后的叶酸存于肠壁、骨髓、肝脏等组织中,被叶酸还原酶还原为具有广泛生理活性的四氢叶酸(THFA),从而参与嘌呤、嘧啶合成,因此叶酸具有促进细胞分裂、蛋白质合成、正常红细胞形成等作用,体内叶酸缺乏时可致细胞成熟受阻、红细胞中血红蛋白合成减少[14]。叶酸代谢是妊娠过程中重要的生化反应,涉及DNA合成、DNA甲基化、蛋白质甲基化,如叶酸代谢失衡,可导致体内生化反应的紊乱,诱发胎儿神经管缺陷形成。MTHFR、TYMS基因合成的蛋白均为叶酸代谢通路上的关键酶,都能影响叶酸代谢。MTHFR是细胞内甲基化反应过程中的限速酶,TYMS是催化脱氧胸腺嘧啶核苷酸(dTMP)合成的唯一产物,若二者基因突变,均可造成叶酸代谢紊乱。有研究指出,TYMS基因rs3819102位点突变可影响脱氧尿嘧啶核苷酸(dUMP)向dTMP转化而增加胎儿出现神经管畸形的可能性,因此TYMS基因rs3819102位点突变与胎儿神经管缺陷关系密切[15]。有报道指出,MTHFR基因C667T位点突变可导致叶酸代谢紊乱,增加胎儿神经管缺陷发生风险[16]。本研究对MTHFR基因C667T位点、TYMS基因rs3819102位点多态性进行了较为详细的分析,发现观察组MTHFR基因C667T位点的TT基因型频率及T等位基因频率明显高于对照组,观察组TYMS基因rs3819102位点的GG基因型频率及G等位基因频率明显高于对照组,由此猜测孕妇MTHFR基因C667T位点的TT基因型频率及T等位基因频率增加,TYMS基因rs3819102位点的GG基因型频率及G等位基因频率增加,提示其胎儿可能具有神经管缺陷的风险。本研究Logistic回归分析显示,MTHFR基因C667T位点T等位基因突变、TYMS基因rs3819102位点G等位基因突变是孕妇胎儿神经管缺陷的危险因素,提示MTHFR基因C667T位点T等位基因突变及TYMS基因rs3819102位点G等位基因突变可能增加孕妇胎儿神经管缺陷易感性。该结论有助于阐明孕妇胎儿神经管缺陷的分子遗传学机制,为基因水平上预测个体发病风险提供新的方向,临床医师应针对上述因素加强防控,积极做好筛查工作,以降低孕妇胎儿神经管缺陷发生风险。
综上所述,血清SAP低水平、MTHFR基因C667T位点T等位基因突变、TYMS基因rs3819102位点G等位基因突变可能增加孕妇胎儿神经管缺陷易感性。但除了临床研究较为广泛的MTHFR基因C667T位点、TYMS基因rs3819102位点外,是否还存在其他多态性位点协同影响胎儿神经管缺陷发生,仍需进一步研究。
