谷氨酸脱羧酶在枯草芽孢杆菌中的表达及应用
2021-07-29邱玲,陈晟,吴敬,黄燕
邱 玲, 陈 晟, 吴 敬, 黄 燕
(食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122)
γ-氨基丁酸(GABA)是一种四碳非蛋白质氨基酸,是由谷氨酸脱羧酶(glutamate decarboxylase,GAD)不可逆、专一地将L-谷氨酸的α-羧基脱去一分子CO2得到,是高度溶于水的两性离子,pK值为4.03和10.56[1],因此表现出与该类氨基酸类似的生理活性,即作为一种抑制性神经递质存在于哺乳动物的中枢神经系统中[2-3]。目前广泛应用于工业、动物饲料、医药和食品行业[4-5]。
大量研究表明,GABA有促进睡眠、增强记忆力、抗焦虑、预防和治疗癫痫、延缓脑衰老、舒缓血管、调节激素分泌、提高受精率、解除氨毒、增强肝功能等作用[6-11]。
目前制备GABA的方法主要有植物富集法、化学合成法[12-13]、微生物发酵法[14-15]、酶催化法[16]。 植物富集法生产GABA虽然安全环保,但GABA浓度低,尚无法用作药物、食品添加剂;化学合成法生产GABA安全性较差、有化学残留,也不易达到医药及食品行业的标准;微生物发酵法得到的GABA是一个多相复杂体系,浓度低,下游产物分离成本高,是生产高纯度、高浓度GABA的一个瓶颈问题。所以,目前制备GABA多采用酶催化法,主要是利用微生物细胞内分离得到的谷氨酸脱羧酶或能够生产谷氨酸脱羧酶的微生物细胞专一、不可逆地脱去L-谷氨酸的α-羧基,从而得到高浓度、高纯度的GABA。此方法的优点是反应条件温和、不需要昂贵的原料、能耗低,并且微生物来源的谷氨酸脱羧酶和能够生产谷氨酸脱羧酶的微生物细胞可通过简单的细胞培养大量获取[17]。
目前大多研究以大肠杆菌为宿主表达GAD,催化生产GABA。在重组菌发酵过程中添加一定浓度的辅酶磷酸吡哆醛(PLP)能够促进GAD的折叠,从而提高GAD酶活力[18-19]。除此之外,酶催化法即利用GAD将谷氨酸脱去一分子CO2制备GABA过程中,在酶转化体系中添加一定量的PLP可以促进酶液或全细胞的转化[17]。有研究者[16]报道了在大肠杆菌发酵过程中直接添加0.02 mmol/L PLP后,GABA产量是对照的2.0~2.5倍。但是PLP价格昂贵,在发酵过程和酶转化体系中直接添加无疑大大增加生产成本。由于大肠杆菌自身具备吡哆醛激酶(PdxK)基因和磷酸吡哆醇氧化酶(PdxH)基因,从而形成PLP补救途径(见图1)。辅酶前体吡哆醇(PN)、吡哆胺(PM)和吡哆醛(PL)上5′羟甲基通过PdxK使其磷酸化,生成对应的辅酶中间体磷酸吡哆醇(PNP)和磷酸吡哆胺(PMP)以及辅酶磷酸吡哆醛(PLP),PdxH进一步催化PNP或PMP的氧化反应,生成辅酶PLP[20-25],辅酶PLP的增加可促进GAD的折叠,提高GAD酶活力。黄燕等[18]研究了在大肠杆菌发酵过程中添加PN后,酶活是对照组(不添加PN)的1.8倍。
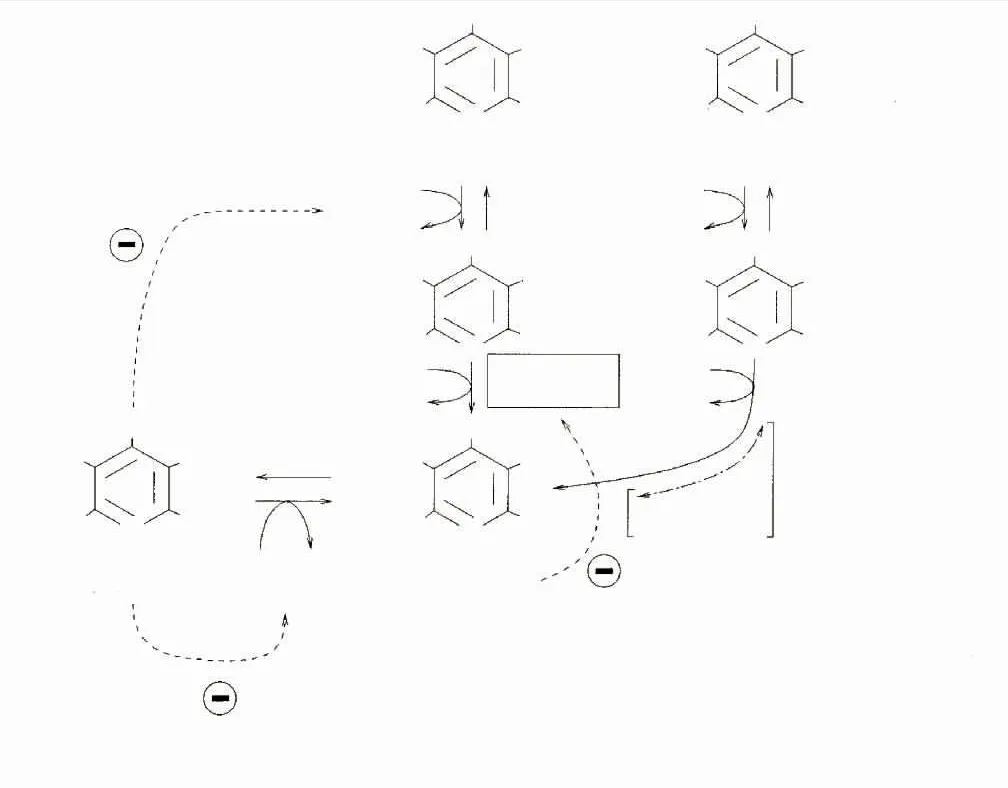
图1 大肠杆菌中PLP的补救途径[25]Fig.1 Salvage pathway of PLPin E.coli
但是大肠杆菌为非食品安全菌株,在发酵过程中易产生内毒素,并且需要添加价格昂贵且有毒害作用的IPTG作为诱导剂诱导产酶,其生产得到的GAD安全性不高,距离满足食品和医药领域的要求还有一定差距。枯草芽孢杆菌是通过美国食品和药物管理局GARS认证的安全菌株,广泛应用在食品、医药生产中。然而在枯草芽孢杆菌中缺少PdxH,所以无法利用添加辅酶前体PN的方式,通过PLP补救途径将PN转化为PLP,从而提高GAD酶活力[27-29]。目前,大量的研究集中在以枯草芽孢杆菌为宿主生产GAD,在酶转化过程中通过直接添加辅酶PLP提高转化效率,如丁伟等[26]运用安全宿主枯草芽孢杆菌生产GABA,在其转化过程中直接添加PLP,全细胞催化GABA产量为239.91 g/L,转化率54.48%。由于PLP价格昂贵,导致生产成本较高,无法适应工业化生产需求。关于在枯草芽孢杆菌为宿主生产GAD发酵过程中,添加价格低廉的辅酶前体以提高GAD酶活力的研究未见报道。因此作者以枯草芽孢杆菌(Bacillus subtilis)为宿主,通过基因工程将大肠杆菌来源的谷氨酸脱羧酶基因(gadB)在B.subtilis中异源表达,添加相对廉价的辅酶前体PL,通过PdxK介导的PLP补救途径将其转化生成PLP(见图2),从而提高酶活和产量,降低生产成本。
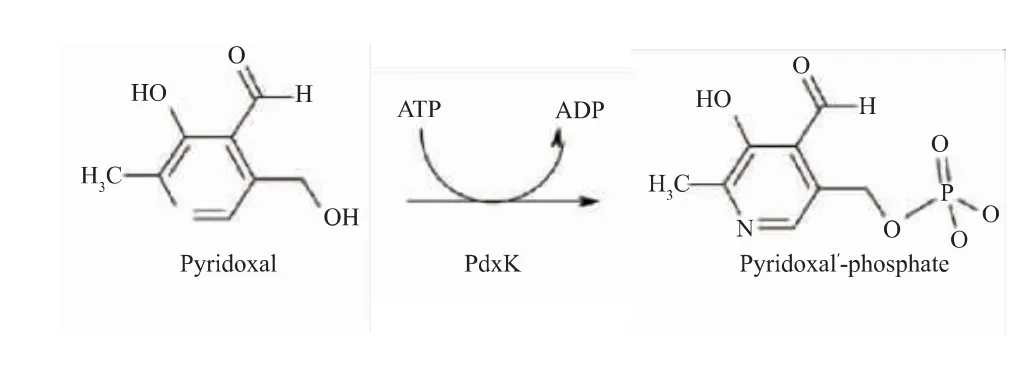
图2 PdxK激酶催化PL生成PLP[27]Fig.2 PdxK kinase catalyzes PL to PLP
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 质粒E.coli JM109/pET-24a(+)-gadB为作者所在实验室前期构建,菌株B.subtilis和表达载体pHY300PLK(含启动子PHpaII和PamyQ,不含信号肽)由作者所在实验室保存。
1.1.2 培养基 LB液体培养基(g/L):分别称取氯化钠10 g、酵母粉5 g、蛋白胨10 g,溶于1 L去离子水中,并通过添加2 mol/L NaOH或HCl调节pH至7.0。
LB固体琼脂培养基:LB液体培养基中添加质量浓度为20 g/L的琼脂粉。
高渗液体培养基:LB液体培养基中添加0.5 mol/L山梨醇。
电转培养基:LB液体培养基中分别添加0.5 mol/L山梨醇和甘露醇,质量浓度为100 g/L的葡萄糖。
RM培养基:LB液体培养基中添加0.5 mol/L山梨醇和0.38 mol/L甘露醇。
TB培养基(g/L):分别称取酵母粉24 g、蛋白胨12 g、甘油5 g、三水磷酸氢二钾16.43 g、磷酸二氢钾2.31 g,溶于1 L去离子水中,并添加2 mol/L NaOH或HCl调节pH至7.0。
1.1.3 试剂 Quickcut Hin d III限制性内切酶:购自TaKaRa生物医药技术有限公司;2×phanta Max Master Mix、Exnase II无缝连接试剂盒:购自诺唯赞(南京)生物科技有限公司;DL-10000DNA Marker、氨苄青霉素、四环素:购自宝生物有限公司;质粒提取试剂盒、琼脂糖凝胶DNA回收试剂盒:购自天根生化科技(北京)有限公司;Unstained Protein MW Marker标准蛋白品、蛋白胶制备试剂盒:购自碧云天生物技术有限公司;分子级的蛋白胨和酵母粉:购自英国Oxiod公司;其他常规试剂:购自国药化学试剂有限公司。
1.1.4 主要仪器 PCR仪:购自美国Bio-Rad公司;722型紫外可见分光光度计:购自上海仪电分析仪器有限公司;冷冻式离心机:购自Beckman coulter公司;KQ-250E型超声波细胞粉碎机:购自宁波新芝生物科技股份有限公司;pH计:购自瑞士Mettler-Toledo公司;高效液相色谱仪:购自安捷伦科技有限公司。
1.2 实验方法
1.2.1 引物设计 以质粒pET-24a(+)-gadB为模板,根据无缝克隆同源臂设计原则分别设计正、反向引物:
正向引物(F1):5′-GGAGTGTCAAGAATGGAC CAGAAGCTGTTAACGGA-3′;反向引物(R1):5′-TTTATTACCAAGCTTTCAGGTGTGTTTAAAGCTGT TC-3′。
以质粒载体pHY300PLK为模板,根据无缝克隆同源臂设计原则分别设计正、反向引物:
正向引物(F2):5′-TCAAATAAGGAGTGTCAA GAATG-3′;反向引物(R2):5′-GGTGTTTTTTTATT ACCAAGCTT-3′。
将设计好的引物送至苏州金唯智生物科技有限公司合成。
1.2.2 目的基因和表达载体的获取 以实验室保存的质粒pET-24a(+)-gadB为模板,F1/R1为正反向引物扩增gadB目的基因;PCR反应体系(50μL):5×PSBuffer 10μL、ddH2O 34μL、dNTP 4μL、模板DNA 0.5μL,正、反向引物各0.5μL,Primer STAR Polymerase 0.5μL。
PCR程序:94℃预变性5 min,98℃变性10 s,55℃退火5 s,72℃延伸2 min,变性至延伸过程进行29个循环;72℃延伸10 min;4℃保存。
以质粒载体pHY300PLK为模板,F2/R2为正反向引物扩增表达载体;PCR反应体系(50μL):5×PS Buffer 10μL、ddH2O 34μL、dNTP 4μL、模板DNA 0.5μL,正、反向引物各0.5μL,Primer STARPolymerase 0.5μL。
PCR程序:94℃预变性5 min,98℃变性10 s,55℃退火5 s,72℃延伸6 min,变性至延伸过程进行29个循环;72℃延伸10 min;4℃保存。
目的基因和表达载体PCR条带通过琼脂糖核酸电泳进行验证。
1.2.3 目的基因和表达载体的连接与鉴定 将1.2.2 已验证正确的PCR产物通过琼脂糖凝胶回收试剂盒进行回收。回收后的PCR产物用Exnase II连接酶连接,其连接体系如下:ddH2O 5.3μL、5×CE Buffer 2μL、Exnase II 1μL、表达载体1.16μL、目的基因0.54μL,置于PCR仪37℃反应30 min完成连接。
采用大肠杆菌JM109热击转化法后,将转化细胞液涂布至含100μg/mL氨苄青霉素的LB固体培养基上,在37℃恒温培养箱倒置培养10~12 h,挑取单菌落至含100μg/mL氨苄青霉素的10 mL LB液体培养基中,置于恒温摇床37℃、200 r/min培养8~10 h后收集菌体,并提取质粒以便验证和进行后续实验。将提取的质粒进行Hin d III酶切验证正确后送往苏州金唯智生物科技有限公司测序。将测序正确的质粒通过电击转化法导入表达宿主B.subtilis中,将转化细胞液涂布至含20μg/mL四环素的LB固体培养基上,在37℃恒温培养箱倒置培养10~12 h,挑取单菌落至含20μg/mL四环素的10 mL LB液体培养基中,置于恒温摇床37℃、200 r/min培养8~10 h后收集菌体,并提取质粒进行酶切验证。
1.2.4 摇瓶发酵生产GAD及蛋白质检测 将-80℃保存的重组菌B.subtilis/pHY300PLK-gadB以体积分数0.2%接种至含20μg/mL四环素的LB液体培养基中,恒温摇床37℃、200 r/min扩大培养8~10 h,再以体积分数5%转接至含20μg/mL四环素的TB发酵培养基中,恒温摇床37℃、200 r/min培养2~3 h后分别加入一定浓度的PLP、PL、PN,于恒温摇床33℃、200 r/min进行重组蛋白质的表达。发酵过程中在不同时间取样,测OD600。12 000 r/min离心1 min得到菌体和发酵上清液。将菌体用1 mL、50 mmol/L、pH 5.0的Na2HPO4-柠檬酸缓冲液重悬,加入0.6 mg/mL溶菌酶,在37℃反应30 min后置于冰水中超声破碎,12 000 r/min离心5 min得到破壁上清液和破壁沉淀,使用SDS-PAGE检测其蛋白质。
1.2.5 重组GAD酶活测定 底物溶液配制:0.1 mol/L一水谷氨酸钠和0.15 mmol/L PLP溶于50 mmol/L、pH 4.5的Na2HPO4-柠檬酸缓冲液中,置于4℃避光保存。
反应体系:将装有360μL底物溶液的1.5 mL EP管于37℃水浴锅预热10 min后,加入40μL GAD粗酶液,在37℃下反应4 min后,加入600μL、0.2 mol/L、pH 10的硼酸缓冲液终止反应,置于沸水中灭活10 min。
GABA生成量测定:采用HPLC-OPA氨基酸柱前衍生法检测GABA生成量[30]。
酶活定义:在反应液中,1 min催化底物转化生成1μmol GABA所需的酶量为一个活力单位(U)。
本文中重组GAD均指重组菌所产的GAD。
1.2.6 重组菌全细胞制备GABA工艺流程
1)GABA的制备 用水配制质量浓度为127 g/L的一水谷氨酸钠底物(折算成100 g/L谷氨酸,以下均以折算后的谷氨酸质量浓度进行阐述)。在150 mL三角锥形瓶中加入20 mL底物,加入一定量的湿菌体(在55℃水浴锅预处理50 min,改善细胞膜的通透性),反应过程中,每隔2 h用0.6 mol/L的H2SO4和NaOH调节pH,使其始终与初始pH一致。在一定温度、pH下,150 r/min水浴摇床中反应一段时间,终止反应后进行煮沸处理,12 000 r/min离心5 min得上清液,适当稀释并过0.22μm有机滤膜后用HPLC-OPA柱前衍生法进行检测。
2)GABA生成量的测定 将过滤好的样品通过HPLC检测GABA生成量[30-31]。HPLC色谱条件如下:Agilent 1200 HPLC色谱仪、Agilent自动进样器、GL Inertsil ODS-3液相柱、Agilent紫外检测器。流动相A:准确量取995 mL纯净水,加入4.52 g无水乙酸钠,搅拌使其充分溶解,再加入5 mL四氢呋喃和0.2mL三乙胺,之后用冰乙酸调节pH至7.20±0.05,充分混合后用0.22μm无机纤维素滤膜过滤备用;流动相B:准确量取200 mL纯净水,加入4.52 g无水乙酸钠,搅拌使其充分溶解,用冰乙酸调节pH至7.20±0.05后,再依次加入400 mL色谱纯的乙腈和甲醇,用冰乙酸调节pH至7.20±0.05,混合后用0.22μm有机尼龙滤膜过滤备用。梯度洗脱,流量为0.8 mL/min,柱温为40℃。根据吸收峰面积和GABA标准品峰面积计算GABA生成量,计算公式如下:
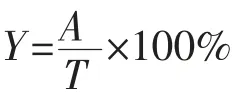
式中:Y为GABA转化率,%;A为谷氨酸转化生成GABA的实际质量浓度,g/L;T为谷氨酸转化生成GABA的理论质量浓度,g/L。
2 结果与讨论
2.1 产谷氨酸脱羧酶重组菌的构建
以实验室保存的质粒pET-24a(+)-gadB为模板,扩增gadB目的片段,并以质粒载体pHY300PLK为模板,扩增表达载体片段。扩增得到的产物用琼脂糖凝胶电泳检测,目的基因片段gadB和质粒表达载体pHY300PLK长度约为1 428 bp和5 731 bp,与理论碱基大小一致。验证正确后通过Exnase II连接酶将两个基因片段连接再转入E.coli JM109感受态细胞,涂布到LB固体培养基(含氨苄青霉素抗性)后挑取单菌落至LB液体培养基(含氨苄青霉素抗性)中过夜培养。提取质粒,酶切验证和测序成功后,将重组质粒用电击转化法导入表达宿主B.subtilis并涂布到LB固体培养基(含四环素抗性),之后挑取单菌落至LB液体培养基(含四环素抗性)中培养8~10 h,提取质粒后进行酶切验证分析。结果见图3,分别在5 130 bp和2 100 bp处有明显的条带,说明重组表达质粒pHY300PLKgadB在B.subtilis中构建成功。
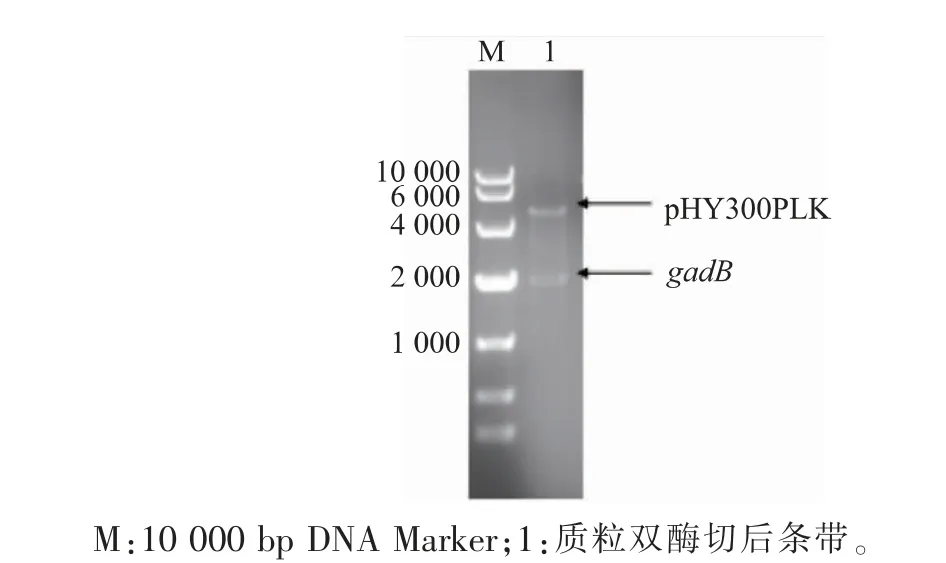
图3 酶切验证重组质粒pHY300PLK-gadBFig.3 Restriction analysis of recombinant plasmid pHY300PLK-gadB
2.2 分别添加辅酶及辅酶前体对重组菌摇瓶发酵的影响
2.2.1 添加不同种类辅酶及辅酶前体对重组菌产酶情况的影响 重组菌按照1.2.4进行摇瓶发酵产酶,摇瓶发酵温度33℃,在重组菌发酵过程中分别添加辅酶PLP(简称GAD-PLP)、辅酶前体PL(简称GAD-PL)和PN(简称GAD-PN)至终浓度为0.5 mmol/L。发酵结束后12 000 r/min离心1 min获得菌体,用超声波细胞粉碎机进行细胞破碎,12 000 r/min离心5 min得到GAD粗酶液。结果见图4,诱导48 h后,酶活分别达到25.40、28.14 U/mL和15.55 U/mL,是对照GAD-0酶活(16.34 U/mL)的1.55、1.72和0.95倍。由此可知,添加0.5 mmol/L PN时,酶活相较于对照并无明显区别,这是因为枯草芽孢杆菌中缺少PdxH氧化酶,无法通过PLP补救途径将PN转化为PLP,从而提高GAD酶活力。其次随着诱导培养时间的延长,细胞内合成的少量PLP被自身吸收并消耗而无法满足GAD表达水平提高的需要。然而向培养基中添加适量的PLP或PL可以直接或间接通过PLP补救途径合成PLP,从而提供能够维持GAD稳定的辅酶PLP,促进GAD的折叠,提高酶活[19]。鉴于PLP成本高于PL,所以在发酵过程中选择添加PL进行后续实验。
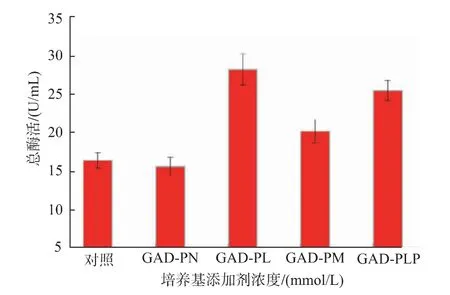
图4 不同培养基添加剂浓度对重组GAD表达的影响Fig.4 Effects of different medium additives on the production of the recombinant GAD
2.2.2 不同吡哆醛浓度对重组菌产酶情况的影响重组菌按照1.2.4进行摇瓶发酵,在过程中添加不同浓度的PL(0.01、0.03、0.05、0.07、0.1、0.2、0.3 mmol/L)发酵培养48 h后,12 000 r/min离心1 min获得菌体,用超声波细胞破碎机进行细胞破碎,12 000 r/min离心5 min得到GAD粗酶液,结果见图5。随着PL浓度的增加,GAD酶活也随之提高,当PL浓度为0.1 mmol/L时,GAD酶活达到最高为28.28 U/mL。继续增加PL的浓度,酶活并未发生显著变化,故可知PL的最适添加浓度为0.1 mmol/L。图6为发酵过程中添加不同浓度PL后的重组GAD蛋白质电泳图,从图中可见在相对分子质量53 000的条带附近有一条清晰的蛋白质电泳条带,符合GAD理论蛋白质相对分子质量大小。
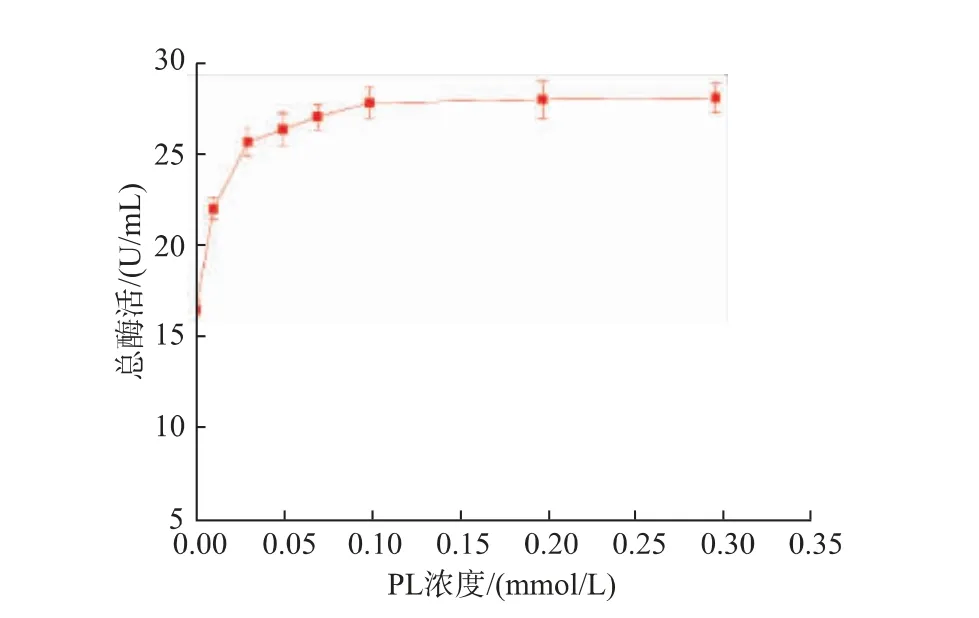
图5 不同PL浓度对重组GAD酶活的影响Fig.5 Effects of different concentration of PL on the enzyme activity of the recombinant GAD
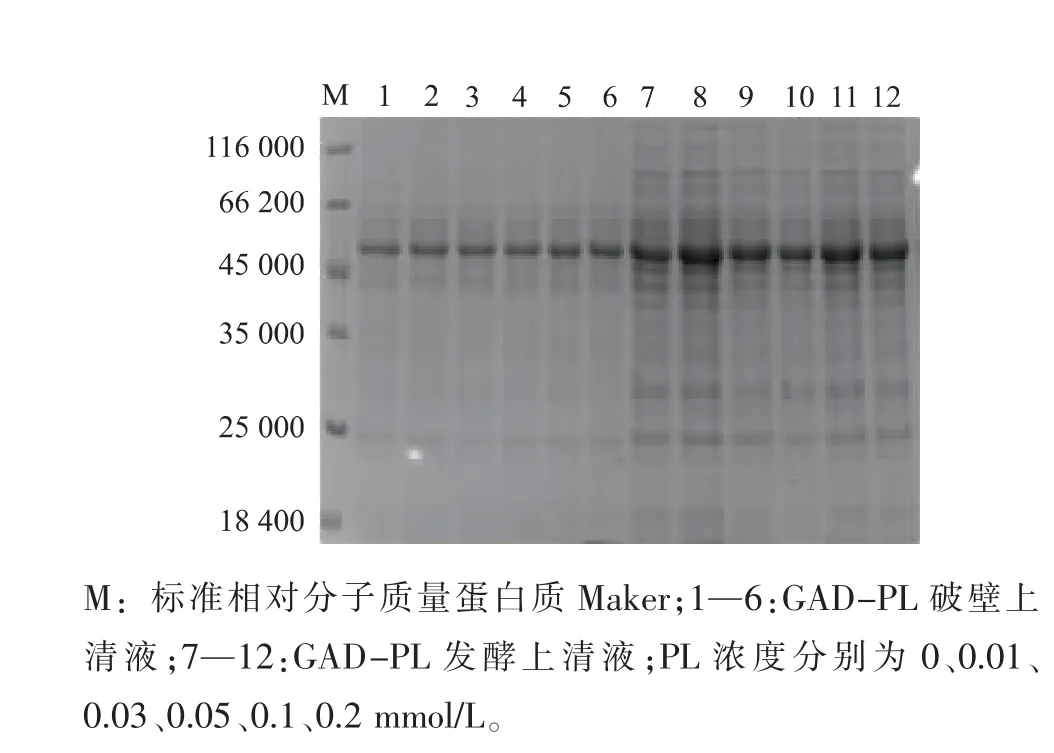
图6 不同PL浓度对重组GAD表达的影响Fig.6 Effects of different concentration of PL on the production of the recombinant GAD
2.2.3 添加吡哆醛前后重组菌发酵过程比较 重组菌按照1.2.4进行摇瓶发酵,在过程中添加0.1 mmol/L PL,探究其在不同发酵时间(0、12、24、36、48、60 h)对重组菌生长(见图7)和产GAD情况(见图8)的影响。与GAD-0相比,在发酵时间36 h左右,PL对菌体的生长有一定的促进作用,是因为在蛋白质表达过程中,通过PLP补救途径,PdxK激酶将PL磷酸化形成PLP[24],促进GAD的折叠,一定程度上有利于菌体生长。随着发酵时间的延长,由于PLP稳定性差而失去作用,导致菌体的生长有所下降。由图8可知,与GAD-0相比,GAD-PL酶活最高达到28.28 U/mL,添加适量的PL可以提供给GAD未知浓度的PLP,从而提高GAD酶活。
2.3 重组菌全细胞转化制备GABA的工艺优化
2.3.1 温度对重组菌全细胞转化生产GABA的影响 酶法制备GABA是一个不可逆反应,适宜的温度可以使GABA转化率达到最大,所以通过设置不同的酶转化温度来探究温度对GABA转化率的影响。以100 g/L的谷氨酸为底物,溶于去离子水中,加入湿菌体(在55℃水浴锅预处理50 min,改善细胞膜的通透性)30 U/g,在150 r/min的水浴摇床中进行转化,反应过程中,控制pH为5.0。温度梯度设置为25、30、35、40、45、50℃,反应24 h后终止反应并进行煮沸处理,12 000 r/min离心5 min得上清液,适当稀释并过0.22μm有机滤膜后用HPLC-OPA柱前衍生法进行检测,结果见图9。转化率随温度升高逐渐提高,当转化温度达到40℃时,GAD-0和GAD-PL转化率达到最高,分别为64.78%和82.27%,继续升高温度,转化率反而降低。这是因为枯草芽孢杆菌细胞壁厚,而反应温度过低时,底物与胞内酶液无法充分接触使得转化率低;当反应温度过高时,酶与PLP稳定性差,从而影响GABA的转化率。
2.3.2 pH对重组菌全细胞转化生产GABA的影响以100 g/L的谷氨酸为底物,溶于去离子水中,加入预处理过的湿菌体30 U/g,在40℃、150 r/min的水浴摇床中进行转化,反应过程中,每隔2 h用0.6 mol/L的H2SO4或NaOH调节pH,使其始终与初始pH保持一致。pH梯度设置为3.5、4.0、4.5、5.0、5.5、6.0,反应24 h后终止反应并进行煮沸处理,12 000 r/min离心5 min得上清液,适当稀释并过0.22μm有机滤膜后用HPLC-OPA柱前衍生法进行检测。结果见图10,当pH为4.5或5.0时,GABA转化率最高,GAD-0的GABA转化率为75.45%和76.21%,GAD-PL的GABA转化率为84.54%和84.21%。当pH小于4.5时,底物一水谷氨酸钠在酸性条件下容易酸水解生成谷氨酸析出,从而形成乳白色浑浊液体,不利于酶与底物的充分结合;当pH大于5.0时不利于酶活性中心的赖氨酸残基以shifft-碱与PLP、底物结合,从而抑制GABA的生成。可见,酶转化法制备GABA的pH耐受范围窄,过酸或过碱都不利于酶促反应进行,考虑在高质量浓度底物下,过低的pH更容易导致底物析出,所以酶转化最适pH为5.0。
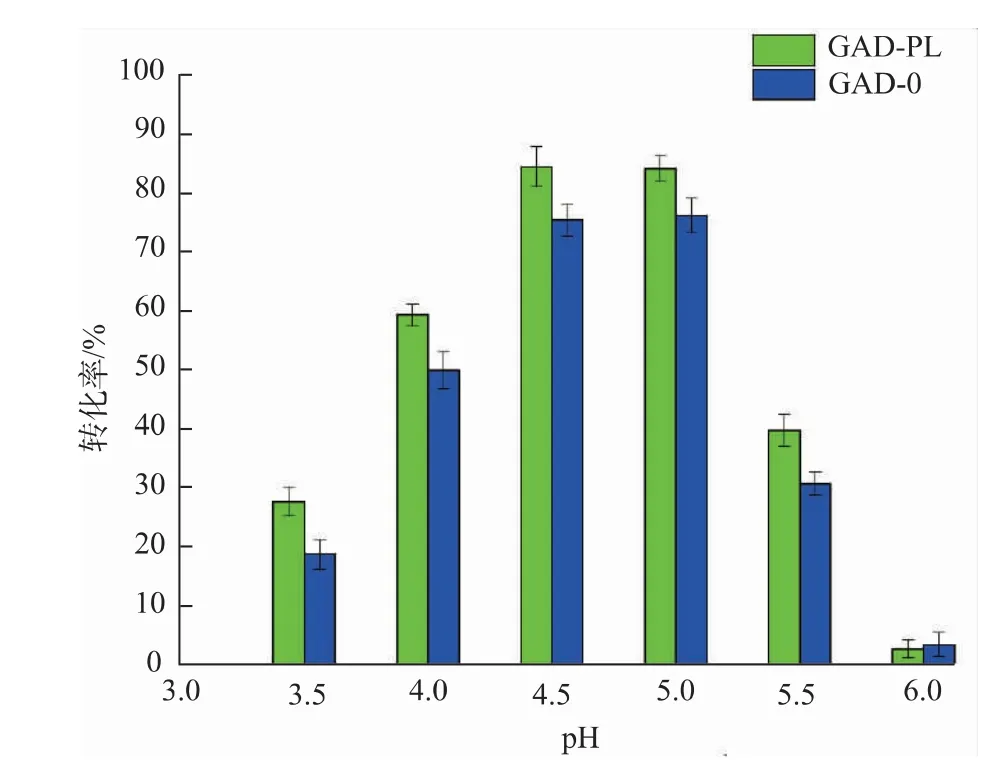
图10 反应p H对酶转化的影响Fig.10 Effect of pH on enzymatic conversion
2.3.3 加菌量对重组菌全细胞转化生产GABA的影响 以100 g/L的谷氨酸为底物,溶于去离子水中,加入预处理过的不同湿菌体(20、30、40、50、60 U/g),在40℃、150 r/min的水浴摇床中反应24 h,反应过程中,控制pH为5.0。反应结束后进行煮沸处理,12 000 r/min离心5 min得上清液,适当稀释后用氨基酸柱前衍生法进行HPLC检测。结果见图11,重组菌全细胞转化率随着加菌量的增加而逐渐提高,其中GAD-PL和GAD-0分别在40 U/g和50 U/g时将底物完全转化,转化率达到100%。GAD-PL的加菌量少于GAD-0是因为前者细胞中的PLP含量高于后者,PLP作为辅助因子有利于酶促反应的进行。
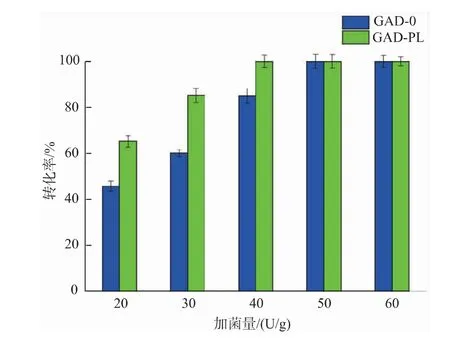
图11 不同加菌量对酶转化的影响Fig.11 Effect of wet cell dosage on enzymatic conversion
2.3.4 反应时间对重组菌全细胞转化生产GABA的影响 以100 g/L的谷氨酸为底物,溶于去离子水中,加入预处理过的不同湿菌体,GAD-0和GAD-PL加入量分别为50 U/g和40 U/g,在40℃、150 r/min的水浴摇床中反应24 h,反应过程中,控制pH为5.0。反应结束后进行煮沸处理,12 000 r/min离心5 min得上清液,适当稀释后用HPLC-OPA柱前衍生法进行检测,结果见图12。在0~20 h,GAD-0和GAD-PL转化合成GABA的产量随时间延长迅速增加,在20 h时转化率达到100%,之后随着反应进行,转化率不再发生变化。
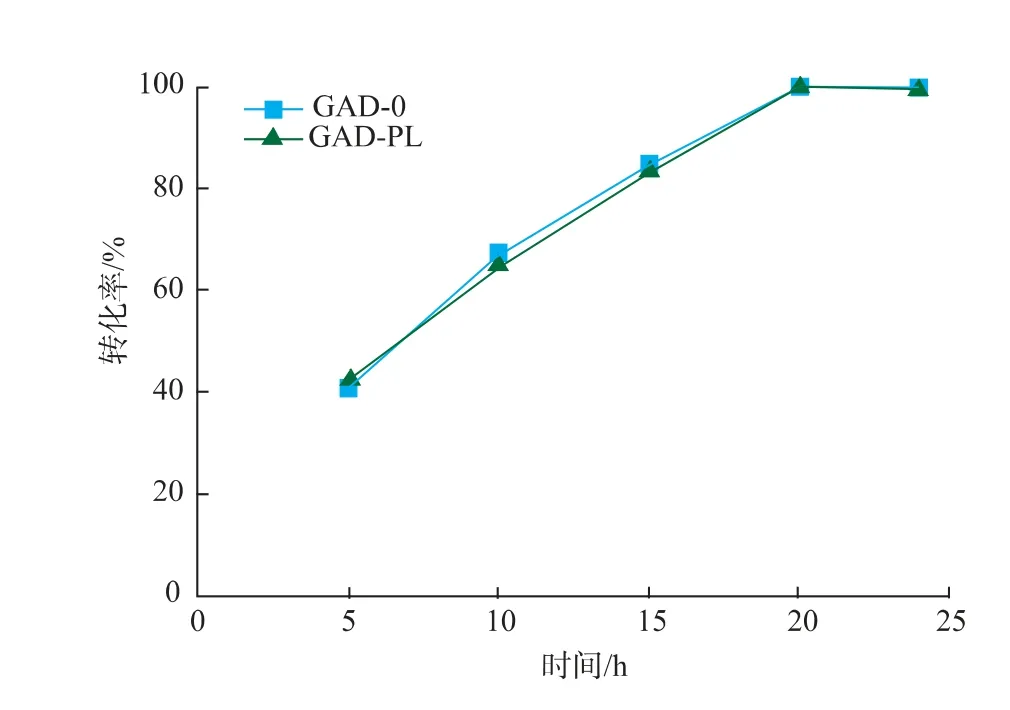
图12 反应时间对酶转化的影响Fig.12 Effect of reaction time on enzymatic conversion
2.3.5 底物质量浓度对重组菌全细胞转化生产GABA的影响 以200 g/L的谷氨酸为初始底物,溶于去离子水中,加入预处理过的不同湿菌体,GAD-0和GAD-PL加菌量分别为50 U/g和40 U/g,在40℃、150 r/min的水浴摇床中反应6 h后,每隔3 h补加1.27 g的谷氨酸固体至底物质量浓度分别为200、250、300、350、400 g/L,反应过程中,控制pH为5.0,反应48 h。反应结束后进行煮沸处理,12 000 r/min离心5 min得上清液,适当稀释并过0.22μm有机滤膜后用HPLC-OPA柱前衍生法进行检测。结果见图13,当底物质量浓度达到400 g/L谷氨酸时,GAD-0和GAD-PL转化生产GABA的转化率分别从100%(底物质量浓度350 g/L谷氨酸)下降为97.72%和98.43%。综合考虑,为提高工业生产效率和节省下游分离纯化成本,选择350 g/L作为酶法制备GABA的最适底物质量浓度。
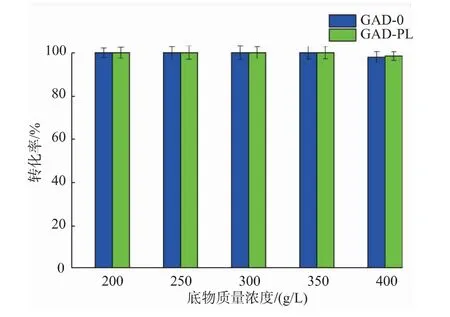
图13 不同底物质量浓度对酶转化的影响Fig.13 Effect substrate concentration on enzymatic conversion
3 结语
作者成功构建并重组表达了含有Escherichia coli来源的 gadB基因的重组菌 B.subtilis/pHY300PLK-gadB。实验表明在发酵过程中添加0.5 mmol/L辅酶前体PL的GAD总酶活达到28.14 U/mL,是对照总酶活的1.72倍。进一步优化重组菌全细胞酶法生产GABA的工艺条件,结果表明,当温度为40℃,pH为5.0,GAD-0和GAD-PL的最适加菌量分别为50 U/g和40 U/g时,GABA转化率达到100%。当谷氨酸质量浓度为400 g/L时,GABA产量分别为275.60 g/L和273.61 g/L。综上所述,作者考察了菌体发酵培养过程中添加辅酶前体PL对重组菌产GAD及制备GABA的影响,开发了一种不需要在发酵过程和酶转化体系中添加昂贵辅酶PLP就能高效生产GABA的工艺技术,为GABA在食品和医药行业中的广泛应用打下了坚实基础。
