酶法制备壳寡糖及其抗肿瘤活性评价
2021-07-29龚劲松丁振中许正宏史劲松
季 珂, 李 恒*, 龚劲松, 耿 燕, 丁振中, 蒋 敏, 许正宏, 史劲松
(1.江南大学 药学院,江苏 无锡 214122;2.扬州日兴生物科技股份有限公司,江苏 高邮 225601;3.江南大学生物工程学院,江苏 无锡 214122)
壳寡糖(chitosan oligosaccharides,COS)是一种海洋来源的相对分子质量小于3 000的低聚糖。目前,壳寡糖大都通过化学法(包括酸解法和氧化法)、物理法[1]以及酶解法(纤维素酶[2]或壳聚糖酶)降解得到。基于壳聚糖酶的专一性与高效性,用其制备壳寡糖的方法具有良好的应用优势和发展潜力[3]。
COS相对分子质量低的特性不但改善了其原料水溶性差的问题,同时其也具有广泛的生物功能,包括抗炎[4]、抗菌[5]、抗氧化[6]、降糖[7]及神经保护等。近年来,针对COS抗肿瘤活性的研究逐渐成为热点。
研究表明,在多株肿瘤细胞(胃癌细胞、肾癌细胞、肺癌细胞、乳腺癌细胞和结肠癌细胞等)中,COS均能达到半数致死的效果[8]。相对分子质量和去乙酰度影响其抗肿瘤活性,且低相对分子质量表现出更为明显的效果[9]。在作用机制探索方面,COS可通过诱导HeLa和A549细胞的自噬性死亡而抑制细胞增殖[10],对A549细胞,COS还可明显降低细胞线粒体膜电位水平而促进细胞凋亡[11]。此外,COS可通过上调p21,下调PCNA、cyclin A和cdk-2基因抑制HepG2细胞的DNA合成速率,抑制细胞增殖[12];通过诱导SW480细胞阻滞在G2/M期而抑制细胞增殖[13]。由此可见,COS对不同肿瘤细胞的作用和机制并不完全相同,其对肿瘤细胞的作用还有待进一步研究。
为了进一步了解COS潜在的抗肿瘤作用,首先以壳聚糖酶酶解法自行制备COS,建立基于分级处理的COS优化制备工艺,将获得的低相对分子质量COS产物对不同肿瘤细胞的抗肿瘤活性进行评价初筛,进而在作用最为显著的人乳腺癌MDA-MB-231细胞中进行量效关系评价及初步机制探讨。
1 材料与方法
1.1 材料与试剂
壳聚糖酶:由作者所在实验室自行构建的重组菌E.coli Rosetta-gami(DE3)/ChiE发酵产酶[5],经纯化浓缩后得到壳聚糖酶酶液,酶活为2 260 U/mL;COS、氨基葡萄糖、无水乙醇、亚硫酸氢钠、氢氧化钠、酒石酸钾钠、3,5-二硝基水杨酸、冰醋酸、Tris:购自国药集团上海化学试剂公司;盐酸阿霉素:购于上海麦克林生化科技有限公司;DMEM、RPMI 1640基础培养基、FBS胎牛血清、抗生素、胰酶、Dulbecco's Phosphate Buffered Saline(DPBS):购 于美国Gibco公司;纳滤膜:购于美国陶氏化学公司;Transwell小室、Cell Counting Kit-8(CCK-8)试剂盒:购于美国Thermo Fisher公司。
质量分数1%的胶体COS溶液:取1 g COS粉末加入少量去离子水溶胀,加入30 mL的0.4 mol/L的乙酸溶液搅拌至COS粉末完全溶解,再以2 mol/L的NaOH调节pH至6.0,加水定容至100 mL。
DNS试剂:准确称取244.4 g酒石酸钾钠加到500 mL煮沸的蒸馏水中溶解,然后依次加入3,5-二硝基水杨酸6.3 g、NaOH 21 g、苯酚5 g和亚硫酸氢钠5 g,搅拌至溶解后定容至1 L,棕色瓶中贮存,一周后可使用。
1.2 仪器与设备
pH计:上海Mettler-Toledo公司产品;紫外分光光度计:上海尤尼可仪器有限公司产品;数显恒温水浴锅:金坛区富华电器有限公司产品;高速冷冻离心机:日本日立公司产品;超高效液相色谱串联四极杆飞行时间质谱联用仪:美国沃特世公司产品;酶标仪:上海精密科学仪器有限公司产品;细胞培养箱:美国Thermo Fisher公司产品;全自动倒置荧光显微镜(共聚焦超分辨成像系统):日本Nikon公司产品。
1.3 方法
1.3.1 COS的酶法制备 探究酶解时间对酶解效果的影响时,反应体系包含制得的质量分数1%COS溶液10 mL(乙酸钠缓冲液,pH 6.0)和0.3 mL酶液,50℃下酶解8 h,间隔1 h取样测定还原糖含量。
探究加酶量对酶解效果的影响时,向质量分数1%的COS溶液中分别加入壳聚糖酶60、90、120、150、180 U/g。体系在50℃下酶解4 h,反应结束后测定还原糖含量。
1.3.2 DNS法测定还原糖质量浓度 以氨基葡萄糖为标样,制作标准曲线:准确称取10 mg氨基葡萄糖,溶解定容至100 mL,再分别吸取0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mL,以去离子水补至1 mL,各加入1 mL DNS,沸水浴5 min,冷却定容至5 mL,于540 nm处测定吸光度。空白组为同样步骤下1 mL去离子水。
分别取1 mL酶解产物,加入1 mL DNS溶液,沸水浴中反应5 min,迅速冷却至室温,在540 nm处测量吸光度。去离子水作为空白对照。
1.3.3 COS的制备工艺 最适酶解条件下得到的壳寡糖酶解液,经100℃水浴15 min后10 000 r/min离心除酶。上清液加入体积分数70%乙醇后4℃过夜。离心收集的上清液依次经截留相对分子质量3 000的膜超滤留取滤过液,经截留相对分子质量300的膜纳滤收取截留液后,浓缩并冻干得到COS样品。
1.3.4 液相色谱-质谱联用法(liquid chromatographymass spectrometry,LC-MS)测定COS样品成分 液相色谱条件:色谱仪Waters acquity UPLC,检测器Waters acquity PDA,柱温45℃,流量0.3 mL/min,进样量10μL。质谱条件:电喷雾电离(ESI+),离子源温度100℃,脱溶剂气温度400℃,扫描范围:m/z 20~2 000。
1.3.5 细胞培养 HepG2细胞和PATU-8988细胞培养在含体积分数90%RPMI1640基础培养基、体积分数10%胎牛血清、100 U/mL青霉素、100μg/L链霉素的培养基内;MDA-MB-231细胞基础培养基为DMEM,其他条件同上。于37℃、体积分数5%CO2的细胞培养箱中贴壁培养,每3 d传一代。
1.3.6 CCK-8法测定细胞生存率 取汇合度90%的细胞,5×103个/mL的细胞浓度铺板至96孔板。考察1~1 000μg/mL质量浓度范围内COS对3株肿瘤细胞作用24 h的生存率影响。COS与阿霉素(DOX)复合给药时,首先确定DOX质量浓度为细胞生存率为50%所对应的质量浓度(IC50),即2.5 μg/mL。以质量浓度为1、10、100、1 000μg/mL的COS作用6 h后给药DOX孵育24 h。之后每孔加10μL CCK-8,孵育1.5 h后测A450nm。阳性对照组为DOX,空白组为培养基,计算细胞生存率,公式如下:
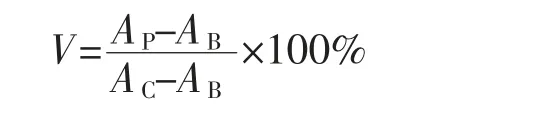
式中:V为细胞生存率,%;AP为药物组在450 nm处吸光度;AB为空白组在450 nm处吸光度;AC为对照组在450 nm处吸光度。
1.3.7 细胞迁移实验 汇合度90%的MDA-MB-231细胞消化后,以饥饿培养基重悬,以每孔1×105个接种于24孔板的小室内。细胞完全贴壁后加入500μg/mL COS培养24 h,吸去培养基。多聚甲醛固定30 min,DPBS洗3遍,结晶紫染色30 min。用流水冲至孔板无色,将小室取出,擦净内部底面后倒置拍照。之后将小室放入24孔板中,每孔加1 mL体积分数33%冰醋酸,振荡,取200μL液体测A570nm。
1.3.8 激光共聚焦检测细胞对DOX的摄取 将对数生长期的MDA-MB-231细胞以1×104个/mL的细胞浓度铺板至激光共聚焦专用培养皿。联用组加入500μg/mL COS 1 mL,作用4 h后再加入1 mL含有2倍终质量浓度DOX培养基,对照组为DOX单独给药组。培养箱中继续孵育1、3、5 h。吸去培养基,DPBS洗1遍,经多聚甲醛固定和DAPI染色各20 min后,DPBS洗3遍。包裹锡箔纸,避光拍照。
1.3.9 统计学分析 数据采用平均值±标准差表示。单因素数据采用单向方差分析法分析。显著性差 异 表 示 为*P<0.05,**P<0.01,***P<0.001。用GraphPad Prism软件制图分析。
2 结果与讨论
2.1 COS的酶法制备
考察酶解时间、加酶量对壳聚糖酶酶解的影响。如图1所示,还原糖生成量随酶解时间延长而上升。酶解4 h内,还原糖含量快速增加,4 h之后趋于平稳,最佳酶解时间选定4 h。由图2可知,酶解过程中,还原糖生成量随着加酶量的升高而逐渐增大。在加酶量为120 U/g时,还原糖生成量近最大值后稳定。继续增加酶量未能使还原糖质量浓度显著增加。最优加酶量选择为120 U/g。
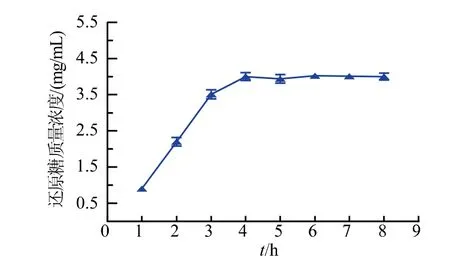
图1 酶解时间对COS水解效果的影响Fig.1 Effect of time on chitosan hydrolysis
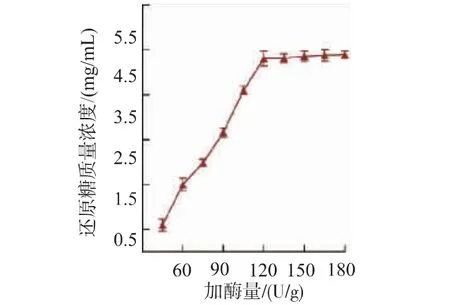
图2 加酶量对COS水解效果的影响Fig.2 Effect of ratio of enzyme and substrate dosage on chitosan hydrolysis
对酶解液逐步采用乙醇沉淀、超滤、纳滤进行分级分离,工艺流程如图3,最终得到COS产物,得率约41%。
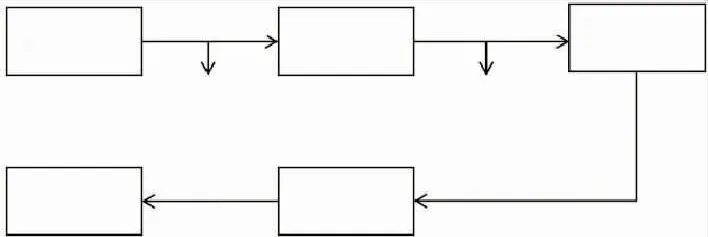
图3 COS的制备工艺Fig.3 Protocol of COSpreparation
2.2 COS组成分析
采用LC-MS法分析COS产物组成。液相色谱图中对应3个保留时间有吸收峰(见图4(a)),分别是5.21、6.90、8.36 min。分别对其进行质谱分析,在ESI+模式下,质荷比m/z 341.1、363.1(见图4(b))对应[壳二糖+H]+、[壳二糖+Na]+的分子离子峰,502.2、524.2(见图4(c))对应[壳三糖+H]+、[壳三糖+Na]+的分子离子峰,663.3、685.3(见图4(d))对应[壳四糖+H]+、[壳四糖+Na]+的分子离子峰。依此判断所得COS产物的主要组分为壳二糖、壳三糖和壳四糖。进一步通过峰面积积分计算可知,所得COS组分中壳二糖、壳三糖和壳四糖相对含量的比例约为3∶5∶2。
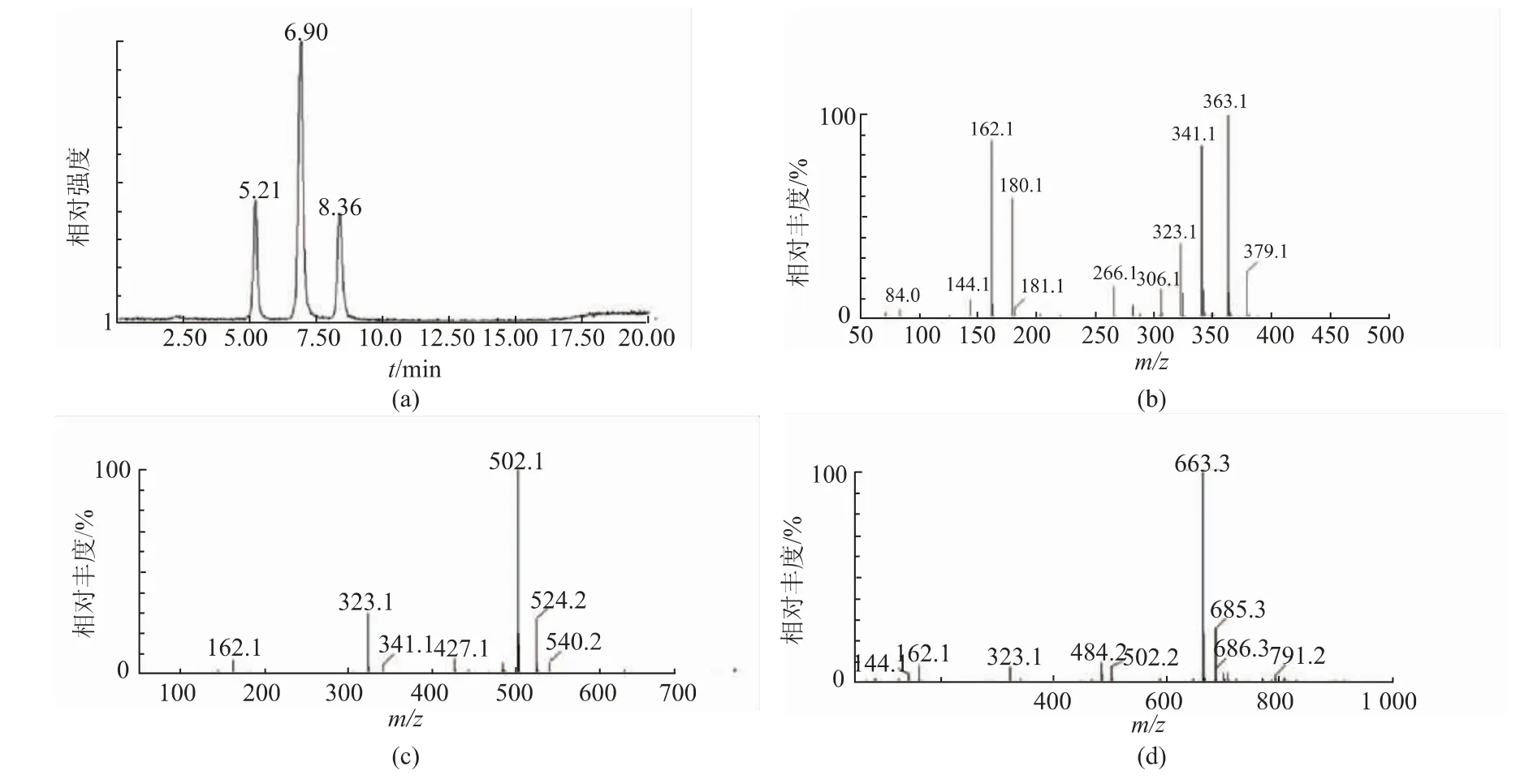
图4 COS的液相色谱-质谱图Fig.4 Liquid chromatography-mass spectrometry profile of COS
通过自行构建的壳聚糖酶酶解,以及多级分级处理工艺获得了低相对分子质量的COS,为后续抗肿瘤活性的分析提供了更为明确和简单的物质基础。
2.3 COS抗肿瘤作用评价
2.3.1 COS对不同肿瘤细胞的抑制活性 研究COS对人肝癌细胞HepG2、人乳腺癌细胞MDAMB-231和人胰腺癌细胞PATU-899生长的影响(见图5)。在给药质量浓度0~1 000μg/mL情况下,未观察到3株肿瘤细胞有生长抑制现象,可以认为低质量浓度的COS对肿瘤细胞生长影响甚微。
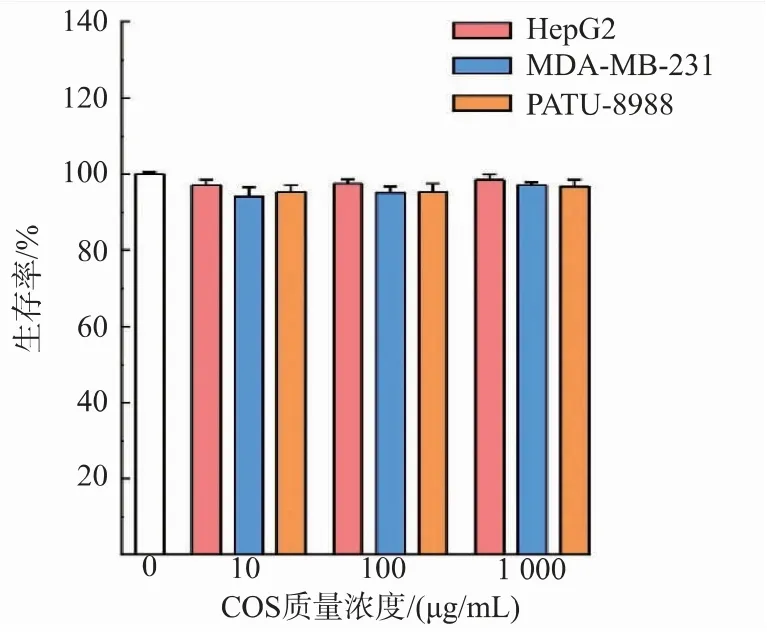
图5 COS对肿瘤细胞生存率的影响Fig.5 Effect of COSadministrated against various tumor cell lines
类似的结果在前期A549和HCT-116细胞的研究中也有报道。4种来源不同的COS作用时,高质量浓度(1.25~20 mg/mL)明显抑制细胞增长,而低质量浓度(0.078 125~1.25 mg/mL)呈现负抑制作用[8]。其中相对分子质量在1 500~2 000的COS样品即使在高质量浓度(1.25~20 mg/mL)下对A549细胞依然无细胞毒性。综观已报道的研究结果,多数报道可显著抑制细胞生长的研究中使用的COS质量浓度较高,如相对分子质量1 000~3 000的COS在质量浓度5.0 mg/mL时对MDA-MB-231细胞抑制效果最佳[14];2~5 mg/mL的COS对HepG2细胞抑制率有剂量依赖关系[15]。COS的肿瘤抑制活性因自身相对分子质量、给药质量浓度以及评价用细胞株的不同而各异,因此有必要进行更为细致地考察和分析。
2.3.2 COS联合DOX对不同癌细胞的抑制活性近期研究发现,在多株骨肉瘤细胞中,甘露糖与DOX或顺铂联用可通过下调Bcl-2家族的Mcl-1和Bcl-XL蛋白质表达水平而增强肿瘤细胞内在凋亡途径,提高抗肿瘤作用[16]。DOX是治疗乳腺癌、肝癌等实体瘤的一种常用化疗药物[17]。DOX的非靶向性可对正常细胞造成损伤[18]。因此,新的方案建议可与其他药物或天然产物联用降低用药量以减少其副作用[19]。受此启示,将COS与DOX复合给药以评价其效果。如图6所示,相较于DOX组50%的细胞生存率,COS仅在人乳腺癌细胞MDA-MB-231上表现出增强DOX抑制作用的效果,且在较低质量浓度下细胞生存率可下降20%~30%。由此选定MDA-MB-231细胞为后续实验的模型,进一步探讨复合给药的效果和机制。
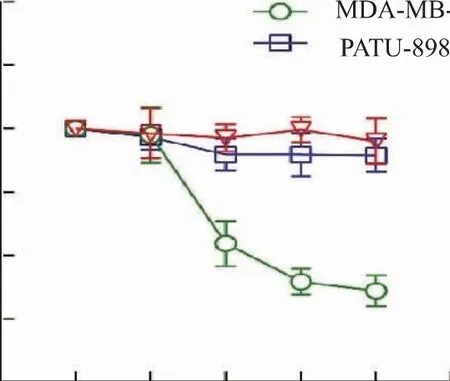
图6 复合给药对肿瘤细胞生存率的影响Fig.6 Effect of combination treatment on tumor cell viability
2.3.3 COS作用时间对其联合DOX抑制MDAMB-231细胞生存率的影响 在MDA-MB-231细胞中,进一步分析COS作用时间对细胞生存率的影响。由图7所示,与初始状态下的细胞生存率相比(见图7(a)),COS短时间作用后细胞生存率显著降低,表现出增强细胞对DOX敏感性的能力。其中,给药时间4 h条件下(见图7(b)),COS质量浓度在0~125μg/mL时细胞生存率呈质量浓度依赖性下降,250~1 000μg/mL时趋于平稳,与阳性药物DOX组相比均有极大的显著性差异(***P<0.001);作用8 h(见图7(c)),COS质量浓度在0~125μg/mL时细胞生存率约下降20%,与DOX组相比有较大显著性差异(**P<0.01),增大质量浓度在250~1 000μg/mL时有显著性差异(*P<0.05)。继续延长时间至12 h并不能降低细胞的生存率(见图7(d))。COS在MDA-MB-231细胞中增强其对阿霉素敏感性的机制有待进一步分析。
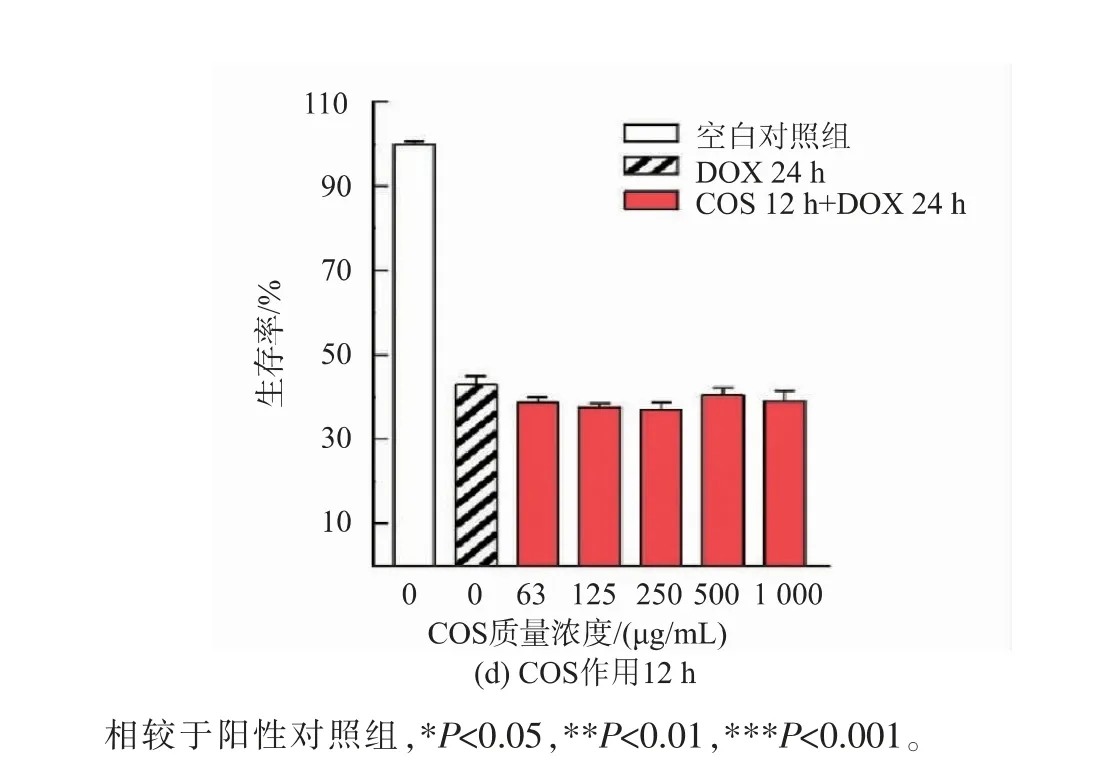
图7 COS作用时间对MDA-MB-231细胞生存率的影响Fig.7 Effect of COStreated time on MDA-MB-231 cells viability
2.4 COS联合DOX抑制MDA-MB-231细胞生存率的机制初探
2.4.1 COS对MDA-MB-231细胞迁移能力的影响考虑到MDA-MB-231细胞的高迁移特性,首先以小室迁移实验体外考察COS能否抑制肿瘤细胞扩散。如图8所示,500μg/mL COS作用后,相较于空白对照组(NC),COS组的细胞迁移数量明显减少(**P<0.01)。说明COS可有效抑制MDA-MB-231细胞迁移,这与Nam等[20]报道的研究现象一致。此外,COS抑制肿瘤细胞迁移的现象也存在于成纤维HT1080细胞[21]和MCF-10A乳腺上皮细胞[22]。由此确认了COS抑制肿瘤细胞迁移的作用。
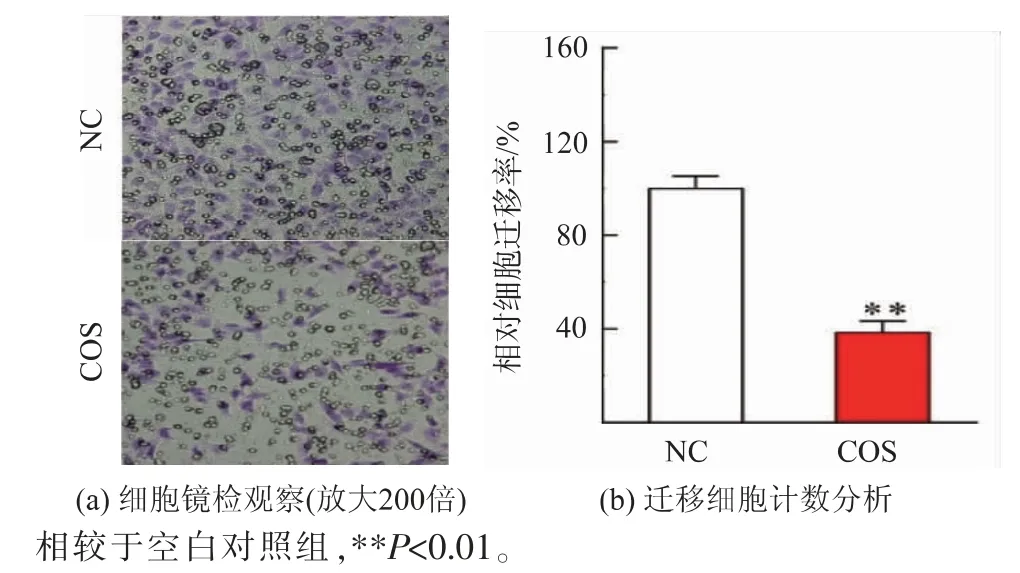
图8 COS抑制MDA-MB-231细胞的小室迁移分析Fig.8 Transwell migration assay of MDA-MB-231 cells with COS
2.4.2 COS对DOX入核的影响 DOX作用于肿瘤细胞时,作为拓扑异构酶Ⅱ抑制剂,进入细胞核干扰DNA复制而发挥作用[21]。借助DOX自带红色荧光的特点,通过激光共聚焦显微镜观察复合COS给药时,MDA-MB-231细胞对DOX的摄取效果,结果如图9所示。随着DOX作用时间的延长,无论是否给药COS,细胞内DOX荧光强度均呈时间依赖性增强。进一步与复合给药相比,1 h时,两组都观察到轻微的DOX入核量,且差异不明显。而在3 h时,COS与DOX复合给药组较DOX单独给药组显示出更强的核内红色荧光。5 h时,两组的细胞核内红色荧光均达到最强但无显著差异。由此说明,COS具有促进DOX快速富集于MDA-MB-231细胞核的作用。推测这一过程可能与COS带正电荷有关,由于静电作用靶向改变了肿瘤细胞膜表面负向电子流,从而影响信号传导通路[23]。此外,COS的这种增强DOX诱导细胞凋亡的作用也在负载DOX的含COS纳米材料中被发现和报道[24]。
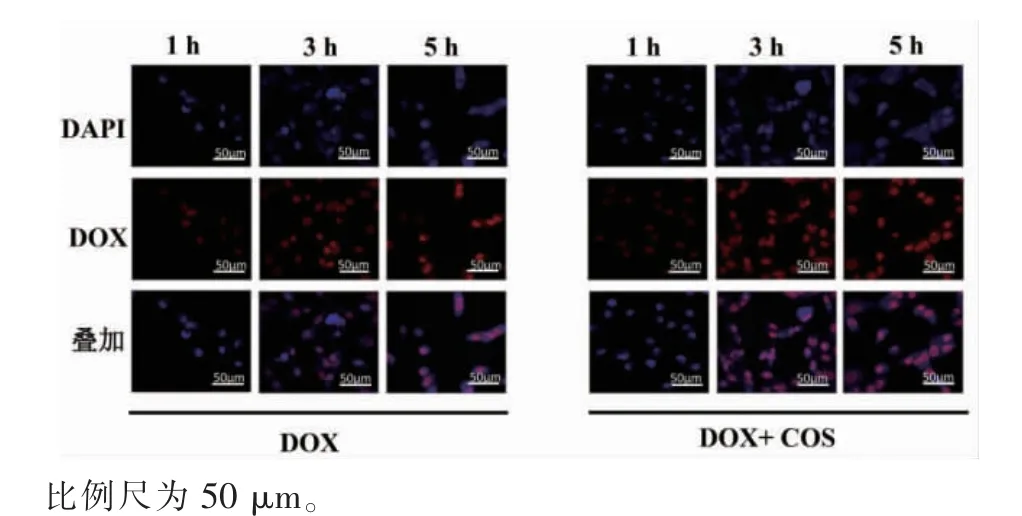
图9 MDA-MB-231细胞对DOX的摄取Fig.9 Uptakeof DOX incubation with MDA-MB-231cells
总结以上结果可以推测,在MDA-MB-231细胞中,COS与DOX的复合给药通过抑制肿瘤细胞迁移,并促进阳性药物DOX的入核而发挥抗肿瘤活性。二者的联用具有一定协同增效作用。
3 结 语
COS具有良好的生物相容性和广泛的生物学活性。COS的抗肿瘤作用是研究的热点,但其作用与机制因糖的组成以及细胞种类等而各异,有必要进一步在特定细胞上探讨COS的作用与机制。
基于前期在细胞水平发现的糖与化疗药物联用提高药效的研究结果[16],本研究中在酶法制备得到聚合度2~4的低相对分子质量COS的基础上,采用COS与DOX复合给药的方式评价COS的抗肿瘤作用。体外抗肿瘤活性评价结果显示,单独给药低质量浓度COS对所选用的3株肿瘤细胞并无显著抑制效果;当与DOX复合给药时,低质量浓度COS即可显著降低人乳腺癌MDA-MB-231细胞生存率。进一步的机制分析推测了COS可通过抑制人乳腺癌细胞迁移,同时促进DOX入核而增强肿瘤细胞对化疗药的敏感性,发挥协同抗肿瘤特性。这为功能糖等膳食补充剂与化疗药物联用的治疗方案提供了数据参考和理论支撑。
由于COS的抗肿瘤作用与机制较为复杂,受糖本身性质以及细胞株影响较大,未来对于COS抗肿瘤作用的深入解析还有待从特定糖的结构、糖与细胞作用的靶点、可能影响的关键基因和信号通路等分子水平进一步阐释和验证。
