刺激响应型微胶囊研究进展
2021-07-29卢立新
卢立新, 徐 婧, 潘 嘹
(1.江南大学 机械工程学院,江苏 无锡 214122;2.江苏省食品先进制造装备技术重点实验室,江苏 无锡 214122)
微胶囊技术起源于大西洋海岸渔业公司,20世纪30年代他们提出了用明胶作为壁材,在液体石蜡中制备鱼肝油-明胶微胶囊的方法。微胶囊技术首次投入市场是在20世纪50年代,美国NCR公司以明胶-阿拉伯树胶为原料,制成无碳复写纸,开创了微胶囊技术的时代[1]。微胶囊技术是通过化学法、物理法或物理化学法,利用天然或合成的高分子材料,将固体、液体甚至是气体等核心物质包囊成直径为1~5 000μm的一种具有半透性或密封囊膜的微小囊状物的技术[2],所制成的微小囊状物叫作微胶囊,通常把被包裹在内部的核心物质叫作“芯材”,外壳材料叫作“壁材”[3]。
微胶囊的制备方法主要有3类:物理法、化学法和物理化学法,目前应用较多的是界面聚合法、原位聚合法和凝聚法[4]。随着层层组装技术的不断发展,因其制备条件温和、操作简单和尺寸稳定可控等优点,其在微胶囊的制备中,也占有一席之地[5]。在纳微胶囊的合成中,微流控技术发展起来,该技术可以精确控制乳液液滴的尺寸、形状和结构,为合成具有可控尺寸、形状和功能性的纳微胶囊提供了极好的模板[6]。
近年来,国内外在具有缓释性能的微胶囊[7-13]、相变微胶囊[14-17]、层层组装微胶囊[18-19]等方面的研究中取得了一定成果。但由于科技的不断发展,传统微胶囊的单一包覆和保护囊芯材料的功能已满足不了人们的需求,所以其靶向性、可控性等特殊功能成为研究的热点。经过国内外研究人员的不断探索,刺激响应型微胶囊应运而生。所谓“刺激响应型微胶囊”是一种对外界环境的刺激具有一定感知力和响应性的微胶囊[6]。微胶囊的囊壁材料随着外界环境的改变而发生渗透性的改变或者被破坏,从而释放出芯材物质。外界环境的改变包括化学改变和物理改变,化学改变是指环境的改变导致微胶囊的壁材发生化学反应,从而改变了壁材的化学性质;物理改变是指由于环境的改变,壁材发生相转变或由于机械外力造成破损,改变壁材的连续性或完整性,而不改变其化学性质[20]。这些外界环境主要包括热、pH、光、磁等。刺激响应型微胶囊根据其对不同环境刺激的响应数量,可分为单刺激响应型微胶囊与多刺激响应型微胶囊。作者对不同刺激响应型微胶囊的研究进行了综述。
1 单刺激响应型微胶囊
1.1 热刺激响应型微胶囊
热刺激响应型微胶囊可以感知温度变化从而引起微胶囊芯材的释放。这类微胶囊的壁材通常由温敏聚合物材料制成,当囊壁材料感知到温度改变而发生相变时,囊壁聚合物产生孔隙或者引起囊壁聚合物的分解,导致芯材的释放[21]。除了材料直接加热外,其他的光、电、磁等刺激也可以引起温度变化,进而导致释放。
微胶囊壁材发生相变而产生孔隙,以聚-N-异丙基丙烯酰胺(PNIPAM)材料为代表,当外界温度到达其最低临界溶解温度(LCST)时,相变导致聚合物收缩产生孔隙,囊壁渗透性增强,触发芯材物质的释放[22-23]。王海杰以正辛烷为模板,用N-异丙基丙烯酰胺制备了温敏型有机-无机杂化纳米微胶囊[24]。纳米微胶囊对甲酚红的吸附随温度不同而发生变化,当外界温度高于LCST时,壁材发生相变而收缩使囊壁微孔打开,导致芯材物质扩散。Vasani采用表面引发的原子转移自由基聚合来接枝源自硅藻生物硅微胶囊表面的低聚(乙二醇)甲基丙烯酸酯的热响应共聚物[25]。当外界温度在LCST以下时,膨胀的聚合物阻塞了孔开口并减缓了药物分子的扩散;当温度在LCST之上时,聚合物层塌陷并打开孔,使包埋分子得到更快释放(见图1)。

图1 硅藻生物硅微胶囊功能化以及从热敏性聚合物接枝的生物硅胶壳中释放药物的方法Fig.1 Process of diatom biosilica microcapsule functionalization and drug release from thermo-responsive polymergrafted biosilica frustule
1.2 化学刺激响应型微胶囊
化学刺激响应型微胶囊主要是囊壁材料上含有的某些化学键被刺激,从而触发一系列化学反应,导致芯材的释放[26]。化学刺激响应型微胶囊主要分为2类[27]:1)pH刺激响应;2)二硫键的还原反应。
1.2.1 pH刺激响应 pH刺激响应型微胶囊主要是通过改变微胶囊内部或环境中的酸碱度来实现的,酸碱度的改变可以引起微胶囊壁材的共价键改变、离子键破坏或者氢键断裂,改变壁材的结构或性质,导致芯材物质的释放。目前pH刺激响应型微胶囊主要由聚电解质制备而成,这是因为聚电解质在不同的酸碱度下,构象发生变化,从而来控制释放,主要分为2类[28]:1)微胶囊壁材直接为聚电解质;2)将聚电解质接枝或者吸附在微胶囊的表面或孔内。
Sun将多巴胺改性的聚丙烯酸和聚乙烯基吡咯烷酮通过层层组装交替沉积到聚多巴胺上,来制造复合胶囊[29]。随着环境pH的变化,复合胶囊中的氢键将解离或重建,表现出pH响应性溶胀-收缩行为。当pH改变时,复合胶囊显示染料罗丹明的受控装载和释放,见图2。

图2 复合胶囊pH响应控制释放Fig.2 Schematic diagram of pH response controlled release of complex capsules
Werner以甲基丙烯酸酐和乙二醇二甲基丙烯酸酯制备微胶囊[30]。水凝胶微胶囊表现出溶胀和渗透性,取决于微胶囊壳的交联密度和pH。在酸酐水解后,微胶囊壳由交联的聚甲基丙烯酸水凝胶组成,改变其周围的酸碱度,微胶囊的渗透性和尺寸可以在多个周期内动态调节。
莫师利用纳米ZnO将Ce3+包裹在纳米SiO2中制备自修复微胶囊。微胶囊具有较好的装载能力,当微胶囊处于酸性或碱性环境中,纳米ZnO溶解,释放出芯材物质[31]。微胶囊设计原理图见图3。
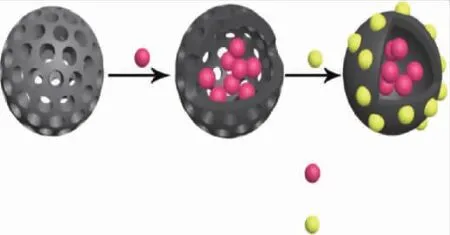
图3 二氧化硅纳米微胶囊设计原理图Fig.3 Scheme of the design of SiO2 nanocapsules
1.2.2 二硫键的还原反应 二硫键是2个巯基被氧化而形成—S—S—形式的硫原子间的键,又称S—S键,其具有可逆的氧化还原性,在空气中巯基可以氧化成二硫键,在还原剂存在下又可以还原成巯基[32]。
Yang通过层层组合(LBL)技术和辣根过氧化物酶(HRP)介导的氧化交联反应制备由硫醇化壳聚糖(CS-SH)和透明质酸(HA-SH)组成的二硫化物交联的中空聚电解质微胶囊[33]。二硫键在生理条件下赋予微胶囊增强的物理稳定性和低渗透性,并且具有氧化还原响应性降解特性,见图4。

图4 通过层层组合(LBL)技术制备具有氧化还原响应性的微胶囊Fig.4 Schematic diagram of microcapsules with redox responsiveness prepared by Layer-by-Layer(LBL)combination technology
Xu通过声化学方法,从硫醇化淀粉中成功设计并制备了还原响应磁性微胶囊[34]。由于谷胱甘肽(GSH)可以通过氧化还原反应裂解二硫键,因此选择它作为还原剂来验证微胶囊的还原响应性。在没有GSH的情况下,微胶囊释放速率很慢,然而在GSH存在下,释放速率明显加快。由于壳上交联的二硫键对还原剂的响应,所获得的微胶囊对疏水性药物表现出优异的还原响应控制释放能力。
1.3 生物刺激响应型微胶囊
生物刺激响应型微胶囊主要利用生物分子(如:酶、DNA、糖等)之间的相互作用来实现囊芯物质的控制释放。生物刺激响应型微胶囊的刺激释放分为2类:1)囊壁材料被生物分子降解从而导致芯材物质的释放;2)囊壁材料被生物生命活动产生的刺激破坏,引起芯材物质的释放。
Ravanfar设计了一种天然而简单的核壳结构微胶囊,只有在暴露于脂肪酶时才能释放囊芯物质[35]。微胶囊壳含有脂质层(由蜂蜡、棕榈酸和卵磷脂组成)和聚合物层(由酪蛋白和泊洛沙姆338制成)。脂质层含有酯键,可被脂肪酶分解。通过使用具有不同数量的酯键和不同烃链长度的脂质来设计脂质层,以控制它们在不同生物系统中对脂肪酶的可用性(见图5)。

图5 酶刺激触发的微胶囊示意图及其通过脂肪酶的控制释放Fig.5 Schematic of the enzymatically triggered microcapsules and their controlled release by lipase
Yang通过接头ssDNA L交联的DNA链的LBL自组装构建了一个DNA微胶囊。利用靶向miRNA 155诱导的DSN信号放大,获得了大量的模拟靶ssDNA D[36]。由于DNA胶囊上ssDNA D和接头ssDNA L完全互补,DNA微胶囊被破坏并释放甲苯胺蓝,从而可以实现DNA胶囊的简单组装和微量miRNA的快速反应。
Zhang通过简单的微流体乳液模板方法成功制备了在生理条件下具有良好单分散性和重复葡萄糖响应性的水凝胶基中空微胶囊[37]。使用罗丹明B和FITC-胰岛素分别作为模型分子和模型药物来证明葡萄糖响应性控制释放功能。将葡萄糖质量浓度从0.4 g/L增加到3.0 g/L,微胶囊经历葡萄糖诱导的溶胀体积变化,导致释放速率加快。
1.4 光刺激响应型微胶囊
目前,光响应型微胶囊的刺激源主要有2种,一种是将含有光活性的光敏基团引入到微胶囊壁材当中,如硝基苯类、香豆素类、喹啉类、吲哚衍生物类[38]。当光敏基团受到相应的光照刺激后,可引发光异构化、光聚合、光分解等反应,从而改变囊壁材料中的聚合物结构,导致芯材物质的释放。
Wang将磁性介孔二氧化硅纳米复合材料与光响应性偶氮苯衍生物共价接枝,制备光响应型微胶囊[39]。微胶囊暴露于450 nm的光驱动时,由于偶氮苯的光异构化性能,能够有效释放芯材,并且能够随意“开-关”,远程控制芯材分子的释放,见图6。

图6 微胶囊的制备与控释Fig.6 Preparation and controlled release of microcapsules
Li使用4-溴甲基-3-硝基苯甲酸(BNBA)作为交联剂,制备光响应型聚乙烯亚胺(PEI)微胶囊,如图7所示[40]。以CaCO3颗粒为牺牲模板,除去后得到PEI-BNBA光响应型胶囊。由于通过苄基溴和胺反应形成的C—N键是可光裂解的,在365 nm的紫外线照射下微胶囊可以分解,其溶胀可以使罗丹明B异硫氰酸酯(RBITC)标记的葡聚糖更快释放。
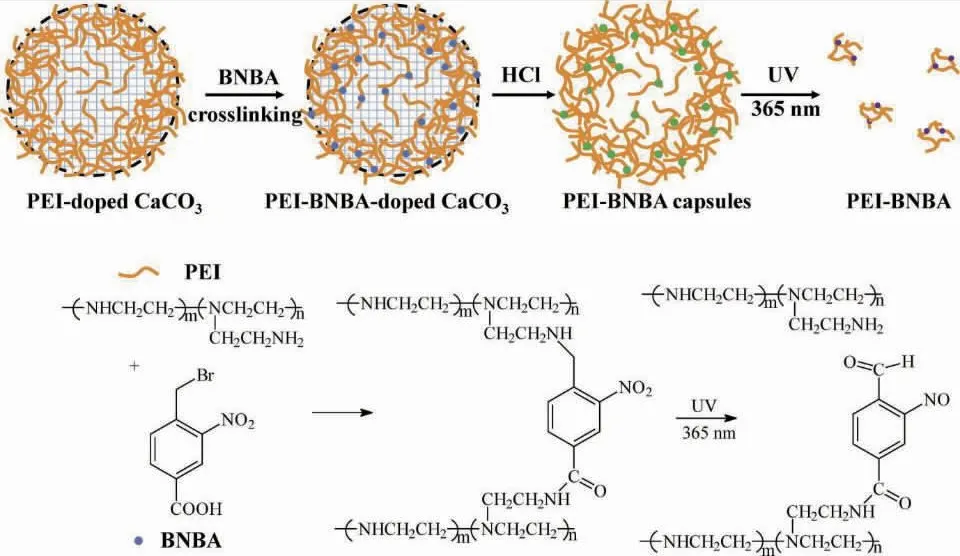
图7 PEI-BNBA胶囊的制备和分解过程Fig.7 Fabrication and decomposition process of PEI-BNBA capsules
Lee用乳化、盐析、光交联、蒸发、透析等工艺制备光响应型空心胶囊[41],见图8。环氧丙氧基香豆素(EPC)与聚乙烯醇(PVA)反应,合成了一种 乳化剂PVA-EPC,在365 nm和254 nm的循环照射下观察到PVA-EPC缀合物的EPC的循环光二聚和去二聚化。以氯仿为油相,PVA-EPC为乳化剂,利用香豆素的光聚合性质制备微胶囊,利用香豆素光分解的性能实现微胶囊的控制释放。

图8 通过乳化、盐析、光交联、蒸发和透析制备PVA-EPC微胶囊Fig.8 Schematic representation of PVA-EPC hollow microcapsules prepared by emulsification,salting out,photo-cross-linking,evaporation and dialysis
另一种是将金属及金属氧化物引入微胶囊壁材,当贵金属纳米粒子(如银纳米粒子或金纳米粒子)受到光照时,将光能转化成热能,微胶囊壁材随着温度的升高而破裂,从而释放芯材物质[42]。
Kim通过原位水解然后交联反应来制备聚乙烯胺(PVAm)水凝胶胶囊,将金纳米颗粒装配到水凝胶胶囊的囊壁材料中。在没有激光照射的情况下,中空复合胶囊保持其原始形状;在暴露于弱照射(50 mJ/cm2)之后,仍然可以识别单个胶囊的轮廓,但是它们的大部分表面略微降解;然而,进一步暴露于更强的照射(高于100 mJ/cm2)会完全破坏壳相,并且不再能区分出单个胶囊[43]。
1.5 磁刺激响应型微胶囊
磁刺激响应型微胶囊可以实现微胶囊的靶向传输以及芯材的可控释放,主要通过将磁性粒子引入微胶囊壁材[44]或者内部[45]来实现。目前,磁刺激响应型微胶囊主要有2种:1)微胶囊中的磁性颗粒在交变磁场的作用下快速运动,微胶囊壁材在机械力的作用下被破坏,导致芯材的可控释放;2)由于磁性颗粒在交变磁场下的磁热效应,导致微胶囊的温敏型壁材改变,实现控释功能。
Luo使用层层组装的磁性微胶囊递送多西环素,并施加具有低频(50 Hz)的交变磁场(LF-AMF)。低频交变磁场对微胶囊的形态几乎没有影响,暴露360 min后没有造成明显损伤,且大大增强了微胶囊的渗透性,与LF-AMF暴露的持续时间成正比。由LF-AMF诱导的渗透性提高归因于聚合物壳内Fe3O4纳米颗粒的搅拌。纳米颗粒在LF-AMF中扭曲和振动,导致聚电解质多层的变形[46],见图9。

图9 用于多西环素递送和LF-AMF触发释放的磁性微胶囊的设计示意图Fig.9 Design of magnetic microcapsules for doxycycline delivery and LF-AMF triggered release
1.6 超声波刺激响应型微胶囊
超声波具有方向性好、穿透能力强、易获得较集中的声能等特点,其频率高于20 000 Hz,由于超声波引起的拉伸振动可以导致微胶囊的破裂,所以可通过超声响应的方式释放微胶囊包封的芯材物质。
Huang将双氯芬酸钠(DS)封装到PEG-PLGA(聚乙二醇-嵌段-聚(乳酸-共-羟基乙酸))微胶囊中以获得超声响应的DS负载微胶囊(DS@PEGPLGA),将DS@PEG-PLGA微胶囊分散在PBS(pH 7.4)中,通过胺和N-羟基琥珀酰亚胺之间的酰胺化反应形成(DS@PEG-PLGA)@PEG水凝胶贴剂。在37℃下进行释放实验,在持续超声下,8 min时DS的累积释放量达到约90%,同时在没有超声的情况下,仅释放不到20%的DS。其显示出了良好的生物相容性和显著的皮肤粘附性,以及超声响应方式下,包封药物释放量的提高[47](见图10)。
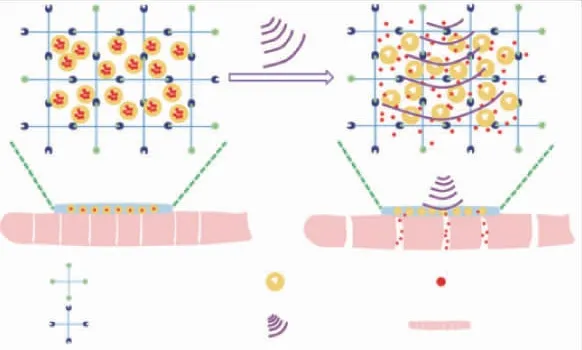
图10 PEG水凝胶贴剂超声响应释放DSFig.10 Schematic illustration of ultrasound responsive transdermal release of DS from(DS@PEGPLGA)@PEG hydrogel patch
1.7 机械刺激响应型微胶囊
机械刺激是触发芯材从微胶囊中释放的物理方式之一。通过常规方法由聚电解质多层制成的中空微胶囊不具有足够的弹性以响应大的和重复的机械变形,造成渗透压改变,从而释放出芯材。
有研究者[48]通过层层组装的方法,用交替的壳聚糖和胶体二氧化硅纳米颗粒制备混合空心胶囊。在冷冻温度下将壳聚糖层与戊二醛交联以使共价键具有柔性和弹性。使用毛细管弹性实验和渗透压引发的破裂实验研究胶囊的机械性质,混合空心胶囊具有足够的弹性,能够承受重复的和大的机械变形,并且在压缩释放后立即恢复到原始形状,通过施加压力引起的可逆变形可以有效调节药物的释放。
Vian将全氟化聚合物具有化学惰性的优点与由双层乳液和薄壳制成的胶囊的小占地面积结合起来,制造的胶囊具有均匀的氟化壳,可以承受高达1.3 MPa的压力而不会发生弯曲。当暴露于较高压力或干燥时,它们会弯曲但保持完整,对低相对分子质量包封剂的渗透性保持不变。然而,当受到机械应力时会发生破裂,从而释放出包封剂[49]。
2 多刺激响应型微胶囊
多刺激响应型微胶囊顾名思义就是将2个或2个以上的刺激响应源结合到1个微胶囊当中,使其具有多个刺激响应的功能。
Paret将2-氧代乙酸酯包封到聚(脲-氨基甲酸酯)核/壳微胶囊中,实现光诱导的挥发性化合物的控制释放。在暴露于紫外光时,2-氧代乙酸盐分解形成羰基化合物和CO2或CO,可以在胶囊内部产生过压,该过压使胶囊壁膨胀或切开,以释放其内容物[50],见图11。(a)将光敏2-氧代乙酸酯香料与另一种香料分子共同包封并将系统暴露于低光强度,造成胶囊壁的机械破裂,从而将共价连接的香料从核/壳微胶囊内释放出来。(b)含有光敏2-氧代乙酸酯香料和另一种香料分子的核/壳微胶囊首先发生机械破裂,释放未结合的香料分子,后来暴露在光照下,释放出共价连接的香料。在这种情况下,两种香料不会同时释放。

图11 光诱导和机械触发从核/壳微胶囊释放香料Fig.11 Light-induced controlled release of fragrances from core/shell microcapsules
Leal通过原位聚合方法合成含有亚麻籽油的微胶囊,并使用逐层技术将苯并三唑包埋于组装在微胶囊外部的聚电解质层之间[51],见图12。该系统具有2种刺激响应机制:机械刺激(亚麻籽油的释放)和pH刺激(苯并三唑的控制释放),可以分别提供自我修复能力和抑制电化学腐蚀反应。
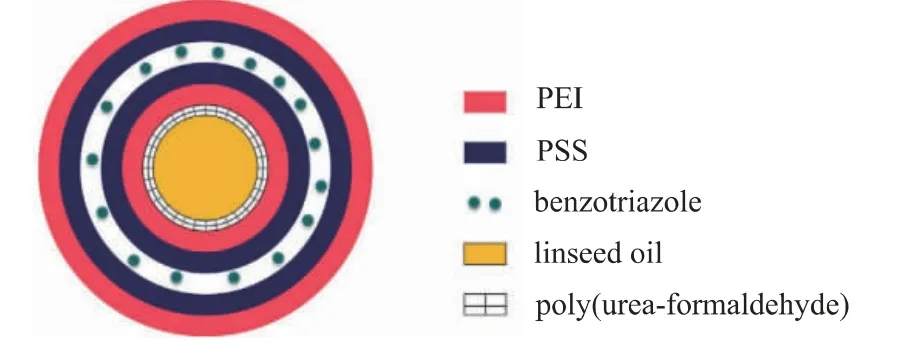
图12 机械和pH多刺激响应型微胶囊的结构Fig.12 Schematic representation of the expected final structure of the multiple-stimulus response microcapsules
Xu使用聚合物囊泡作为主要组分成功制备了响应型多室微胶囊,其具备pH和离子强度双响应特性[52],见图13。制备的微胶囊具有双载体能力:一种类型的分子可以包封在聚合物囊泡内,另一种分子可以包封在微胶囊的中空内部。更重要的是,因为具有聚电解质复合物壁的聚合物囊泡的结构可以通过离子强度的变化来调节,同时单宁酸和聚合物囊泡之间的氢键结合受pH条件的影响,因此,pH和离子强度的组合可用于实现2种类型非常不同的货物分子(阴离子和阳离子)的顺序和可编程释放,而不损害微胶囊的整体形态。

图13 pH和离子强度双响应型多室微胶囊Fig.13 Schematic diagram of pH and ionic strength dual-response multi-chamber microcapsules
Li在固体模板上通过逐层组装方法成功制造了基于主客体相互作用的双响应胶体MC。二茂铁改性的聚乙烯亚胺(PEI-Fc)和环糊精改性的聚苯乙烯纳米粒子(PS-CD NPs)作为组装构件,可以在添加竞争性金刚烷(Ad)分子时或在pH低于4的溶液中将胶体MC分解成纳米组分[53],见图14。

图14 基于主客体的胶体MC的制造和拆卸过程Fig.14 Schematic illustration of the fabrication and disassembly process of host-guest based colloidal MC
胡振兴通过细乳液聚合制备了温度/pH双重响应型纳米微胶囊。其中温敏单体为N-异丙基丙烯酰胺(NIPAM),pH敏感单体为丙烯酸(AA),制备的纳米微胶囊具有良好的温度响应性和pH敏感性,LCST为40~50℃;单体AA的引入提高了纳米微胶囊对pH的敏感性[54]。
Wang通过蒸馏沉淀聚合和通过氢氟酸蚀刻选择性除去二氧化硅模板获得聚(丙烯酸)/偶氮苯微胶囊。在紫外线照射下,主链中的偶氮苯交联位点从反式转化为顺式异构体,从而诱导微胶囊收缩,调整了胶囊的渗透性。此外,微胶囊具有pH响应性,芯材物质的扩散速率和最终释放百分比均随pH增加而增加。不同辐照模式和pH下的释放行为与Baker-Lonsdale模型非常一致,显示了扩散控制释放行为[55],见图15。

图15 不同模式下微胶囊包封和释放行为Fig.15 Schematic illustration of encapsulation and release of microcapsules under different modes
徐斌斌通过原位共沉淀法制备了磁场/温度双重响应型纳米微胶囊。N-异丙基丙烯酰胺和Fe3O4磁性纳米粒子的引入,使纳米微胶囊具有良好的温度响应性和磁响应性,其饱和磁化强度约为1.7 emu/g,LCST为40~50℃[56]。
3 展望
刺激响应型微胶囊按其本身对不同环境刺激的响应数量,分为单刺激响应型微胶囊和多刺激响应型微胶囊,作者对不同类型的刺激响应型微胶囊进行了归纳介绍。目前刺激响应型微胶囊多用于医药、纺织、自修复防腐材料等领域,在化工、化妆品和农药等领域也得到更多关注,而在包装领域相关报道较少。药物领域主要涉及热响应、还原响应、光响应、pH响应及多响应等,从而实现定向爆破式释放药物、“按需”释放药物、实时远程控制释放等功能。未来刺激响应型微胶囊的发展趋势将是刺激方式更加灵敏,对刺激机制的研究更加成熟,生产规模化且成本更低,对环境友好且其应用领域更加广泛等。
