头孢他啶阿维巴坦治疗严重革兰阴性菌感染疗效与安全性的系统评价Δ
2021-07-29张翔云焦伟杰郭艳青
张翔云,赵 旭,焦伟杰,郭艳青,杜 蕾
(1.河南省中医院药学部,河南 郑州 450003; 2.河南省中医院重症医学科,河南 郑州 450003)
全球范围内细菌耐药率呈急速升高趋势,尤其是多重耐药的肠杆菌、铜绿假单胞菌及鲍曼不动杆菌等革兰阴性菌。目前,碳青霉烯类抗菌药物依然是严重革兰阴性菌感染的一线推荐方案[1]。然而,随着碳青霉烯类抗菌药物的广泛应用,耐碳青霉烯类肠杆菌科细菌(carbapenem resistantenterobacteriaceae,CRE)的检出率逐年升高。根据中国细菌耐药监测网监测结果,肺炎克雷伯菌对碳青霉烯类抗菌药物的平均耐药率从2005年的<3.0%飙升至2018年的10.1%,尤其是河南省达到了32.5%[2-3]。当前可用于治疗CRE感染的抗菌药物极为有限,研究结果显示,CRE感染的临床死亡率为38%~63%[4]。因此,为应对细菌耐药尤其是对碳青霉烯类抗菌药物耐药的威胁,临床亟需创新型的抗菌药物。阿维巴坦是一种长效、广谱的新型β-内酰胺酶抑制剂,可抑制A、C和某些D类β-内酰胺酶,包括超广谱β-内酰胺酶(extended spectrumβlactamase,ESBL)和肺炎克雷伯菌产生的碳青霉烯酶,满足了抗严重革兰阴性菌感染的需求[5]。2015年2月,头孢他啶阿维巴坦获得美国食品药品监督管理局批准上市,用于成人无其他治疗选择的感染,包括复杂性腹腔内感染(complex intra-abdominal infection,cIAI)、复杂性尿路感染(complex urinary tract infection,cUTI)和医院获得性肺炎/呼吸机相关性肺炎(hospital acquired pneumonia/ventilator-associated pneumonia,HAP/VAP)。已有的系统评价结果表明,头孢他啶阿维巴坦具有良好的药理作用,可能是一种用于严重革兰阴性菌感染的经验选择,但其纳入的文献或为观察性研究,或为病案报道,或样本量较小,或考察对象为新型β-内酰胺类抗菌药物/β-内酰胺酶抑制剂复方制剂[6-11]。本研究将基于荟萃分析(Meta分析)方法,增加样本量,纳入更多高质量的随机对照试验(randomized controlled trial,RCT),扩大适应症(cUTI、cIAI和HAP)和适用人群(成人和儿童),全面考察头孢他啶阿维巴坦的疗效与安全性,以期为临床提供合理的用药建议。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型:国内外已公开发表的关于头孢他啶阿维巴坦治疗严重革兰阴性菌感染的RCT。
1.1.2 研究对象:根据目前公认的诊断依据,确诊为cUTI、cIAI和HAP等常见严重革兰阴性菌感染者;年龄、性别及种族等无限制。
1.1.3 干预措施:研究组患者采用头孢他啶阿维巴坦治疗,cIAI患者可联合应用甲硝唑;对照组患者采用常规治疗,如美罗培南/亚胺培南西司他丁/头孢吡肟/多尼培南/粘菌素/替加环素等;两组患者剂量、疗程不限。
1.1.4 结局指标:(1)临床治愈率;(2)微生物根除率;(3)不良事件(adverse events,AE)发生率;(4)严重不良事件(serious adverse events,SAE)发生率;(5)死亡率。
1.1.5 排除标准:(1)无结局指标、数据错误及不完整的研究;(2)临床试验的摘要报道;(3)重复研究;(4)体外抗菌研究、动物实验、药动学研究、药理学研究、综述及回顾性分析等非RCT研究。
1.2 文献检索策略
以“头孢他啶阿维巴坦”“感染”和“随机”等为中文检索词,以“ceftazidime avibactam”“infections”和“random”等为英文检索词,采用题目、摘要、关键词和全文结合的方法,检索中国知网、万方数据库、维普数据库、PubMed、the Cochrane Library、EMBase和ClinicalTrials.gov数据库;检索时限为建库至2020年6月。
1.3 文献筛选与资料提取
由2名评价者独立阅读文题和摘要,排除重复、不相关、药动学实验及体外抑菌实验等文献后,进一步阅读全文,确定纳入文献。如有分歧,由第3位研究者介入讨论解决分歧。制定数据提取表格,进行数据提取。提取的资料包括:(1)基本情况,如第一作者、发表年份、研究编号、样本量、干预措施、感染类型、联合用药、疗程及微生物种类等;(2)结局指标相关数据,临床治愈率及微生物根除率优先使用改良意向治疗(modified intention-to-treat,MITT)人群在治疗试验结束(test of cure,TOC)时的数据,若无上述数据,则采用文献报道的其他数据替代,AE发生率、SAE发生率及死亡率采用安全性分析人群数据;(3)纳入研究质量信息,包括随机方法、分配隐藏、盲法、数据完整性及偏倚等。
1.4 方法学质量评价
采用改良Jadad量表[12]对纳入的文献进行质量评价,主要对随机序列的产生、随机化隐藏、盲法、退出与失访情况进行评分。1~3分属于低质量研究,4~7分属于高质量研究。
1.5 统计学方法
采用Review Manager 5.3软件进行Meta分析。以相对危险度(RR)及95%置信区间(CI)为合并效应量指标。对纳入研究进行异质性检验,若不存在异质性或者异质性较小(P>0.10,I2≤50%),采用固定效应模型计算合并效应量。若异质性较大(P≤0.10,I2>50%),首先以敏感性分析方法,依次剔除1项研究,将剩余研究重新进行Meta分析,探寻对合并效应量影响较大的研究;如果敏感性分析后,总合并效应量的结果稳定,则进行亚组分析,探索异质性来源;如果经过处理后异质性仍无法消除,则采用随机效应模型进行Meta分析。采用漏斗图及Egger’s检验法评估纳入研究的发表偏倚。
2 结果
2.1 文献筛选流程与结果
初检得到相关文献2 175篇,除去重复文献990篇,阅读文献标题及摘要后排除文献1 152篇;对剩余的33篇文献进一步阅读全文,排除体外抑菌实验、综述、Meta分析及药动学研究等23篇文献,最终纳入10篇文献,见图1。
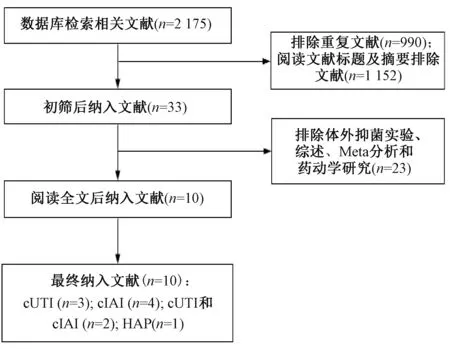
图1 文献筛选流程与结果Fig 1 Literature screening process and results
2.2 纳入文献的基本特征及质量评价
最终纳入10篇文献[13-22],共4 294例患者。其中,3项研究[13,17,22]关注cUTI,4项研究[14,18-20]关注cIAI,2项研究[15-16]关注cUTI和cIAI,1项研究[21]关注HAP。所有纳入研究的改良Jadad量表评估结果显示,9项研究[13-21]随机方法明确,为计算机产生随机序列;9项研究[13-21]实现了分配隐藏;8项研究[13-15,17-21]为双盲研究,1项研究[16]为开放标签研究,1项研究[22]为单盲研究;10项研究[13-22]均详细记录了退出与失访情况;所有纳入研究的改良Jadad量表评分均>4分,为高质量RCT。纳入文献的基本特征及质量评价见表1。

表1 纳入文献的基本特征及质量评价Tab 1 General characteristics and quality evaluation of included literature
2.3 Meta分析结果
2.3.1 临床治愈率:9项研究[13-14,16-22]比较了研究组、对照组患者的临床治愈率,共3 451例患者。各研究之间无异质性(P=0.78,I2=0%),采用固定效应模型进行Meta分析。结果显示,两组患者的临床治愈率比较,差异无统计学意义(RR=0.99,95%CI=0.96~1.02,P=0.36),见图2。

图2 两组患者临床治愈率比较的Meta分析森林图Fig 2 Meta-analysis of comparison of clinical cure rate between two groups
2.3.2 微生物根除率:7项研究[13-17,21-22]比较了研究组、对照组患者的微生物根除率,共1 864例患者。各研究之间有异质性(P=0.007,I2=66%),采用随机效应模型进行Meta分析。结果显示,两组患者的微生物根除率比较,差异无统计学意义(RR=1.06,95%CI=0.96~1.17,P=0.26),见图3。

图3 两组患者微生物根除率比较的Meta分析森林图Fig 3 Meta-analysis of comparison of microbial eradication rate between two groups
2.3.3 AE发生率:8项研究[13-14,16-19,21-22]比较了研究组、对照组患者的AE发生率,共4 083例患者。各研究之间无异质性(P=0.32,I2=14%),采用固定效应模型进行Meta分析。结果显示,两组患者的SE发生率比较,差异无统计学意义(RR=1.03,95%CI=0.97~1.10,P=0.31),见图4(A)。
2.3.4 SAE发生率:8项研究[13-14,16-19,21-22]比较了研究组、对照组患者的SAE发生率,共4 083例患者。各研究之间无异质性(P=0.55,I2=0%),采用固定效应模型进行Meta分析。结果显示,两组患者的SAE发生率比较,差异无统计学意义(RR=1.21,95%CI=0.98~1.49,P=0.08),见图4(B)。
2.3.5 死亡率:5项研究[14,16,18-19,21]比较了研究组、对照组患者的SAE发生率,共2 833例患者。各研究之间无异质性(P=0.92,I2=0%),采用固定效应模型进行Meta分析。结果显示,两组患者的死亡率比较,差异无统计学意义(RR=1.31,95%CI=0.90~1.91,P=0.16),见图4(C)。
2.3.6 敏感性分析:依次剔除1项研究,将剩余研究重新进行Meta分析,结果显示,除微生物根除率外,其余指标合并效应值稳定。微生物根除率指标中,所纳入研究之间的异质性较大(P=0.007,I2=66%),进行敏感性分析后发现,文献[16]对合并效应值影响较大,剔除该文献后,其余各研究间无异质性(P=0.12,I2=43%),故采用固定效应模型进行Meta分析,结果(RR=1.02,95%CI=0.94~1.11,P=0.69)与随机效应模型(RR=1.06,95%CI=0.96~1.17,P=0.26)一致。
2.3.7 亚组分析:依据感染类型、病原体种类、肾功能状态、急性生理与慢性健康评分(acute physiology and chronic health evaluation,APACHE Ⅱ)进行亚组分析,结果见表2。由表2可见,各亚组中,头孢他啶阿维巴坦与常规治疗的临床治愈率比较,差异均无统计学意义(P>0.05);复杂尿路感染亚组中,头孢他啶阿维巴坦的微生物根除率明显优于常规治疗(RR=1.14,95%CI=1.06~1.22,P<0.01);肠杆菌亚组中,头孢他啶阿维巴坦的微生物根除率明显高于常规治疗(RR=1.11,95%CI=1.02~1.20,P=0.01),尤其是对大肠埃希菌(RR=1.12,95%CI=1.04~1.20,P<0.01)及肺炎克雷伯菌(RR=1.20,95%CI=1.03~1.39,P=0.02)的根除;其余亚组中,头孢他啶阿维巴坦与常规治疗的微生物根除率比较,差异均无统计学意义(P>0.05)。
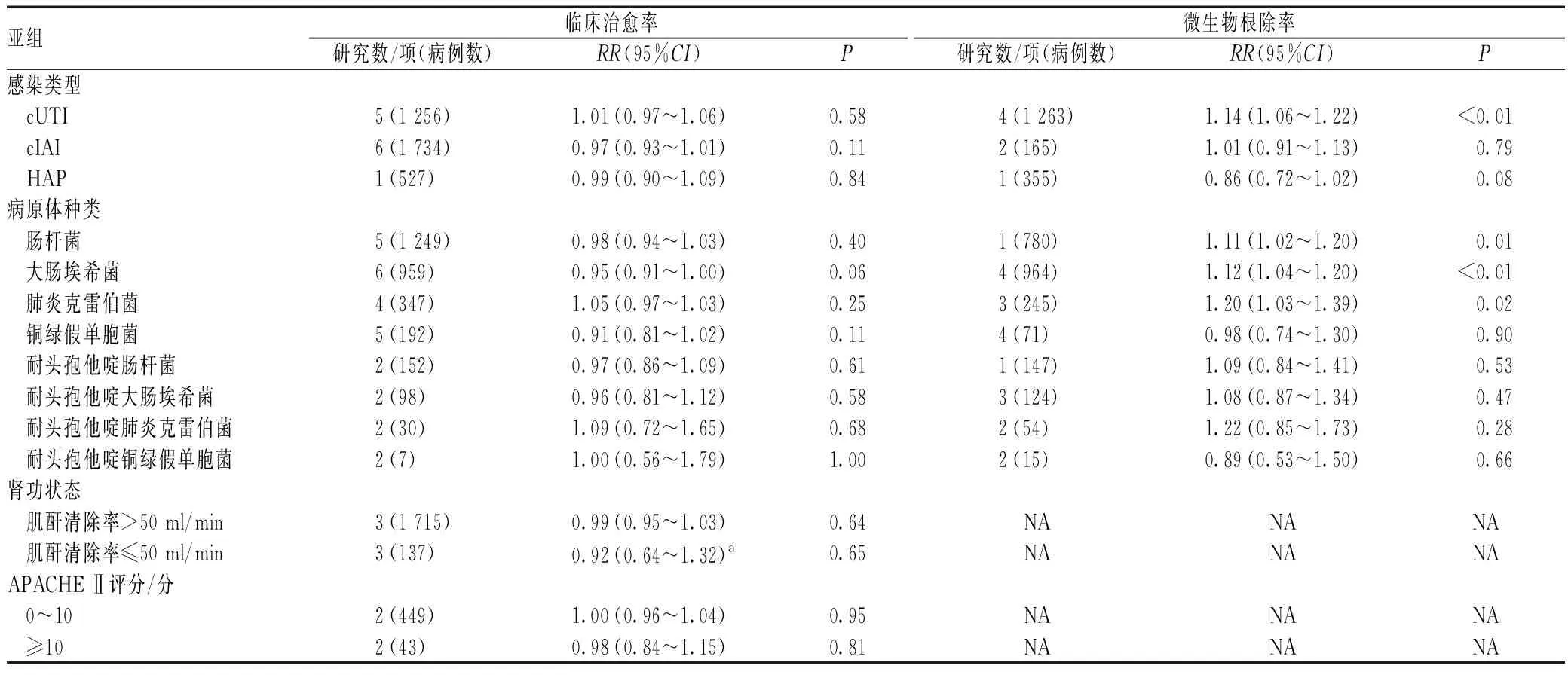
表2 头孢他啶阿维巴坦与常规治疗比较的亚组分析结果Tab 2 Subgroup analysis of comparison of ceftazidime and avibactam and conventional treatment
2.3.8 发表偏倚:对各指标进行漏斗图检验及Egger’s检验,结果显示,在临床治愈率(PEgger=0.558)、微生物根除率(PEgger=0.770)、不良反应发生率(PEgger=0.753)、严重不良反应发生率(PEgger=0.988)及死亡率(PEgger=0.637)指标中,所纳入研究的漏斗图对称,Egger’s检验,P均>0.05,无发表偏倚。
3 讨论
随着抗菌药物长期、大量的使用,细菌耐药性逐渐增强,给临床抗感染治疗带来了难题。阿维巴坦作为新型、广谱的β-内酰胺酶抑制剂,与β-内酰胺酶丝氨酸残基共价结合,可重新环化恢复活性从而长效抑制A、C和某些D类β-内酰胺酶;其与头孢他啶联合应用,能够恢复或增强头孢他啶的抗菌活性,包括对产ESBL菌、CRE的活性,显示出治疗严重革兰阴性菌感染的潜能。本次Meta分析共纳入10项RCT,包含4 294例患者,经统计分析发现,相比常规治疗,头孢他啶阿维巴坦治疗严重革兰阴性菌感染具有非劣性,可作为临床抗感染难题的新选择。

A.AE发生率;B.SAE发生率;C.死亡率A.incidence of AE; B.incidence of SAE; C.mortality rate图4 两组患者AE发生率、SAE发生率及死亡率比较的Meta分析森林图Fig 4 Meta-analysis of comparison of incidence of AE, SAE and mortality rate between two groups
在有效性方面,本研究结果显示,头孢他啶阿维巴坦组患者的临床治愈率、微生物根除率与常规治疗组之间的差异均无统计学意义(P>0.05);依据感染类型、病原体种类、肾功能状态和APACHE Ⅱ评分进行亚组分析的结果显示,各亚组中,头孢他啶阿维巴坦组患者的临床治愈率与常规治疗组之间的差异均无统计学意义(P>0.05)。但本研究纳入的感染类型包括cUTI、cIAI和HAP 3种,并未纳入血流感染的患者。Zhong等[7]对2项(140例患者)关于血流感染的回顾性研究进行了系统分析,认为头孢他啶阿维巴坦可改善血流感染患者的临床治愈率(RR=2.11,95%CI=0.1.54~2.88);Caston等[23]纳入31例血液病患者进行回顾分析,认为在14 d的治疗中,头孢他啶阿维巴坦对产碳青霉烯酶肠杆菌的临床治愈率比对照组更高(85.7% vs.34.8%);Tumbarello等[24]对104例产碳青霉烯类酶肺炎克雷伯菌血流感染患者一线治疗无效后使用头孢他啶阿维巴坦进行挽救治疗进行了回顾性分析,发现其感染30 d的死亡率明显低于非头孢他啶阿维巴坦治疗者(36.5% vs.55.7%),使用头孢他啶阿维巴坦是生存的唯一独立预测因子。上述结论均可作为本研究结果适用性的补充,但由于其非RCT,故未纳入本研究。另外,针对肾功不全患者,Mazuski等[18]的研究结果与本研究结果不同,其认为对于肾功能中度受损患者,头孢他啶阿维巴坦的临床治愈率劣于美罗培南,究其原因,可能是肾功能受损患者的用药剂量减少了1/3,而其肾功能在治疗的48~72 h又迅速得到改善,进而导致头孢他啶阿维巴坦清除过快而疗效降低。但本研究对包括Mazuski等[18]研究在内的3项研究[18-19,21]进行定量分析,认为不管患者肾功能状态如何,头孢他啶阿维巴坦的疗效都与常规治疗相当。在微生物根除率方面,本研究结果显示,cUTI亚组中,头孢他啶阿维巴坦略优于常规治疗;肠杆菌亚组中,头孢他啶阿维巴坦的微生物根除率高于对照组,尤其是对大肠埃希菌及肺炎克雷伯菌;其余亚组中,两组方案微生物根除率的差异无统计学意义(P>0.05)。头孢他啶阿维巴坦大部分(80~90%)以原型药经肾脏排泄,导致尿路中药物浓度较高,因此,理论上头孢他啶阿维巴坦更适合cUTI患者,本研究中,头孢他啶阿维巴坦在cUTI亚组中的微生物根除率优于cIAI及HAP亚组,也进一步验证了上述结论。另外,在体外抑菌实验中,99.5%的肠杆菌对头孢他啶阿维巴坦敏感,且头孢他啶阿维巴坦对大肠杆菌及肺炎克雷伯菌中同时产ESBL、AmpCβ-内酰胺酶菌株的敏感率高达100%[25]。本研究可进一步佐证其体外敏感性与体内抗菌活性的一致性。目前国内外专家推荐头孢他啶阿维巴坦为严重革兰阴性菌感染的常用治疗药物[26-27],本研究结果可为这一论断提供进一步的循证依据,尤其是针对肠杆菌如大肠埃希菌、肺炎克雷伯菌引起的cUTI。
在安全性方面,本研究结果显示,头孢他啶阿维巴坦的AE发生率、SAE发生率和死亡率与常规治疗相近。其中,头孢他啶阿维巴坦相关的AE主要有腹泻、腹痛、恶心、呕吐、咳嗽、头痛、头晕、焦虑、胸痛、注射/输注部位反应、丙氨酸转氨酶水平升高、天冬氨酸转氨酶水平升高、血肌酐水平升高以及外阴、阴道真菌感染等;头孢他啶阿维巴坦相关的SAE主要有急性肾衰竭、严重伪膜性肠炎、癫痫、昏迷以及肌阵挛等。由于头孢他啶阿维巴坦主要经肾脏排泄,肾功能损伤直接影响头孢他啶阿维巴坦的清除,因此,对于肾功能损伤的患者,头孢他啶阿维巴坦的剂量需要随肾功能进行调整,否则AE、SAE甚至死亡的发生风险将显著升高[28]。
尽管本研究严格设定了纳入、排除标准,尽可能纳入全球多中心的RCT,定量分析的结果稳定可信,仍然存在一定局限性:(1)微生物根除率指标中,各研究间异质性较大(P=0.007,I2=66%),敏感性分析结果提示与文献[16]的研究结果有关,剔除该文献后异质性有所降低(P=0.12,I2=43%),但仍有部分残余异质性;(2)虽然临床治愈率、微生物根除率优先使用MITT人群在TOC时的数据,但未能对各数据进行详细的分层分析;(3)虽然根据病原菌种类进行了亚组分析,但由于数据有限,并未详细考察对CRE及各类耐药机制病原菌的疗效,需要进一步研究。综上所述,相比常规治疗,头孢他啶阿维巴坦治疗严重革兰阴性菌感染具有非劣性,但仍需大规模、多中心的RCT来验证。
