基于医院集中监测的红花注射液安全性相关分析
2021-07-29吴桂月焦伟杰侯瑞英
吴桂月,赵 旭,焦伟杰,杜 蕾,侯瑞英
(河南中医药大学第二附属医院药学部,郑州 450002)
红花注射液是由中药红花经水煮醇沉等工艺加工而成的中药注射剂[1],功能主治为活血化瘀,用于治疗闭塞性脑血管疾病、冠心病、脉管炎等[2]。随着临床应用日益广泛,红花注射液不良反应/事件(adverse drug reactions/events,ADR/ADE)的报道逐渐增多,安全性备受关注[3-4]。2013年2月,国家药品不良反应监测中心发布不良反应信息通报[5],提示警惕红花注射液的严重不良反应。2017年9月,原国家食品药品监督管理总局发布通告[6],责令涉事企业立即召回出现不良反应批次的红花注射液。药品不良反应医院集中监测是药品不良反应监测体系的一种重要方式,与不良反应自愿呈报模式相比,能更全面、准确地收集药品不良反应。本研究采用医院集中监测法监测红花注射液的ADE,并对ADE分布情况和危险因素进行分析,为其临床使用提供更多安全性证据。
1 资料与方法
1.1 资料来源
以2019年1月1日~2019年12月31日入院并使用红花注射液的住院患者为研究对象。
1.2 监测方法
采用回顾性医院集中监测法,通过医院信息系统(hospital information system,HIS)筛选出使用红花注射液的住院患者。红花注射液不良反应主要涉及皮肤及其附件损害、心血管系统损害、中枢及外周神经系统损害、呼吸系统损害等[5]。鉴于红花注射液不良反应呈现的多样性,通过以下2种途径监测病例。第一种途径:筛选出同时使用红花注射液和地塞米松、异丙嗪、马来酸氯苯那敏、氯雷他定及炉甘石等制剂的病例,筛选出发生过敏反应的病例。第二种途径:对没有使用上述药物的病例,参考红花注射液说明书推荐的使用疗程(10~15天为一个疗程,排除因手术、出院及转科中断治疗病例),筛选出因不良反应而使用未足疗程的病例。经上述2种方法筛选出的病例标记为“疑似病例”。
1.3 ADE监测与评价标准
对系统筛选出的“疑似病例”由2名临床药师分别审阅病例资料,发现有红花注射液ADE相关记录的病例,填写《红花注射液不良反应/事件报告表》,根据国家药品不良反应监测中心现行的6级标准(肯定、很可能、可能、可能无关、待评价、无法评价)进行评价[7]。肯定、很可能和可能的病例判定为ADE病例。
1.4 药品使用合理性评价标准
依据红花注射液说明书和《中成药临床应用指导原则》[8],评价其使用合理性。药品:红花注射液(山西华卫药业有限公司,国药准字Z14020007,规格20 ml/支)。功能主治:活血化瘀,用于治疗闭塞性脑血管疾病、冠心病、脉管炎。用法用量:静脉滴注,一次15 ml,用10%葡萄糖注射液250~500 ml稀释后使用,qd。
1.5 数据处理
采用SPSS 19.0软件处理数据。分类变量采用单因素卡方检验,连续变量采用t检验,分析各因素与ADE发生的相关性。P<0.05为有统计学差异。
2 结果
2.1 ADE监测情况
筛选使用红花注射液的病例共计2593例。其中,有81例(3.12%)ADE病例。第一种途径筛选出疑似病例280例,ADE病例24例,其中肯定1例、很可能15例、可能8例;第二种途径筛选出疑似病例384例,ADE病例57例,其中肯定0例、很可能36例、可能21例。
2.2 ADE分布情况和危险因素分析
81例ADE病例中,男性35例,女性46例;年龄14~104岁,平均年龄(53.8±16.18)岁,65岁及以上占66.7%;西医诊断与说明书不相符47例,中医诊断与说明书不相符7例;给药剂量>20 ml的ADE构成比为60.49%。
将性别、体重、诊断及用法用量进行单因素分析。结果显示,用法用量与ADE发生有显著相关性(P<0.01),其他因素与ADE发生无显著相关性(P>0.05)。见表1。
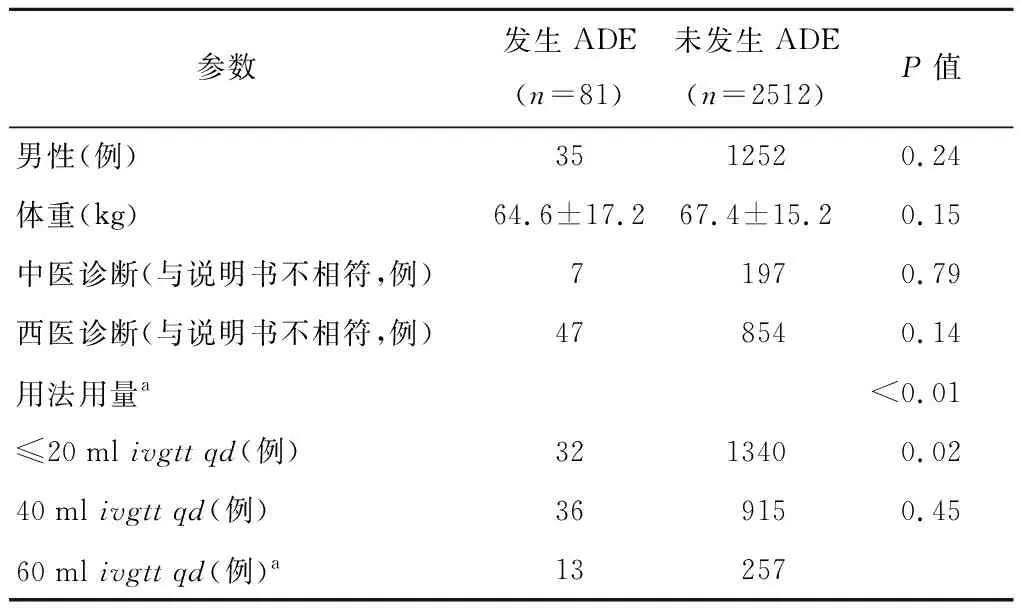
表1 ADE相关风险因素的单因素分析
2.3 ADE发生时间
81例ADE病例中,ADE发生时间距首次给药最早为10 min,最晚为7天。给药后1 h内发生ADE最多,占74.07%。见表2。

表2 ADE发生时间
2.4 ADE临床表现、处理与转归
81例ADE病例中,严重ADE 3例,新ADE 12例。第一种途径筛选出的24例均停药并给予药物对症处理;第二种途径筛选出的57例,18例给予药物对症处理,44例停药,13例未停药。3例严重ADE经对症处理后均好转。转归情况为好转9例,其余均为痊愈。ADE临床表现及构成比见表3。
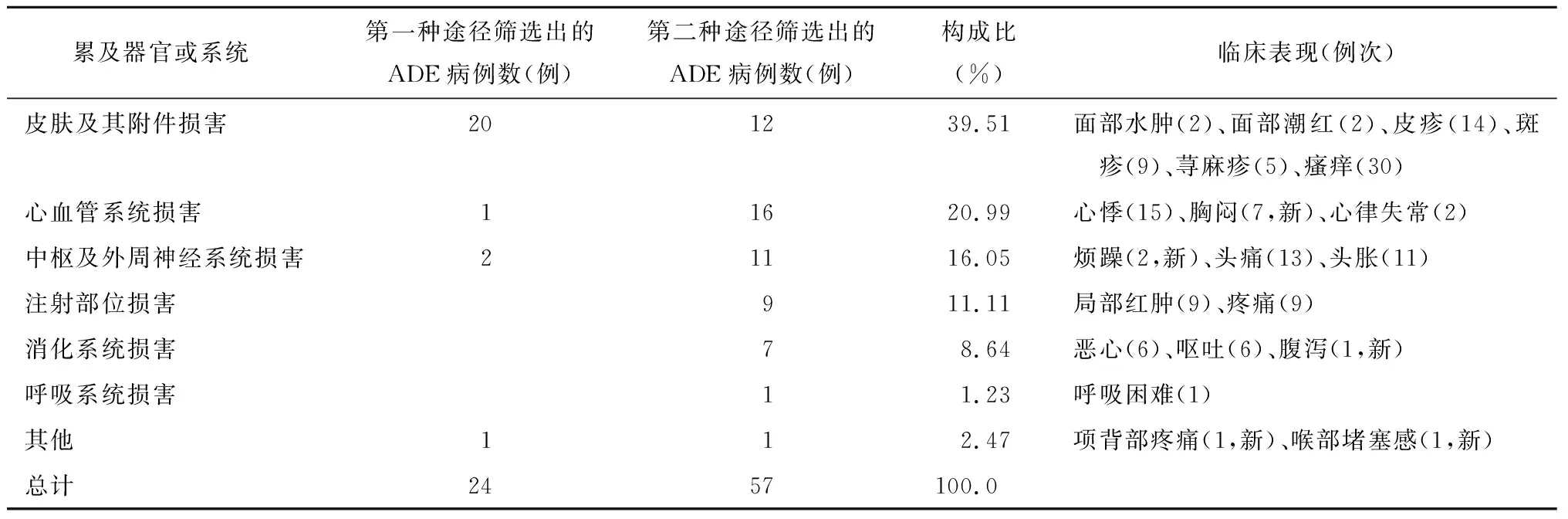
表3 ADE临床表现
2.5 溶媒和联合用药
81例ADE病例均为静脉滴注给药,溶媒5%葡萄糖注射液150~250 ml;与其他药物联合使用时,中间均用0.9%氯化钠注射液或5%葡萄糖注射液冲管。72例(88.89%)存在联合用药,其中联合使用一种药物最多(39例),联合用药的药物有薄芝糖肽注射液、复方骨肽注射液、喜炎平注射液、注射用盐酸丙帕他莫等。
3 讨论
2593例使用红花注射液的病例中有81例(3.12%)发生ADE,症状总体较轻,经停药或对症处理后均好转或痊愈。2种方法筛选出的ADE中,评价“肯定”的只有1例,评价“很可能”的有51例,占62.96%。这也使得本研究收集的ADE病例数高于不良反应自愿呈报模式收集的数量。
2012年,国家药品不良反应监测数据库中有关红花注射液的病例报告共计3306例,引起的严重病例中涉及超说明书规定剂量用药的占17.19%[5]。本院81例ADE病例中,给药剂量>20 ml的ADE构成比为60.49%。不同给药剂量组单因素卡方检验结果显示,给药剂量≤20 ml与给药剂量60 ml的ADE构成比有统计学差异(P=0.02),给药剂量40 ml与给药剂量60 ml比较无统计学差异(P>0.05),超剂量使用的患者更容易发生ADE。此次监测到的红花注射液的溶媒均为5%葡萄糖注射液,溶媒量150~250 ml,存在溶媒量不足。据文献报道[9],选择溶媒5%葡萄糖注射液250 ml,红花注射液40 ml时,配伍溶液不溶性微粒明显超出《中国药典》规定。不溶性微粒本身亦可引起ADE,应避免超说明书剂量用药。红花注射液是经水煮醇沉制成,成分复杂,药理作用更为复杂。老年人因肝肾功能减弱,药物的吸收、分布、代谢、排泄均发生相应改变[10],比年轻人更容易发生不良反应。《国家药品不良反应监测年度报告(2019年)》数据显示[11],2019年老年患者ADR/ADE报告中,65~69岁老年患者报告占32.9%,70~74岁老年患者报告占25.3%。本研究ADE监测数显示,81例患者平均年龄(53.8±16.18)岁,65岁及以上占66.7%,与监测数据年龄分布的总体趋势一致。
首次给药后1 h内发生ADE的构成比最高(74.07%),给药后1~24 h内发生ADE仅4例(4.94%),与刘嘉莹等[12]报道的ADE发生时间的构成比不一致。可能原因是:刘嘉莹等[12]研究的是从中国生物医学文献服务系统(CBM)、中国知网(CNKI)以及中国医院知识总库(CHKD)等中文数据库中检索的红花注射液不良反应,包含的严重不良反应较多。本研究为回顾性研究,所观察的不良反应总体较轻,部分可以耐受或者医师不易做出相关性判断的ADE未在病例中显示,导致本研究给药后 1~24 h发生ADE的构成比低。首次给药发生ADE的风险高于后续给药,因此首次给予红花注射液,特别是给药后1 h内,是ADE高发期,应给予特别监护。红花注射液说明书要求严禁混合配伍,应谨慎联合用药。为避免ADE发生,临床使用时要求严格执行与相邻药物之间冲管。本研究中,虽然联合用药较多,但冲管在一定程度上避免了因药物配伍禁忌而发生ADE,这也可能是本研究ADE发生率比罗永等[13]报道的结果低的原因。
基于HIS系统的医院集中监测能更加全面地收集ADE数据,但考虑本研究为回顾性研究,抽取方法有一定局限性,存在迟发型或速发型ADE,患者可耐受未采取停药或未给予抗过敏治疗的过敏反应等均难以检出,使本研究ADE病例数低于实际情况,且监测出的ADE种类和临床表现不够全面,可能使研究结果产生偏倚。因此,红花注射液的安全性仍需要多中心、大样本的研究进一步分析和探索。
