氯化钙对盐胁迫下荆芥种子萌发及幼苗生理特性的影响
2021-07-29张胜珍马艳芝
张胜珍, 马艳芝
(唐山师范学院生命科学系, 河北 唐山 063000)
当前,日益严重的土壤盐渍化问题已成为制约全世界农业生产的重要因素之一[1]。在盐渍化土壤中,高浓度的盐离子(主要是Na+和Cl-)会使土壤水势下降,造成植物根系吸水困难,形成生理干旱;同时还会产生离子毒害,影响植物对其他离子的吸收(如K+、Ca2+等),造成矿质营养亏缺与营养失衡。高浓度的盐分还会破坏质膜透性,使植物生理代谢发生紊乱,最终造成植物生长发育不良,产量降低、品质变劣,甚至植株死亡[2-3]。我国是土壤盐渍化非常严重的国家之一[4],对大面积盐渍化土壤进行恢复改良和开发利用是当前农业科研中非常重要的研究方向。
钙是植物生长发育必需的营养元素之一,具有极其重要的生理功能[5-6]。近年来,钙在植物抗逆反应中的作用受到广泛关注。研究表明,在盐胁迫下适量添加外源钙不仅可以缓解因钙素不足而导致的矿质营养亏缺,还可以增强生物膜结构的稳定性,降低质膜透性,从而控制离子的选择吸收[7]。此外,由于钙素是偶联胞外信号与胞内生理反应的第二信使[8],因此适量添加外源钙可以保证钙信号系统的正常发生和传递,从而增强植物对盐胁迫的响应,减轻盐胁迫对植物的伤害[9]。
荆芥(SchizonepetatenuifoliaBriq.)为唇形科荆芥属草本植物,其地上部干燥后可入药,用于感冒、头痛、麻疹、风疹、疮疡初起等疾病的治疗,为我国传统的常用大宗类中药材之一[10]。由于野生资源的不断减少,目前荆芥以人工栽培为主,主要分布于河北、江苏、浙江、东北三省等地区[11]。前人对荆芥的研究主要集中在栽培技术、化学成分、药理活性及临床应用等方面[12-15]。作为荆芥主产区的华北和东北地区存在较严重的土壤盐渍化问题[4],但关于荆芥盐胁迫的相关研究较少,利用外源物质缓解荆芥盐胁迫的研究尚未见报道。种子在盐胁迫环境中顺利萌发成苗是植物在盐渍化土壤中生长发育的前提。鉴于此,本研究采用氯化钙对荆芥种子进行浸种处理,研究其对盐胁迫下荆芥种子萌发及幼苗生理特性的影响,寻找缓解荆芥盐胁迫的最适氯化钙浸种浓度,并探索其作用机理,以期为荆芥在盐渍土地区的栽培生产提供理论依据和技术参考。
1 材料与方法
1.1 试验材料
选取大小均匀、健康饱满的荆芥种子作为试验材料,由北京同仁堂河北中药材有限公司提供。
1.2 试验设计
根据预试验及前期研究结果,选择对种子发芽抑制率在50%左右的150 mmol·L-1NaCl作为盐胁迫处理浓度。氯化钙设置2.5(Ca2.5)、5.0(Ca5)、10.0(Ca10)、20.0(Ca20)、40.0(Ca40) mmol·L-1共5个浓度进行浸种处理。选取饱满的荆芥种子,用0.1%的高锰酸钾消毒10 min,蒸馏水冲洗干净后,用不同浓度氯化钙溶液浸种24 h。将浸种后的种子放入垫有双层滤纸的培养皿中,每皿100粒,加入150 mmol·L-1NaCl溶液,每处理重复3次。另设蒸馏水对照(CK0)及盐胁迫对照(CK150)2个对照处理。蒸馏水对照的种子采用蒸馏水浸种24 h,然后加入蒸馏水培养。盐胁迫对照的种子采用蒸馏水浸种24 h,然后加入150 mmol·L-1NaCl溶液培养,具体操作方法与氯化钙处理相同。将培养皿置于25 ℃恒温培养箱中进行发芽培养,每天观察记录荆芥种子的发芽情况,并计算发芽势(germination energy,GE)、发芽率(germination rate,GR)、发芽指数(germination index,GI)、活力指数(vital index,VI)等。于处理第13 d时测定幼苗的株高、根长、鲜重等生长指标及相关生理指标。
1.3 指标测定
1.3.1种子萌发指标测定 以胚根长度为种子长度1/2时作为发芽标准,统计种子发芽情况,按以下公式计算发芽指标[16]。
发芽势(GE)=前3 d内正常发芽的种子数/供试种子数×100%
(1)
发芽率(GR)=7 d内正常发芽的种子数/供试种子数×100%
(2)
发芽指数(GI)=∑(Gt/Dt)
(3)
式中,Gt为t日的发芽数,Dt为相应的发芽天数。
活力指数(VI)=GI×S
(4)
式中,S为第7天的平均苗重。
1.3.2幼苗生长指标的测定 取荆芥幼苗,用滤纸吸干表面的水分,采用游标卡尺测量幼苗的株高和根长,每处理测定10株,重复3次;采用分析天平测定幼苗的鲜重,每处理20株,重复3次。
1.3.3幼苗生理指标的测定 丙二醛(malondialdehyde, MDA)含量测定采用硫代巴比妥酸法[17];脯氨酸含量测定采用酸性茚三酮法[17];可溶性蛋白含量采用考马斯亮蓝G-250法[17];超氧化物歧化酶(superoxide dismutase, SOD)活性测定采用氮蓝四唑法[17]、过氧化物酶(peroxidase, POD)活性测定采用愈创木酚法[18]、过氧化氢酶(catalase,CAT)活性测定采用紫外吸收法[17]。
1.4 数据分析
采用Microsoft Excel 2013进行数据处理与作图,采用SPSS 19.0进行方差分析,采用Duncan法进行多重比较。
3 结果与分析
3.1 氯化钙对盐胁迫下荆芥种子萌发的影响
不同处理下荆芥种子的萌发情况见表1。与CK0处理相比,CK150处理的种子发芽率和发芽势分别降低52.94%和55.99%,发芽指数和活力指数分别降低53.62%和72.32%,表明150 mmol·L-1NaCl胁迫对荆芥种子萌发有显著的抑制作用。用氯化钙浸种处理后,随氯化钙浓度的增加,荆芥种子在盐胁迫下的发芽率、发芽势、发芽指数、活力指数等各项指标均呈先升高后降低的趋势。5个氯化钙处理中,Ca2.5处理的各项发芽指标最低,种子发芽率仅为45.00%,发芽势仅为39.67%,与CK150对照无显著差异;其余氯化钙浓度处理的荆芥种子各项发芽指标均显著高于CK150对照,其中,Ca20处理荆芥种子的各项发芽指标均为最高,发芽率和发芽势分别为CK150对照的1.73和1.89倍,发芽指数和活力指数分别为CK150对照的1.87和2.45倍。综上所述,较高浓度的氯化钙浸种可以有效缓解NaCl胁迫对种子萌发的抑制作用,且20 mmol·L-1氯化钙效果最显著。
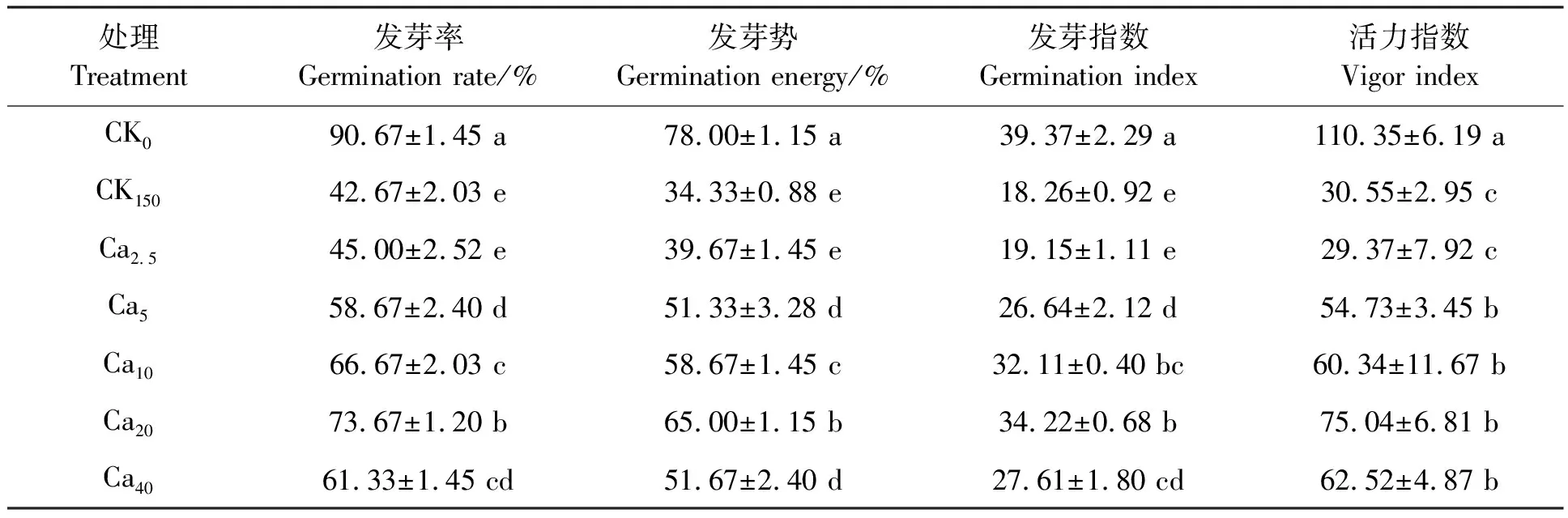
表1 氯化钙浸种后盐胁迫下荆芥种子的萌发Table 1 Seed germination of Schizonepeta tenuifolia Briq. of seed soaking with CaCl2 under salt stress
3.2 氯化钙对盐胁迫下荆芥幼苗生长指标的影响
不同处理下荆芥幼苗的生长见表2。与CK0对照相比,CK150处理荆芥幼苗生长受到明显的抑制,株高、根长及鲜重分别降低74.26%、38.00%和30.28%。用氯化钙对荆芥种子浸种处理后,随着氯化钙溶液浓度的增加,荆芥幼苗的株高、根长和鲜重均呈先增加后降低的趋势,其中,CK20处理的株高、根长和鲜重等指标均为最大,且显著高于CK150对照,分别为CK150对照的1.54、1.41和1.24倍;但仍低于CK0对照,尤其是株高仅为CK0对照的39.60%。
3.3 氯化钙对盐胁迫下荆芥幼苗生理生化指标的影响
3.3.1氯化钙浸种对盐胁迫下荆芥幼苗丙二醛含量的影响 植物在逆境条件下会发生膜脂过氧化作用。丙二醛是膜脂质过氧化的产物之一,其含量的高低可反映膜质过氧化程度和膜系统受损状况[19]。从图1可知,与CK0对照相比,CK150处理荆芥幼苗中丙二醛的含量大幅升高,表明荆芥幼苗在150 mmol·L-1NaCl胁迫下细胞膜受到了严重损伤。用氯化钙浸种处理后,荆芥幼苗中丙二醛含量随氯化钙浓度的增大先降低后升高。除Ca2.5处理外,其他处理幼苗中丙二醛含量均显著低于CK150对照。其中Ca20处理幼苗中丙二醛的含量最低,较CK150对照降低46.40%。以上结果表明,氯化钙浸种可以降低荆芥幼苗的膜脂过氧化水平,减轻荆芥幼苗在盐胁迫下的膜损伤程度,且20 mmol·L-1氯化钙浸种效果最好。
3.3.2氯化钙浸种对盐胁迫下荆芥幼苗抗氧化酶活性的影响 不同处理下荆芥幼苗中抗氧化酶活性表明(图1),CK150处理荆芥幼苗中SOD、POD和CAT活性较CK0对照分别降低了70.73%、36.66%和49.93%。氯化钙浸种处理后,荆芥幼苗的SOD活性随氯化钙浓度的增加先大幅升高,而后小幅降低;各浓度处理的SOD活性均显著高于CK150对照。POD和CAT活性的变化趋势与SOD基本一致,均随氯化钙浓度的增加呈先升高后降低的趋势,但变幅较小。低浓度(<5 mmol·L-1)的氯化钙处理幼苗中POD和CAT活性较CK150对照相比虽有所升高,但差异不显著;中高浓度(≥5 mmol·L-1)的氯化钙处理幼苗中POD和CAT活性显著高于CK150对照。其中Ca20处理幼苗中SOD、POD、CAT活性均为最高,分别是CK150对照的3.07、1.29和1.71倍。综上所述,氯化钙浸种可促进抗氧化酶活性的提高,从而增强清除活性氧能力,减轻盐胁迫对荆芥幼苗所造成的伤害,且20 mmol·L-1氯化钙为提高荆芥幼苗抗氧化能力的最佳浓度。
3.3.3氯化钙浸种对盐胁迫下荆芥幼苗中脯氨酸及可溶性蛋白含量的影响 植物在盐胁迫下会在细胞内合成并积累一些渗透调节物质,以平衡外部介质或液泡内的渗透压。脯氨酸和可溶性糖都是植物体内重要的有机渗透调节物质[20]。由图2可以看出,CK150处理荆芥幼苗中脯氨酸和可溶性蛋白含量较CK0分别提高了4.73和1.93倍,表明150 mmol·L-1NaCl 处理对荆芥幼苗产生了渗透胁迫,从而使脯氨酸和可溶性蛋白大量积累,以调节渗透压,缓解渗透胁迫。氯化钙浸种处理后,荆芥幼苗中脯氨酸和可溶性蛋白含量均随氯化钙浓度的增大呈现先降低后升高的趋势。Ca2.5处理幼苗中脯氨酸和可溶性蛋白含量最高;Ca20处理最低。氯化钙处理的幼苗脯氨酸和可溶性蛋白含量均显著高于CK0对照。与CK150相比,仅Ca2.5处理的可溶性蛋白与其无显著差异,其他处理与CK150间差异均达显著水平。综上所述,氯化钙浸种在一定程度上降低了荆芥幼苗在盐胁迫下对脯氨酸和可溶性蛋白的合成与积累,推测添加外源钙使得荆芥幼苗在盐胁迫下可能存在多种渗透调节方式,从而使脯氨酸与可溶性蛋白的累积量减少。
4 讨论
种子萌发是植物生长周期中最初和最关键的阶段[21],也是抗逆性最弱的阶段,易受到环境胁迫的影响甚至伤害。盐碱胁迫是最严重的生态限制因素之一[22]。本研究表明,150 mmol·L-1的NaCl胁迫下,荆芥种子的各项萌发指标均受到抑制。而采用氯化钙对荆芥种子进行浸种处理后,种子的发芽率、发芽势、发芽指数、活力指数等随氯化钙浓度的升高呈先升高后降低的趋势,且各项发芽指标均显著高于未浸种对照。此外氯化钙浸种后荆芥幼苗的株高、根长、鲜重等也显著高于对照,与前人关于外源钙促进马齿苋[23]、小麦[24]、豌豆[25]、黄芩[26]等种子萌发的研究结果相一致。
植物在逆境环境下会产生大量的活性氧自由基,从而发生膜脂过氧化作用,丙二醛作为其产物之一,是判断细胞膜脂过氧化程度和植物对逆境条件反应强弱的重要指标[27]。本研究中,在150 mmol·L-1NaCl胁迫下,荆芥幼苗的丙二醛含量显著提高,表明在盐胁迫下荆芥幼苗发生了严重的膜脂过氧化反应。而氯化钙浸种处理后,荆芥幼苗丙二醛含量与盐胁迫对照相比显著降低,与前人研究结果相一致[24-26],表明外源钙处理可有效地降低荆芥幼苗中MDA的积累,从而减轻盐胁迫下膜质过氧化作用对细胞的伤害程度。而外源钙处理后荆芥幼苗中MDA含量降低的原因可能与外源钙提高抗氧化酶活性有关。植物体内的SOD、POD和CAT等抗氧化酶是植物体内活性氧清除系统的重要成员,它们协同作用,调节植物体内的活性氧平衡,抵御其对膜的结构和完整性造成破坏。本研究表明,在盐胁迫下荆芥幼苗体内的SOD、POD和CAT活性均显著降低,而用氯化钙浸种处理后,幼苗中SOD、CAT和POD的活性均显著提高,与李小玲等[26]关于盐胁迫降低黄芩体内抗氧化酶活性,而外源钙可提高抗氧化酶活性的研究结果相一致。氯化钙浸种后,荆芥幼苗中抗氧化酶活性的提高降低了植株体内活性氧水平, 抑制了膜质过氧化作用,减少了MDA的累积,从而减轻了细胞膜损伤程度。
当土壤溶液中盐分含量增加时,渗透压也随之提高,从而造成植物根系吸水困难,甚至出现生理干旱现象。因此植物在盐胁迫下自身会进行渗透调节,即在细胞内积累渗透调节物质,以提高细胞内溶质浓度,降低胞内水势。渗透调节一般由无机离子(如K+、Cl-、Ca2+等)和有机物质(如游离脯氨酸、可溶性蛋白、可溶性糖等)共同参与[5]。本研究结果表明,在150 mmol·L-1NaCl胁迫下,荆芥幼苗的脯氨酸及可溶性蛋白含量与蒸馏水对照相比显著提高,这正是荆芥在盐胁迫下受到伤害后的一种自我调节反应。采用氯化钙浸种处理后的幼苗在盐胁迫下脯氨酸和可溶性蛋白含量虽整体上高于蒸馏水对照,但均低于未浸种对照,与前人关于外源钙提高盐胁迫下巴西蕉[9]、酸枣[20]、沙拐枣[27]幼苗脯氨酸及可溶性蛋白含量的研究结果存在差异。但侍瑞高等[24]研究发现,外源氯化钙会使盐胁迫下小麦幼苗中脯氨酸含量降低、可溶性糖含量提高;王志强等[28]研究发现,外源Ca2+显著降低了小麦在高盐胁迫下的脯氨酸含量,但增加了K+的吸收,认为增加的K+可部分替代脯氨酸等有机溶质的渗透调节作用,且与有机溶质相比,利用无机离子作为渗透调节剂的耗能更低;苏江硕等[7]研究发现外源Ca2+使盐胁迫下菊花幼苗脯氨酸含量降低,认为脯氨酸可能仅是盐胁迫下的一种产物,外源Ca2+可能是通过保护膜的稳定性、保持离子平衡等其他途径来减少菊花在盐胁迫下所受的伤害。本研究中外源钙使荆芥幼苗在盐胁迫下的脯氨酸及可溶性蛋白含量降低,推测可能是由于外源钙使植株启动了其他胁迫生理响应机制,从而具备了多种渗透调节方式,如提高抗氧化物酶活性、促进无机离子的吸收或其他渗透调节物质的合成等,从而降低了脯氨酸和可溶性蛋白的累积,但具体机制仍需进一步的研究。
