硫嘌呤联合5-氨基水杨酸类药物与单用硫嘌呤类药物用于炎症性肠病疗效和安全性比较的Meta分析*
2021-07-29李红莲张峻柳汝明姚勤李骞黄桦王晶晶卢珊珊
李红莲,张峻,柳汝明,姚勤,李骞,黄桦,王晶晶,卢珊珊
(昆明医科大学第一附属医院临床药学科,昆明 650032)
炎症性肠病(inflammatory bowel disease,IBD)是一种主要累及消化道的慢性非特异性疾病,主要包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn's disease,CD)[1]。5-氨基水杨酸(5-Aminosalicylate,5-ASA)类药物和硫嘌呤(thiopurines)类药物是缓解期和活动期IBD的主要治疗药物[2-3]。5-ASA包括美沙拉嗪、奥沙拉嗪、柳氮磺吡啶等;硫嘌呤类药物包括硫唑嘌呤(Azathioprine,AZA)和6-巯基嘌呤(6-mercaptopurine,6-MP),AZA由谷胱甘肽S-转移酶代谢为6-MP,6-MP再由次黄嘌呤转磷酸核糖基酶(hypoxanthine phosphoribosyl transferase,HPRT)代谢为6-鸟嘌呤核苷酸(6-thioguanine nucleotides,6-TGN)才能发挥疗效[4-6],6-TGN水平个体差异较大,目前研究推荐其有效浓度为250~500 pmol.8×10-8RBC[7]。其次6-MP由巯嘌呤甲基转移酶(The enzyme thiopurine methyltransferase,TPMT)代谢为6-甲基巯嘌呤(6-methylmercapto purine,6-MMP),该产物虽与药物疗效无直接关联,但6-MMP通过竞争共同代谢底物而减少6-TGN的生成,进而影响AZA/6-MP的疗效[4-6],目前研究推荐6-MMP浓度应不超过5700 pmol.8×10-8RBC[7]。本研究主要采用6-TGN和6-MMP水平评估硫嘌呤类药物的疗效。有研究提出硫唑嘌呤与美沙拉嗪联合治疗IBD会增大前者的骨髓抑制发生的风险,且对IBD的缓解率影响不大,并认为两药联合使用是发生骨髓抑制的危险因素[8]。有研究则发现硫唑嘌呤与美沙拉嗪联合使用的总有效率高于单用美沙拉嗪,且未增大不良反应发生的风险[9-10]。同时,临床实际应用时对于AZA/6-MP与5-ASA合用的治疗方案亦存在较大分歧,因此本研究将系统评价硫嘌呤联合5-ASA类药物与单用硫嘌呤的疗效与安全性,以期为临床治疗提供参考。
1 资料与方法
1.1文献纳入与排除标准
1.1.1研究类型 用AZA/6-MP或5-ASA治疗IBD的随机对照试验(randomized controlled trial,RCT)或队列研究。
1.1.2研究对象 纳入标准:①被确诊为UC或CD的IBD患者,诊断标准参照《中国炎症性肠病组织病理诊断共识意见》[11]、《欧洲炎症性肠病的诊断评估指南》[12];②患者种族、性别、年龄不限。排除标准:①AZA/6-MP治疗时间小于2周;②合用生物制剂治疗。
1.1.3干预措施 试验组:AZA/6-MP联合5-ASA治疗;对照组:单用AZA/6-MP治疗。要求试验组与对照组基线治疗一致。
1.1.4结局指标 ①6-TGN和6-MMP水平;②不良反应发生率;以上两个指标兼备或具备一个均可。
1.1.5文献排除标准 ①在不同数据库重复发表的文献;②动物实验;③仅发表文章摘要无详细内容或无法获得有效结局的文献。
1.2文献检索策略 计算机检索The Cochane Library、PubMed、迈特思创、CBM、万方数据库、VIP和中国知网数据库,检索时限为建库至2019年10月。中文检索词为:硫嘌呤、硫唑嘌呤、美沙拉嗪、奥沙拉嗪、柳氮磺吡啶、5-氨基水杨酸、克罗恩病、溃疡性结肠炎、炎症性肠病、不良反应等;英文检索词为:thiopurines,Imurel,Azat-hioprine,6-Mercaptopurine,6-Thiohypoxanthine,5-Aminosalicylate,Mesalazine,Olsalazine,sulfasalazine,Crohn's disease,ulcerative colitis,inflammatory bowel disease,adverse reaction等,用AND和OR运算符连接上述检索词分别检索各个数据库。
1.3文献筛选与资料提取 将检索到的文献全部导入EndNote17.0文献管理软件,剔除重复发表文献后,由2名研究员独立筛选文献,先初步阅读文献题目和摘要,剔除不相关研究,然后仔细阅读剩余文献全文以确定是否纳入,意见存在分歧时通过协商或请求第三方协助解决。提取资料包括:研究题目、研究者姓名、文献发表日期、患者数、疾病诊断、平均年龄、试验组和对照组药物使用情况、所关注的结局指标和其对应数据等。
1.4纳入研究的偏倚风险评价 参照Cochrane handbook6.0提出的文献偏倚风险评价方法,由2名研究员分别采用RoB 2[13]和ROBINS-I[14]评价纳入RCT和队列研究的偏倚风险,然后交叉核对评价结果,如有不同意见,可请求第三方协助解决。
1.5统计分析 不良反应为二分类变量,效应分析统计量采用比值比(odds ratio,OR)和95%CI;6-TGN和6-MMP为连续变量,效应分析统计量采用均数差(mean diffrence,MD)和95%CI;采用χ2检验分析纳入文献间的异质性,并结合I2判断其异质性数值大小。如果各文献结果间无较大异质性,采用固定效应模型分析;反之,则需先分析导致异质性的原因,采用亚组分析消除较大临床异质性后,采用随机效应模型分析或只做描述性分析。以上统计分析均在RevMan 5.3和Stata 12.0版软件进行。
2 结果
2.1文献筛选流程及结果 从各个数据库共检索到文献1569篇,按照如下文献筛选流程(图1)最后纳入分析12篇[15-26],其中包括1个RCT,11个队列研究,共计3751例患者。
2.2纳入研究基本特征与偏倚风险评价结果 纳入文献基本特征见表1所示,表中干预措施下标示药物剂量是根据原始文献数据经换算所得,将6-MP换算为等剂量的AZA,奥沙拉嗪和柳氮磺吡啶换算为等剂量的美沙拉嗪,统一用AZA、5-ASA表示[18,23]。纳入研究包含1个RCT和11个队列研究,其中RCT偏倚风险评价结果为:不清楚随机化过程和测量结果偏差,未偏离预期干预措施,结果数据不缺失,未选择报告结果。11个队列研究的偏倚风险评价结果如表2所示。
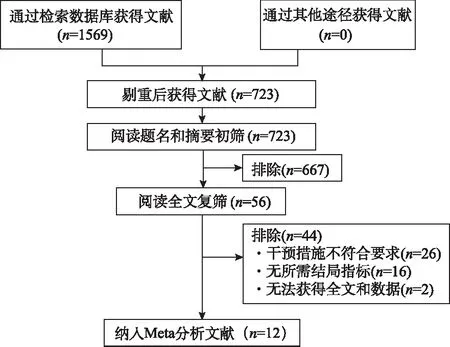
图1 文献筛选流程图
2.3Meta分析结果
2.3.1疗效评估
① 6-TGN水平。共纳入6个研究[19-23,25]。固定效应模型Meta分析结果显示,AZA/6-MP与5-ASA合用组6-TGN水平高于单用AZA/6-MP组,差异有统计学意义[MD=24.45,95%CI(8.63,-40.28)%,P<0.05](图2)。
② 6-MMP水平。共纳入5个研究[19,21-23,25]。固定效应模型Meta分析结果显示,AZA/6-MP联合5-ASA组与单用AZA/6-MP组比较,6-MMP水平差异无统计学意义(P=0.34)(图3)。
③ 复发率和缓解率。因纳入的研究复发率和缓解率指标资料较少,故只做描述性分析。SHAH 等[17]研究发现AZA/6-MP联合5-ASA组复发率高于单用AZA/6-MP组(χ2=5.5,P<0.02)。MANTZARIS 等[24]研究发现AZA/6-MP联合5-ASA组与单用AZA/6-MP组比较复发时间差异无统计学意义。NGUYEN 等[22]研究发现AZA/6-MP联合5-ASA组与单用AZA/6-MP组比较缓解率差异无统计学意义(83.3%和90.3%)。

表1 纳入文献的基本特征
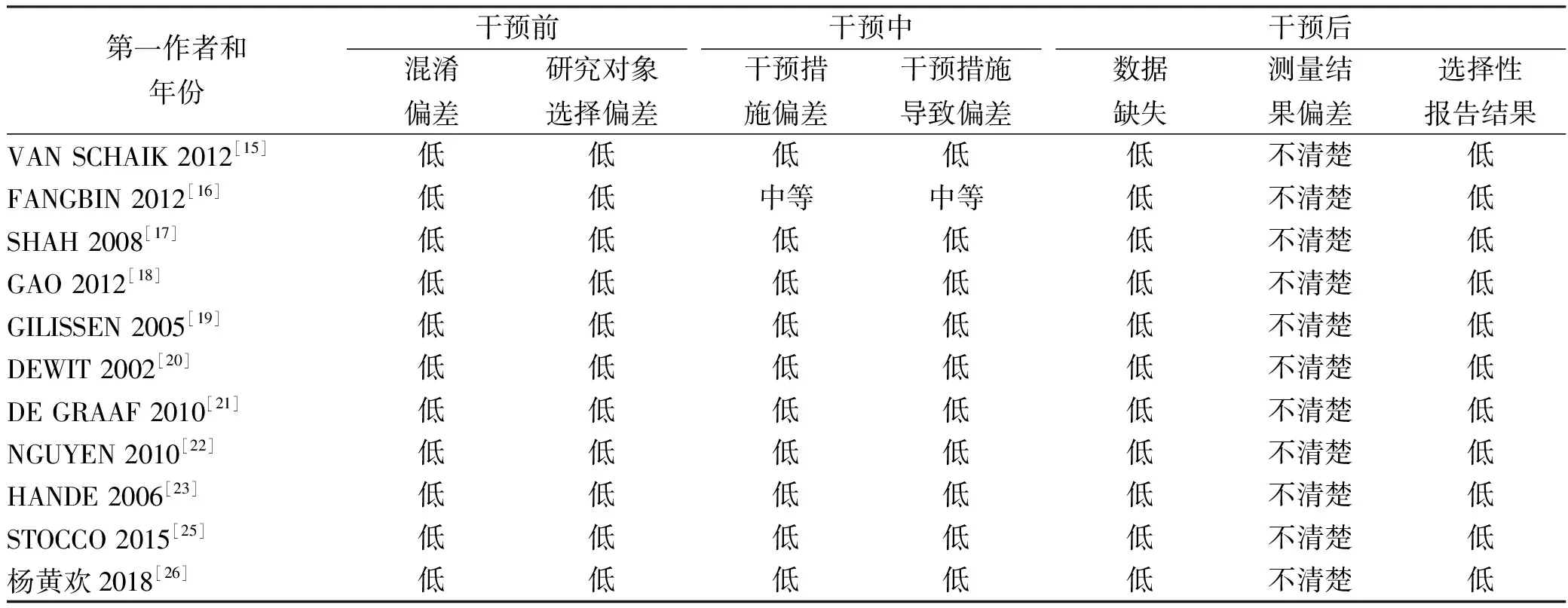
表2 纳入队列研究的偏倚风险评价结果
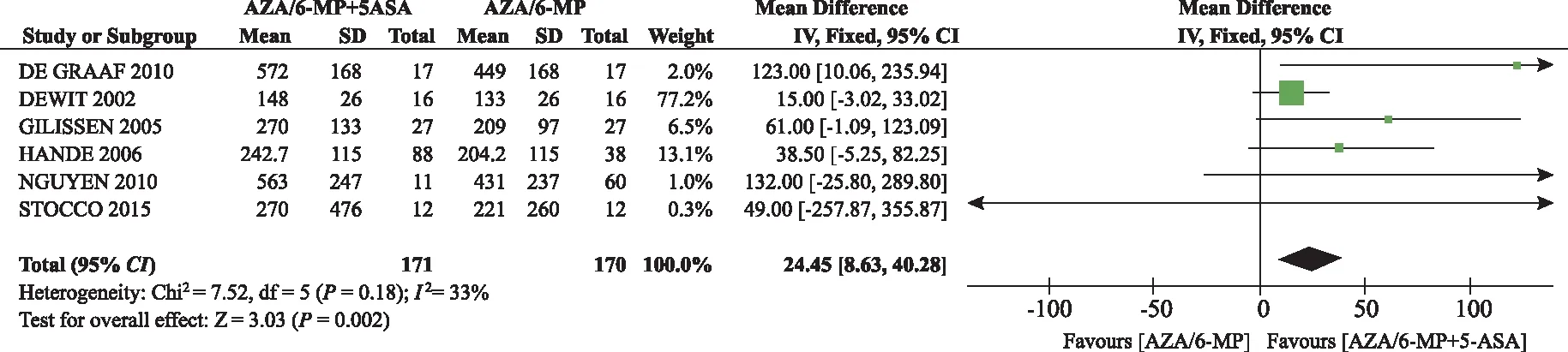
图2 AZA/6-MP联合5-ASA组对比单用AZA/6-MP 组6-TGN水平的Meta分析
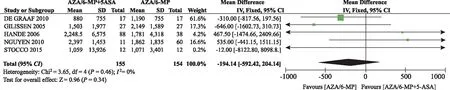
图3 AZA/6-MP联合5-ASA组对比单用AZA/6-MP 组6-MMP水平的Meta分析
2.3.2不良反应发生率 共纳入8个研究[15-18,22-25]。其中7个队列研究,随机效应模型Meta分析结果显示,AZA/6-MP与5-ASA合用组总不良反应发生率低于单用AZA/6-MP组,差异有统计学意义[OR=1.78,95%CI(1.03,3.08)%,I2=63%,P<0.05](图4)。由于不良反应发生率Meta分析结果异质性较大,故分别对不良反应中的骨髓抑制、血液系统异常、肝毒性和胃肠道不适结局指标做亚组分析,AZA/6-MP联合5-ASA组与单用AZA/6-MP组比较,AZA/6-MP与5-ASA合用组骨髓抑制、血液系统异常和胃肠道不适发生率均较低(P<0.05),两组肝毒性发生率差异无统计学意义(P>0.05)(图4、表3)。纳入的RCT只有1项,故只对其进行描述性分析,AZA/6-MP与5-ASA合用组和单用AZA/6-MP组的总体不良反应发生率分别为41.67%,23.53%,血液系统异常发生率分别为36.11%,17.65%,肝毒性发生率分别为0%,2.9%,胃肠道不适的发生率分别为5.56%,2.9%。因原始文献未给出不良反应的严重程度等级,故本文分析的不良反应泛指所有等级的不良反应。

图4 AZA/6-MP联合5-ASA组对比单用AZA/6-MP组总体不良反应发生率的Meta分析
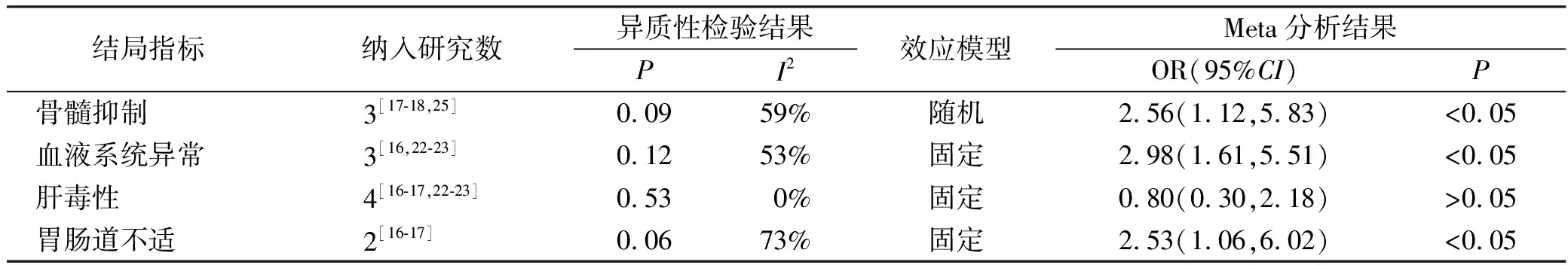
表3 AZA/6-MP联合5-ASA组对比单用AZA/6-MP组不良反应发生率的亚组分析
2.3.3敏感性分析 分别以6-TGN、6-MMP和不良反应发生率为指标在Stata 12.0版软件进行敏感性分析,结果显示,剔除任意一篇文献,结局指标均未发生明显变化,表明结果较稳定。见图5—图7。

图5 6-TGN敏感性分析结果
图6 6-MMP敏感性分析结果
图7 总体不良反应发生率敏感性分析结果
2.3.4发表偏倚分析 分别以6-TGN、6-MMP和不良反应发生率为指标在Stata 12.0版软件进行Egger’s检验,结果显示6-TGN、6-MMP和不良反应的P值均大于0.05,提示本研究存在发表偏倚的可能性较小(表4)。
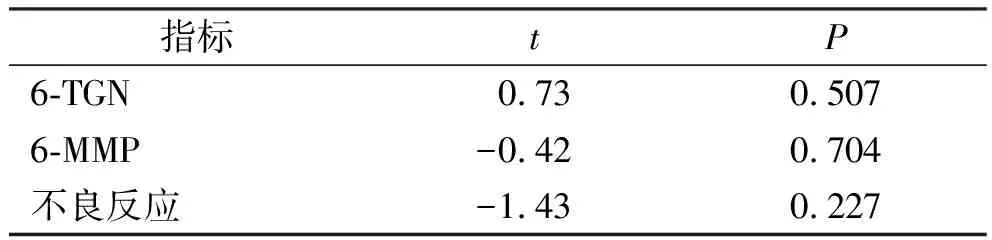
表4 Egger’s 检验结果
3 讨论
炎症性肠病的病因和致病机制尚不完全明确,5-氨基水杨酸类药物和硫嘌呤类药物是目前治疗炎症性肠病的常用药物,研究报道10% ~50%的IBD患者会联用美沙拉嗪和硫唑嘌呤[27]。5-ASA由N-乙酰转移酶代谢为乙酰化5-氨基水杨酸发挥抗炎作用[28],AZA/ 6-MP由HPRT代谢为6-TGN发挥免疫抑制作用[4-6],6-TGN不仅是活性代谢产物,同时也与该类药物导致骨髓抑制的不良反应相关[4],故研究建议行血药浓度监测,浓度低于参考范围下限疗效欠佳,高于参考范围上限则骨髓抑制的风险较大[29]。本研究结果显示AZA/6-MP联合5-ASA治疗IBD,会使6-TGN浓度增大(P<0.05),在该结论下纳入的6个原始研究中,联用组6-TGN水平超过500 pmol.8×10-8RBC的研究有2个[21-23],但AZA/6-MP单用组6-TGN水平低250 pmol.8×10-8RBC的研究多达4个[19-20,23,25],并结合骨髓抑制亚组分析结果,联用组的骨髓抑制发生率较小(P<0.05),故对于6-TGN水平Meta分析结果的解读,本研究趋向于认为联合用药的疗效更佳,但仍需行血药浓度监测,将6-TGN水平控制在安全范围。另外,有研究提出6-TGN水平还与TPMT和NUDT15基因多态性相关[30-31],AZA/ 6-MP联合5-ASA使用时,还需综合考虑患者基因型因素。其次与6-TGN具有竞争代谢作用的6-MMP浓度过高,不仅阻碍活性代谢物6-TGN的生成,还与肝毒性相关[4],研究推荐6-MMP浓度应不超过5700 pmol.8×10-8RBC[29],在本研究中两组的6-MMP水平差异无统计学意义(P>0.05)。
在不良反应方面,本研究结果显示:AZA/6-MP与5-ASA联用组总不良反应发生率较AZA/6-MP单用组小(P<0.05),但异质性偏大,考虑其原因可能是:原始研究不良反应结局的判断标准差异较大,其次计算总体不良反应发生率时,将多个不良反应结局合并,从而产生了较大的临床异质性。考虑骨髓抑制、血液系统异常、肝毒性、胃肠道不适是硫嘌呤类药物常见的不良反应[32],故分别对其做亚组分析,结果显示:AZA/6-MP与5-ASA联用组骨髓抑制、血液系统异常的和胃肠道不适的发生率均较低(P<0.05),两组肝毒性发生率差异无统计学意义(P>0.05),与上述肝毒性相关的6-MMP水平的Meta分析结果相符。
经查阅文献,发现目前发表的系统评价均只对比AZA/6-MP组和5-ASA组的有效性和安全性[33],尚未见比较二者合用组与单用组的Meta分析。目前关于两类药物相互作用的机制尚不明确,CHANG等[34]提出美沙拉嗪能抑制硫唑嘌呤的侧甲基化代谢生成6-MMP,进而促进活性代谢产物6-TGN的生成,与本研究结果相呼应。另外,AZA/6-MP和5-ASA合用的相互作用机制也可能与转运蛋白有关[35]。
本研究存在的不足之处:①炎症性肠病患者的不良反应中,胃肠道不适很难与疾病本身鉴别,可能导致该不良反应与实际发生率有所偏差;其次骨髓抑制的不良反应通常表现就是血液系统检查指标异常,纳入的研究中有的结局指标是骨髓抑制,有的则是白细胞减少、淋巴细胞减少和贫血,无法统一归类,将其分为骨髓抑制和血液系统异常,也可能干扰到骨髓抑制的实际发生率;②因受限于原始研究的疗效评估指标,本研究主要采用6-TGN和6-MMP水平来评估疗效,复发率和缓解率资料匮乏,只做描述性分析。
综上所述,当前证据显示,AZA/6-MP与5-ASA联用组疗效高于单用AZA/6-MP组,且总体不良反应发生率较低。受纳入文献数量和质量限制,上述结论还需结合临床情况进一步探讨。
