油菜素内酯对盐胁迫下黑麦草种子萌发及幼苗生长的生理调控作用
2021-07-28刘亚西聂书明
王 丹,刘亚西,周 扬,黎 彬,聂书明
(西华师范大学生命科学学院 西南野生动植物资源保护教育部重点实验室, 四川 南充 637009)
土壤盐渍化是当前全球范围内所面临的生态问题,严重威胁着生态安全和农牧业的可持续发展[1]。探索适宜在盐碱地栽培生产且具有较高经济和生态价值的植物,是开发和利用盐碱地资源较为经济有效的途径之一[2]。多年生黑麦草(Lolium perenne)具有耐践踏、适应土壤范围广、色泽靓丽、建植速度快、抗病虫害能力强等特性,目前已被广泛应用于畜牧业养殖、地被植物水土保持和土壤生态修复等方面[3-4]。探索黑麦草耐盐高效的栽培模式,不仅为土壤盐渍化地区黑麦草农业生产及草地改良提供科学依据,而且对盐碱地资源高效利用及农牧业的可持续发展等方面均具有重大的应用价值。
盐胁迫扰乱了植物细胞内离子平衡,诱发细胞内积累过多的活性氧引起氧化胁迫,使胞内膜脂过氧化程度加大,进而损伤膜的完整性,从而丧失了对离子的选择性吸收功能,最终导致植物的生理代谢紊乱,甚至植株死亡[5]。植物为了应对过多活性氧的积累对其自身产生的伤害,进化出一套复杂的抗氧化防御系统,包括各种抗氧化酶和非酶分子,来共同抵御各种环境胁迫对植物造成的不利影响[6]。有研究表明施加外源水杨酸、褪黑素、2, 4-表油菜素内酯(2, 4-epibrassinolide, EBR)和一氧化氮信号分子等可促进非生物胁迫条件下种子萌发[7-10]。
油菜素内酯(brassinosteroids, BRs)是一类不仅在植物生长发育过程中具有重要的调节作用,而且在植物抗逆性方面也发挥重要作用的植物新型激素[11]。研究表明在玉米(Zea mays)种子播种前进行BRs 浸种处理,可通过刺激植株体内抗氧化防御功能成分,有效克服盐碱胁迫对植株的损伤[12]。EBR 对NaCl 胁迫下紫花苜蓿(Medicago sativa)幼苗根系生长抑制及氧化损伤具有缓解效应[13-14]。在拟南芥(Arabidopsis thaliana)中发现盐胁迫条件下BRs 信号可能通过调节气孔密度和气孔导度来减少叶片水分散失,进而提高植物耐盐性[15]。应用EBR 提高了盐胁迫下水稻(Oryza sativa)的抗氧化酶活性、脯氨酸和可溶性蛋白含量[16]。在盐胁迫下喷施EBR 缓解了辣椒(Capsicum annuum)叶片中电解质、脯氨酸和叶绿素含量的升高,进而减轻了盐胁迫的效果[17]。EBR 抑制了番茄(Solanum lycopersicum)植株体内Na+从根部向地上部的运输,降低了多胺浓度,最终提高了番茄的耐盐性[18]。关于EBR 对盐胁迫下黑麦草的影响,有研究将EBR 和盐溶液同时加入装有无菌黑麦草幼苗的MS 培养基中,结果表明EBR 可提高盐胁迫下黑麦草幼苗的耐盐性[19]。而针对EBR 对盐胁迫下黑麦草种子萌发过程的影响、如何提高黑麦草幼苗的抗盐性及其与渗透调节和抗氧化特性之间的关系却鲜有报道。
基于此,本研究在盐胁迫下,分别对黑麦草种子和幼苗进行EBR 处理,探讨EBR 对盐胁迫下黑麦草种子萌发、淀粉酶活性、幼苗生长、幼苗渗透调节和抗氧化酶特性等方面的影响,旨在为土壤盐渍化地区黑麦草耐盐高效栽培管理提供理论依据和生产实践指导。
1 材料与方法
1.1 试验材料
黑麦草雅晴(Yatsyn)种子购自百绿国际草业有限公司;EBR 购自上海源叶生物技术有限公司,用少量无水乙醇充分溶解后,用双蒸水分别稀释至工作液浓度。
1.2 试验处理
种子处理包括CK 处理(蒸馏水)、EBR 处理(0.01 μmol·L-1EBR 溶液)、 NaCl 100 处理 (100 mmol·L-1NaCl 盐溶液)、NaCl 100 + EBR 处理(100 mmol·L-1NaCl 和0.01 μmol·L-1EBR 溶液)、 NaCl 150 处理(150 mmol·L-1NaCl 盐溶液)和NaCl 150 +EBR 处理(150 mmol·L-1NaCl 和0.01 μmol·L-1EBR溶液)。将种子置于使用处理溶液润湿的铺有双层滤纸的洁净培养皿中进行发芽试验,每处理100 粒种子,3 次重复,在光照培养箱中进行试验,温度25 ℃,昼夜时长各为12 h,相对湿度70%。
幼苗生长试验,将出芽15 d 的幼苗移栽到直径7 cm 的方形营养钵中(营养土 ∶ 蛭石 = 2 ∶ 1,V ∶ V),置于植物培养间中,光照16 h,温度(26 ± 2) ℃,黑暗8 h,温度(24 ± 2) ℃,相对湿度70%。对生长60 d的黑麦草幼苗进行叶片正面喷施,每天早上对每株叶片正面均匀喷施,连续喷施3 d。喷施完成的第2 天,进行浇灌处理,为盐胁迫处理的开始。试验处理包括CK 处理(喷施相同体积的蒸馏水,浇灌蒸馏水)、EBR 处理(喷施含0.1 μmol·L-1EBR 溶液,浇灌蒸馏水)、NaCl 处理(喷施相同体积的蒸馏水,浇灌含250 mmol·L-1NaCl 盐溶液)和NaCl + EBR 处理(喷施含0. 1 μmol·L-1EBR 溶液,浇灌含250 mmol·L-1NaCl 盐溶液),在培养间进行正常栽培管理。
1.3 测定指标与方法
种子发芽处理第3 天时,取样测定种子淀粉含量和α 淀粉酶活性,处理第5 天统计种子发芽势,第12 天统计种子发芽数、株高、活力指数、鲜重、根系活力。幼苗胁迫处理第10 天取样进行抗氧化酶活性、渗透调节物质、可溶性蛋白、可溶性糖含量、叶绿素含量等生理指标测定。
抗氧化酶活性、可溶性糖和可溶性蛋白含量等指标的测定取植株叶片为试验材料[16];根系活力应用TTC 还原法测定,具体操作参考李合生[20]的测定步骤;淀粉含量、α-淀粉酶活性、超氧化物歧化酶(superoxide dismutase, SOD)活性、 过氧化物酶(peroxidase, POD)活性、过氧化氢酶(catalase, CAT)活性、谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)活性、可溶性糖(soluble sugar, SS)含量和可溶性蛋白(soluble protein, SP)含量测定方法根据苏州格锐思生物科技公司的试剂盒说明书进行测定。丙二醛含量通过与硫代巴比妥酸(TBA)反应,然后进行比色的方法测定,参考李合生[20]的测定步骤。
各发芽指标计算公式如下:

式中:Gt为第t天的发芽数,Dt为相应的发芽天数。
活力指数(vitality index,VI) =GI×S。
式中:GI为发芽指数,S为发芽t时间的根长。
1.4 数据统计分析
运用Excel 2010 软件处理试验数据并作图,应用SPSS 19.0 软件对数据进行单因素方差分析,利用Duncan’s 多重比较进行差异显著性分析(P< 0.05)。
2 结果与分析
2.1 外源EBR 对盐胁迫下黑麦草种子萌发的影响
与对照相比,150 mmol·L-1NaCl 胁迫显著降低了黑麦草种子的发芽率(P< 0.05),而外源EBR 处理后黑麦草种子的发芽率较该浓度盐胁迫显著提高(P< 0.05) (表1)。100 和150 mmol·L-1NaCl 胁迫下种子的发芽势分别比对照降低了17.96%和31.15%(P< 0.05);外源EBR 处理后发芽势分别较各自浓度盐胁迫提高了10.95%和9.57% (P< 0.05)。100 和150 mmol·L-1NaCl 胁迫下种子的活力指数分别比对照降低了48.99%和70.70% (P< 0.05),外源EBR 处理后种子活力指数分别较各自浓度盐胁迫提高了23.86%和22.82% (P< 0.05)。100 和150 mmol·L-1NaCl胁迫下黑麦草的株高显著降低(P< 0.05),而且150 mmol·L-1NaCl 胁迫下株高降低更明显,外源EBR处理100 mmol·L-1NaCl 后株高较该浓度盐胁迫处理显著升高(P< 0.05)。这些结果表明100 和150 mmol·L-1NaCl 胁迫均显著抑制了黑麦草种子的萌发和生长(P< 0.05),而外源EBR 处理可以缓解NaCl胁迫对黑麦草种子萌发的抑制作用。
100 mmol·L-1NaCl 和150 mmol·L-1NaCl 处理下黑麦草α-淀粉酶活性比对照分别降低了27.51%和53.44% (P< 0.05),表明盐胁迫抑制了黑麦草α-淀粉酶的活性(表1)。100 mmol·L-1NaCl + 0.01 μmol·L-1EBR 处理比100 mmol·L-1NaCl 处理的α-淀粉酶活性显著提高15.61% (P< 0.05);而150 mmol·L-1NaCl +0.01 μmol·L-1EBR 处理的α-淀粉酶活性与150 mmol·L-1NaCl 处理的无显著差异(P >0.05)。盐胁迫处理抑制了种子萌发过程中淀粉的分解,100 mmol·L-1NaCl 胁迫处理下,外源EBR 处理比无EBR胁迫处理组的淀粉含量显著降低12.75% (P< 0.05)。以上结果表明EBR 能够提高100 mmol·L-1NaCl 胁迫下黑麦草种子的α-淀粉酶活性,并进一步促进淀粉的代谢分解。
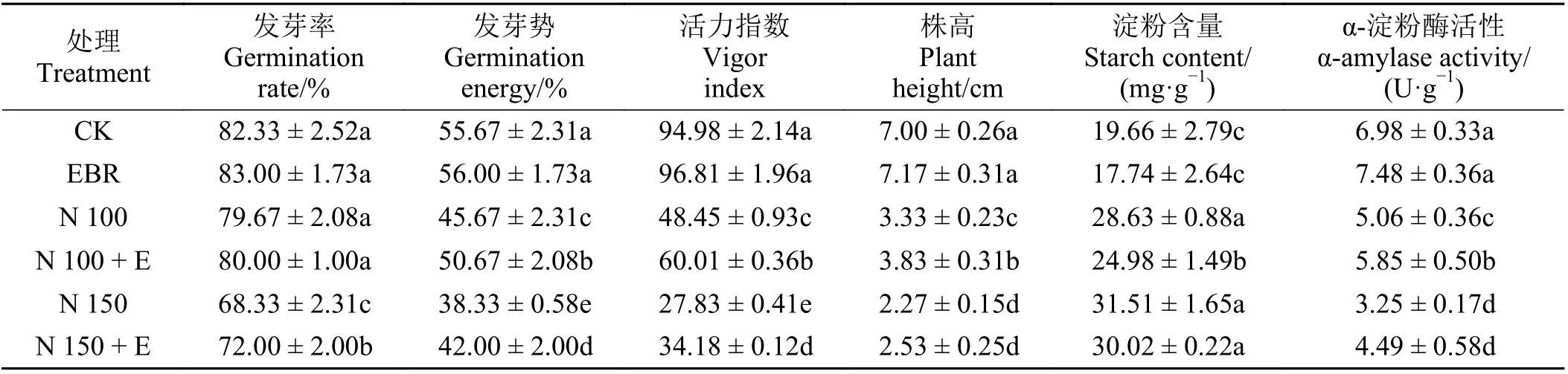
表1 外源油菜素内酯对NaCl 胁迫下黑麦草种子萌发期指标的影响Table 1 Effect of exogenous 2, 4-epibrassinolide on germination indexes of ryegrass seeds under NaCl stress
2.2 外源EBR 对盐胁迫下黑麦草鲜重和根系活力的影响
盐胁迫显著抑制了黑麦草的鲜重(P< 0.05),100 和150 mmol·L-1NaCl 胁迫下鲜重分别比对照降低了分别比对照降低了10.17% 和42.73% (图1)。150 mmol·L-1NaCl 胁迫下,外源添加EBR 处理比未添加EBR 处理鲜重提高了21.37%(P< 0.05)。与此同时,100 和150 mmol·L-1NaCl 胁迫处理下根系活力分别比对照降低了17.32%和60.02% (P< 0.05);而在150 mmol·L-1NaCl 处理下添加EBR 处理比未添加EBR 处理下根系活力显著提高了42.91% (P< 0.05)。
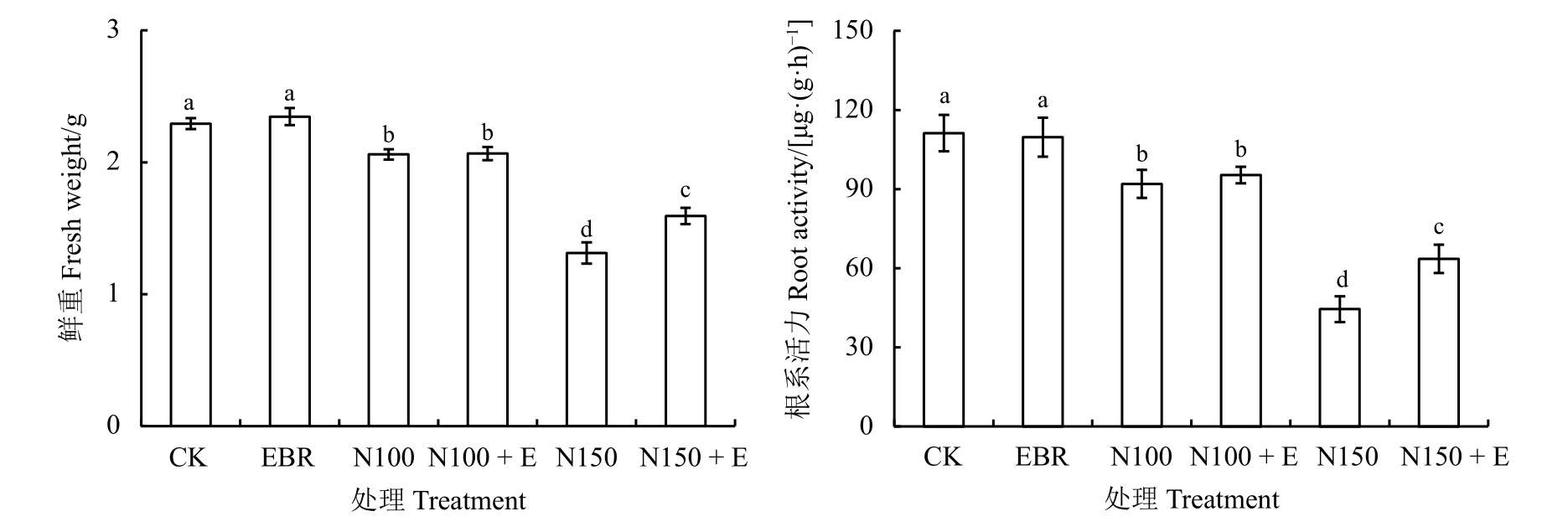
图1 外源油菜素内酯对NaCl 胁迫下黑麦草鲜重和根系活力的影响Figure 1 Effect of exogenous 2, 4-epibrassinolide on fresh weight and root activity of ryegrass under NaCl stress
2.3 外源EBR 对盐胁迫下黑麦草幼苗叶片的丙二醛含量和抗氧化酶活性的影响
250 mmol·L-1NaCl 胁迫显著增加了黑麦草幼苗体内膜脂过氧化产物MDA 的含量(P< 0.05),NaCl处理10 d 后,MDA 含量比对照显著增加了38.42% (P<0.05);外源EBR 处理黑麦草幼苗体内MDA 含量比NaCl 处理显著降低了14.57% (P< 0.05) (图2)。
与对照相比,250 mmol·L-1NaCl 胁迫下,黑麦草幼苗体内SOD、CAT、POD 和GPX 活性显著升高(P<0.05),而外源EBR 和NaCl 共同处理下进一步提高了黑麦草幼苗体内抗氧化酶活性(图2)。NaCl 处理10 d后,SOD、CAT、POD 和GPX 活性分别比对照提高了21.42%、13.87%、10.67%和33.96%;外源EBR 和NaCl共同处理下SOD、CAT、POD 和GPX 活性比NaCl胁迫处理提高了12.6%、 5.11%、 8.73%和4.44%。以上结果表明外源EBR 可以进一步提高NaCl 处理下黑麦草幼苗体内抗氧化酶活性来降低MDA 含量。
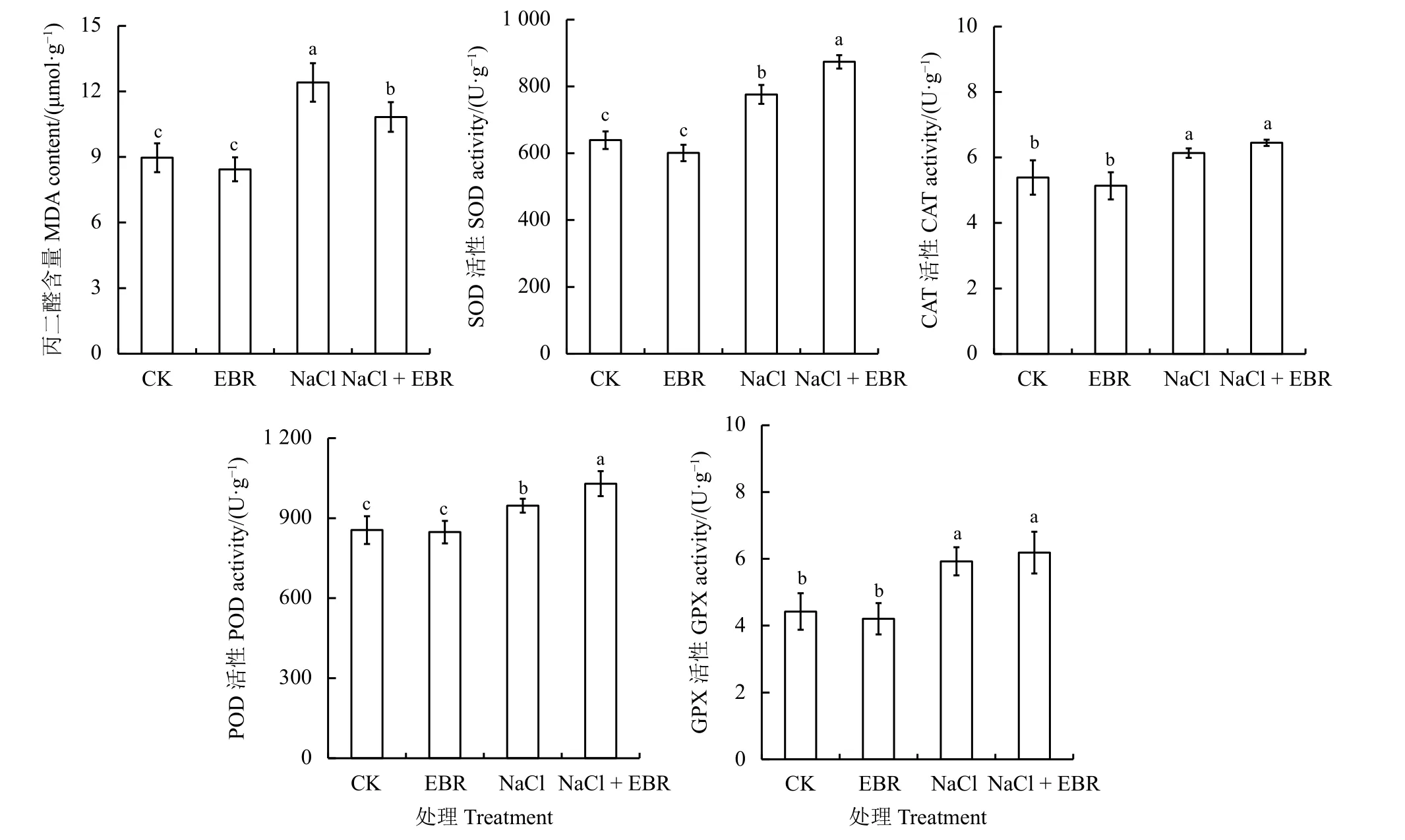
图2 外源油菜素内酯对NaCl 胁迫下黑麦草幼苗叶片丙二醛含量和抗氧化酶活性的影响Figure 2 Effect of exogenous 2, 4-epibrassinolide on malondialdehyde and antioxidant enzyme activity in ryegrass seedling leaves under NaCl stress
2.4 外源EBR 对盐胁迫下黑麦草幼苗叶片可溶性糖、可溶性蛋白和叶绿素含量的影响
250 mmol·L-1NaCl 胁迫显著增加了黑麦草幼苗体内可溶性糖和可溶性蛋白含量(P< 0.05),NaCl 处理10 d 后,可溶性糖和可溶性蛋白含量分别比对照增加了28.98%和31.56% (图3)。外源EBR 和NaCl共同处理下黑麦草幼苗体内可溶性糖和可溶性蛋白含量分别比NaCl 处理提高了13.9%和8.31%。
在正常生长条件下,外源喷施EBR 轻微增加了NaCl 胁迫下的黑麦草幼苗体内叶绿素a 含量;250 mmol·L-1NaCl 胁迫下,黑麦草幼苗体内叶绿素a、叶绿素b、总叶绿素、类胡萝卜素含量显著下降(P< 0.05),EBR 在一定程度上可以抑制NaCl 胁迫导致的叶绿素含量下降(图3)。NaCl 处理10 d 后,叶绿素a、叶绿素b、总叶绿素、类胡萝卜素含量分别比对照降低了46.54%、48.25%、43.79%和46.97%;EBR 和NaCl共同处理下黑麦草幼苗体内叶绿素a、叶绿素b、总叶绿素、类胡萝卜素含量比NaCl 处理提高了24.74%、25.18%、24.86%和8.49%。表明250 mmol·L-1NaCl胁迫下,添加外源EBR 能显著改善NaCl 胁迫对黑麦草光合色素的影响。
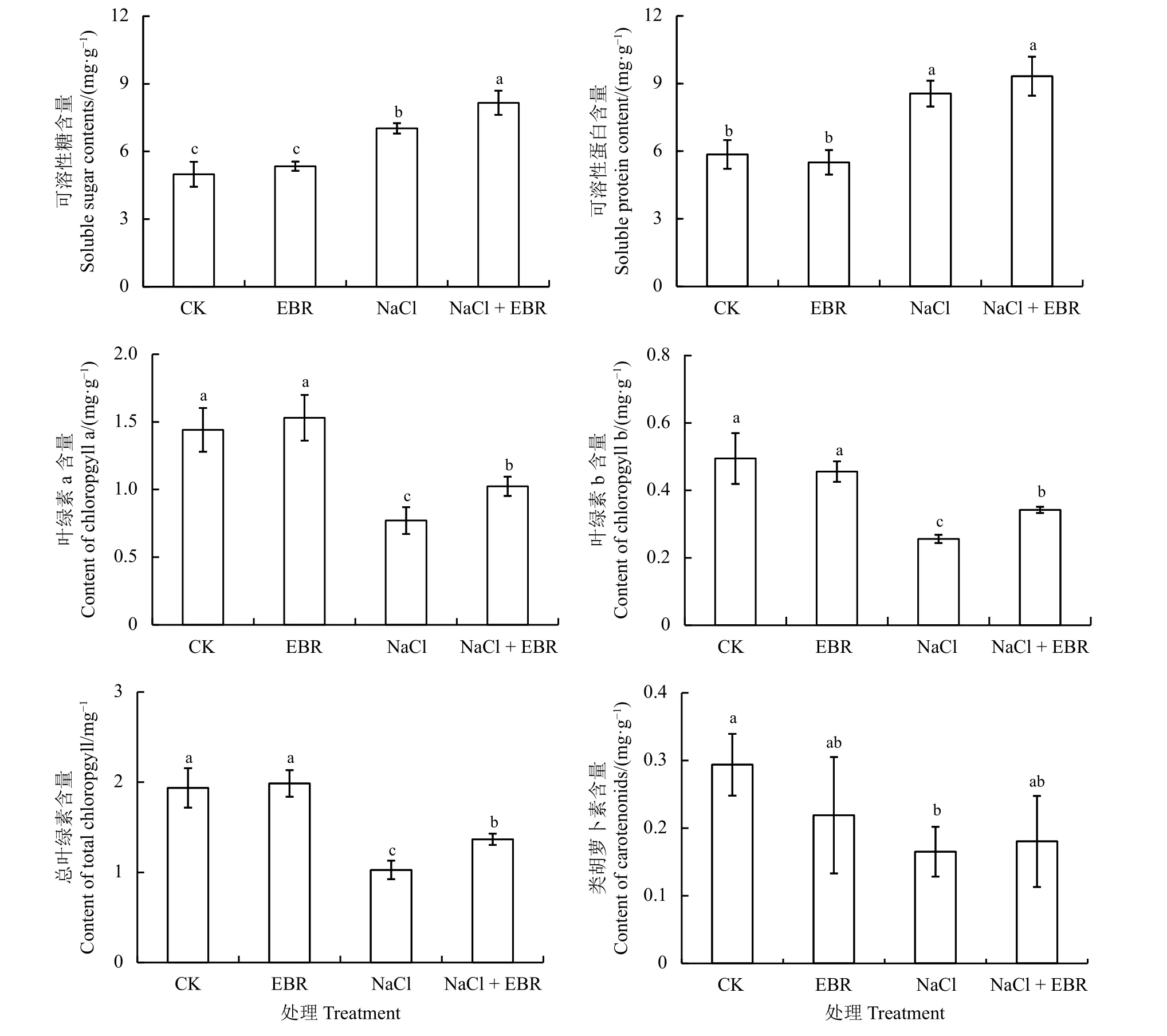
图3 外源油菜素内酯对NaCl 胁迫下黑麦草幼苗叶片可溶性糖、可溶性蛋白和叶绿素含量的影响Figure 3 Effect of exogenous 2, 4-epibrassinolide on soluble sugar, soluble protein, and chlorophyll content in ryegrass seedling leaves under NaCl stress
3 讨论与结论
植物在生长的不同阶段对胁迫的耐受性不同,对于大多数植物而言,种子萌发和幼苗生长阶段对胁迫最为敏感[21]。黑麦草种子萌发时对盐胁迫敏感,而且随着胁迫程度的增加,伤害程度也加重[22]。目前有研究报道表明应用水杨酸、褪黑素、EBR、一氧化氮等外源物质可以促进非生物胁迫条件下种子萌发[7-10]。Wang 等[23]研究表明,BRs 通过与乙烯合成的相互作用来减轻盐胁迫对黄瓜(Cucumis sativus)种子萌发的抑制作用。其他研究表明,BRs与根发育的许多方面有关,如分生组织大小的维持、根毛的形成、侧根的发生、重力反应、菌根的形成和豆科植物的结瘤等[24]。本研究表明,盐胁迫降低了黑麦草种子的发芽率、发芽势、活力指数以及发芽后的鲜重和根系活力,而EBR 缓解了盐胁迫对黑麦草种子这些指标的影响。盐胁迫也抑制了黑麦草种子α-淀粉酶的活性,进而导致淀粉含量显著高于对照。EBR 提高了盐胁迫下黑麦草种子的α-淀粉酶活性,进一步促进了淀粉的代谢分解,最终降低了黑麦草的淀粉含量。
植物对盐胁迫的适应性和耐受性涉及复杂的生理生化反应、代谢途径和信号调控网络,包括分子、代谢和生理水平上对盐胁迫的各种适应性反应[25-26]。有研究表明,盐胁迫能导致植株幼苗活性氧代谢失调并引发膜脂过氧化作用,进而使得植株幼苗生长受到抑制[27]。本研究利用有机营养土种植黑麦草幼苗,通过叶面喷施EBR 显著缓解了250 mmol·L-1NaCl 处理对黑麦草幼苗生长的抑制效果。正常生长条件下植物体内的活性氧代谢处于动态平衡状态,当植物遭受逆境胁迫时,就会产生过多的活性氧(reactive oxygen species,ROS),进而对植物造成伤害。盐胁迫下产生的过多ROS 能引起植株细胞膜脂过氧化,MDA 是膜脂过氧化产物,其含量的高低是反映细胞膜脂过氧化作用强弱和质膜破坏程度的重要指标[18]。本研究中NaCl 胁迫显著提高了黑麦草体内MDA 含量,而添加EBR 显著降低了NaCl胁迫下黑麦草体内MDA 的含量,表明NaCl 胁迫增加了黑麦草体内膜脂过氧化程度,而EBR 降低了NaCl 胁迫下黑麦草体内膜脂过氧化程度,进而对黑麦草体内细胞完整性起到较好的保护作用。植物在进化过程中形成了活性氧清除系统用于防御胁迫产生的活性氧伤害。活性氧清除的主要酶类,能有效地清除植物体内过量的自由基,增强植物适应胁迫的能力。本研究进一步发现,黑麦草体内的SOD、POD、CAT、APX 等主要保护酶在盐胁迫下活性增强,经EBR 处理后,这些酶的活性进一步增强,进而可以有效清除盐胁迫下引起的过多活性氧对黑麦草细胞的伤害,这与EBR 显著降低了NaCl 胁迫下黑麦草体内膜脂过氧化产物MDA 含量的结果相一致。这些结果也与BRs 能通过调控渗透物质含量和抗氧化酶系统等缓解盐胁迫对燕麦(Avena sativa)种子萌发的伤害结果一致[9]。
在盐胁迫下的黑麦草幼苗经EBR 处理后,其体内渗透调节物质可溶性蛋白和可溶性糖等含量明显增加,渗透调节能力增强,进一步降低了盐胁迫引起的伤害[12]。外源EBR 降低了NaCl 依赖性脂质过氧化的程度,提高了叶片细胞的渗透势;盐胁迫下EBR 的保护作用可能与EBR 的抗氧化作用有关,通过维持细胞内离子平衡来调节植物保持水分平衡的能力[28]。本研究表明,EBR 处理促进了黑麦草体内可溶性糖和可溶性蛋白等渗透调节物质的积累,从而增强了植株在NaCl 胁迫下渗透调节的能力,最终减轻了盐胁迫对植株造成的伤害。Oliveira 等[29]研究表明,EBR 处理改善了离子平衡,减轻了盐胁迫对尾叶桉(Eucalyptus urophylla)幼苗的伤害程度,提高了组织的营养成分含量。寇江涛和师尚礼[13]研究表明,EBR 能减轻盐胁迫对苜蓿幼苗的光抑制作用,加快有机物的合成,维持植株体内离子代谢平衡,进而增强苜蓿幼苗的耐盐性。
叶绿素在植物光合作用过程中发挥着吸收、传递和转化光能的作用,而且植物叶绿素含量的高低与光合作用强弱直接相关[21]。盐胁迫会导致植物细胞中盐离子的积累,造成叶绿素代谢平衡被破坏,进而导致叶绿素降解速度加快,严重时还可能破坏叶绿体结构,最终影响植物光合作用能力的强弱[21,30]。本研究中,盐胁迫使叶绿素a、叶绿素b、总叶绿素、类胡萝卜素含量均显著下降,而应用EBR 明显缓解了光合色素含量的下降。表明EBR 可以通过缓解盐胁迫下光合色素含量的下降来提高黑麦草幼苗的抗盐性。
综上所述,本研究结果表明应用0.01 μmol·L-1EBR 溶液对黑麦草进行浸种处理,可以有效缓解100 mmol·L-1NaCl 胁迫对黑麦草种子发芽势和活力指数的影响,并提高了α-淀粉酶活性和根系活力。通过对黑麦草幼苗叶片喷施0.1 μmol·L-1EBR 溶液减轻了250 mmol·L-1NaCl 胁迫对黑麦草幼苗的伤害程度,本研究结果表明EBR 可能主要通过以下几方面来缓解盐胁迫对植物造成的伤害:一是EBR 提高了盐胁迫下黑麦草幼苗可溶性糖和可溶性蛋白含量,从而增强了盐胁迫下黑麦草幼苗的渗透调节能力;二是EBR 通过缓解盐胁迫下光合色素含量的下降来提高黑麦草幼苗的抗盐性;三是EBR 增强了盐胁迫下黑麦草幼苗的抗氧化酶活性,进而有效减轻过多活性氧对黑麦草细胞造成的伤害,从而降低了膜脂过氧化产物丙二醛的含量,最终减轻了盐胁迫对植株造成的伤害。
