人源性CC103无乳链球菌主要ST的耐药特点及分子流行特征*
2021-07-28程招敏王云秀黎小琼柯培锋
程招敏,蓝 锴,王云秀,黎小琼,柯培锋△,李 亮
1.广州中医药大学第二附属医院检验科,广东广州 510120;2.广西中医药大学赛恩斯新医药学院医学技术系,广西南宁530200
无乳链球菌又称为B群链球菌(GBS),是育龄期女性的直肠和生殖道中常见的定植菌。妊娠晚期无乳链球菌的定植,是引起产妇宫内感染和严重新生儿感染的主要原因[1]。了解育龄期女性中定植无乳链球菌的耐药特点和分子流行特征,对妊娠不良结局的防控有重要作用。通过多位点序列分型(MLST)可将无乳链球菌分为不同的序列型(ST),并归为不同的克隆群(CC)。大多数人源菌株源于5个CC(CC1、CC10、CC17、CC19、CC23)[2]。国外研究表明,CC103菌株主要引起奶牛乳腺炎[3],然而2015-2017年,国内人源性CC103菌株的分离率从1.25%增加至21.74%,尤其是ST485已成为主要的人源性ST之一,且分离率明显高于国外的报道[2-4]。然而,国内关于人源性CC103菌株主要流行的ST,以及其耐药性、分子流行病学研究鲜有报道。本研究拟对广州地区妊娠期女性定植CC103无乳链球菌的ST分布进行分析,并对其耐药性、主要耐药基因、血清型分布及主要毒力基因进行调查,旨在为该地区CC103菌株引起感染的防控提供科学依据。
1 材料与方法
1.1菌株来源 本研究收集的137株无乳链球菌均为非重复菌株,分离于2018-2019年在广州中医药大学第二附属医院就诊的妊娠期女性的阴道-直肠拭子标本。标准菌株大肠埃希菌ATCC8739和肺炎链球菌ATCC49619购于美国典型菌种保藏中心。标准菌株无乳链球菌ATCC12403和A909由南华大学陈丽丽老师惠赠。
1.2仪器与试剂 水解酪蛋白(M-H)琼脂平板和哥伦比亚血琼脂平板(江门凯琳公司)、药敏纸片(英国Oxoid公司)、细菌基因组DNA提取和Premix Taq试剂盒(大连TakaRa公司)、VITEK MS质谱仪及相关试剂(法国bioMérieux公司)、VITEK-2全自动细菌鉴定/药敏分析仪及相关检测试剂(法国bioMérieux公司)、PCR扩增仪(美国ABI公司)、核酸凝胶电泳仪及凝胶成像系统(美国Bio-Rad公司)。本实验MLST、血清学分型、耐药基因和毒力基因检测所需的引物均由上海生工生物工程股份有限公司合成。
1.3方法
1.3.1菌株复苏及鉴定 将收集的试验菌株转种于血平板上,在37 ℃、5.00% CO2条件下,孵育24 h,同时采用VITEK MS质谱仪和VITEK-2细菌鉴定仪对所有试验菌株进行鉴定。
1.3.2DNA提取 细菌基因组DNA提取参照试剂说明书的要求和操作步骤进行,提取的DNA置于-80 ℃待用。
1.3.3MLST分型 参照JONES等[5]报道的实验条件和方法,采用PCR技术对adhP、pheS、atr、glnA、sdhA、glcK、tkt等7个管家基因进行扩增,并将扩增产物送上海生工生物工程股份有限公司进行测序分析。运用MEGA6软件对所获取的所有试验菌株的同一基因进行剪齐,将经过剪齐的序列上传至MLST分型在线数据库(http://pubmlst.org/sagalactiae/),获取各菌株各管家基因的等位基因数,通过7个管家基因的等位基因数确定各菌株的序列型。用eBURST3.1软件对所有序列型进行分析并归为不同CC。
1.3.4抗菌药物敏感试验 参照2019版美国临床和实验室标准化协会(CLSI)抗菌药物敏感试验指南(http://www.clsi.org)的试验要求和药敏判断标准,检测各试验菌株对青霉素(10 μg)、红霉素(15 μg)、克林霉素(2 μg)、四环素(30 μg)、氯霉素(30 μg)、利奈唑胺(30 μg)、万古霉素(30 μg)等7种抗菌药物的敏感性。药敏试验质控菌株根据CLSI要求,采用标准菌株ATCC49619。
1.3.5耐药基因检测 采用PCR技术分别扩增CC103菌株的红霉素和克林霉素耐药基因(ermB、mefA/E、ermTR基因、linB基因),反应条件和引物采用何其励等[6]的报道,根据各菌株扩增产物的琼脂糖凝胶电泳结果确定其是否携带耐药基因。
1.3.6毒力基因检测 采用PCR技术分别扩增CC103菌株的主要毒力基因:CAMP因子基因(cfa)、α-C蛋白基因(bca)、β-C蛋白基因(bac)、5Ca肽酶基因(scpB)和层黏连蛋白基因(lmb)。引物和反应条件参照JIANG等[7]的报道,通过扩增产物的琼脂糖凝胶电泳结果确定各菌株是否携带毒力基因。
1.3.7分子血清学分型 参照IMPERI等[8]建立的方法,采用多重PCR技术,扩增荚膜多糖(CPS)合成基因,通过琼脂糖凝胶电泳确定各CC103菌株的血清型。以标准菌株ATCC12403(血清学 Ⅲ型)和A909(血清学Ⅰa型)为血清分型的参考菌株。
1.4统计学处理 药敏试验结果用WHONET5.6软件统计分析。统计学分析用SPSS22.0软件进行,计数资料以例数或百分率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1菌株鉴定 收集的137株试验菌株,均同时采用VITEK MS质谱仪和VITEK-2全自动细菌鉴定仪鉴定,其结果均为无乳链球菌。
2.2MLST分型结果 MLST分型结果如图1所示,137株无乳链球菌被分为19种ST,以ST19和ST17为主,分别占28.50%和13.10%,其他主要的ST包括ST485、ST862、ST651、ST27等,19种ST来源于7个CC。CC103占26.30%(36/137),共发现4种来源于CC103的ST,分别为ST485(9.50%)、ST862(7.30%)、ST651(7.30%)、ST103(2.20%)。此外,聚类分析显示ST485与ST862,ST651与ST103的亲缘关系更近。
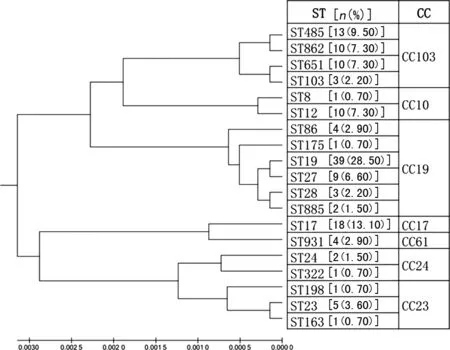
图1 19种ST无乳链球菌的聚类分析图
2.3抗菌药物敏感试验结果 137株无乳链球菌对青霉素、利奈唑胺和万古霉素均敏感(敏感率为100.00%)。CC103对红霉素、克林霉素、左氧氟沙星、氯霉素、四环素的耐药情况见表1。CC103菌株对红霉素、左氧氟沙星和四环素耐药率与非CC103菌株比较,差异均有统计学意义(均P<0.05),即CC103菌株红霉素、左氧氟沙星和四环素的耐药率低于非CC103菌株。ST651和ST862对红霉素、克林霉素和氯霉素的耐药率以及两者的多重耐药率均>60.00%。
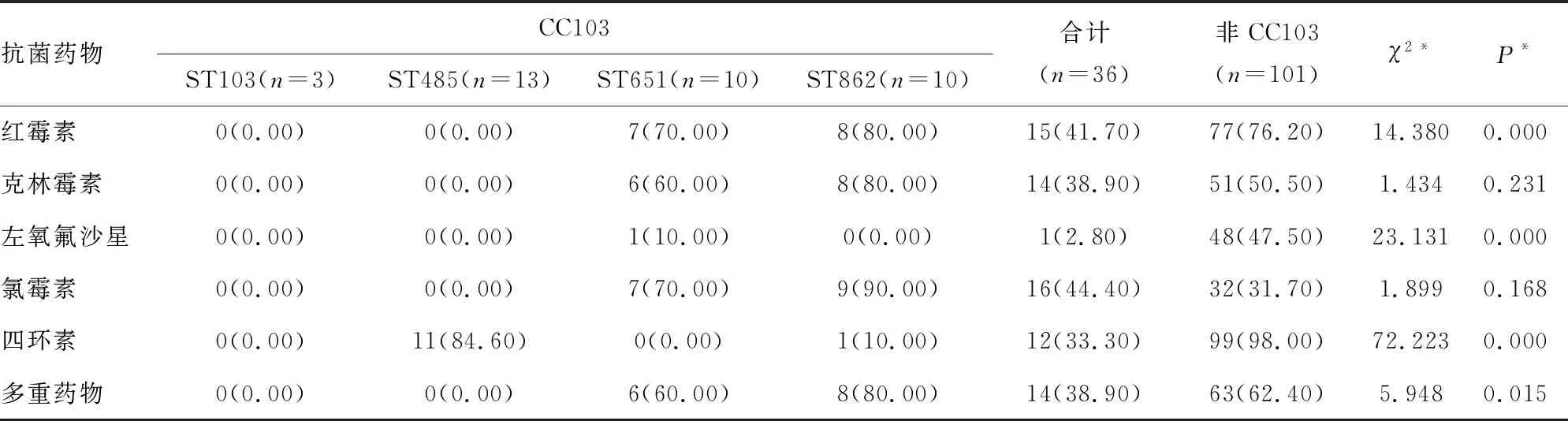
表1 人源性CC103无乳链球菌与非CC103菌株的耐药性比较[n(%)]
2.4耐药基因检测结果 耐药基因扩增后电泳图见图2。对红霉素耐药的ST651菌株ermB基因阳性率为100.00%(7/7),未检出mefA/E和ermTR两种耐药基因;对红霉素耐药的ST862菌株ermB和mefA/E基因的阳性率均为100.00%(8/8),未检出ermTR基因;对克林霉素耐药的所有CC103菌株,linB基因阳性率为100.00%(14/14)。
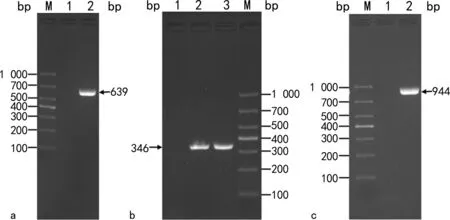
注:a为ermB基因,M为DL1000标志物,1为阴性对照,2为阳性标本;b为mefA/E基因,M为DL1000标志物,1为阴性对照,2和3为阳性标本;c为linB基因,M为DL1000标志物,1为阴性对照,2为阳性标本。
2.5分子血清学分型结果 分子血清学分型的电泳见图3。36株CC103无乳链球菌共检出Ⅰa型和Ⅲ型两种血清型,其中ST103和ST485均为血清学Ⅰa型,而ST651和ST862菌株均为血清学Ⅲ型。
注:M为DL1000标志物;1为ATCC12403无乳链球菌(血清学Ⅲ型阳性对照);2为A909无乳链球菌(血清学Ⅰa型阳性对照);3、4、6为实验菌株(血清学Ⅲ型);5为实验菌株(血清学Ⅰa型)。
2.6毒力基因检测结果 5种主要毒力基因的电泳见图4,bca、cfb、bac、scpB、lmb检出率依次为100.00%(36/36)、100.00%(36/36)、30.60%(11/36)、25.00%(9/36)和27.80%(10/36)。
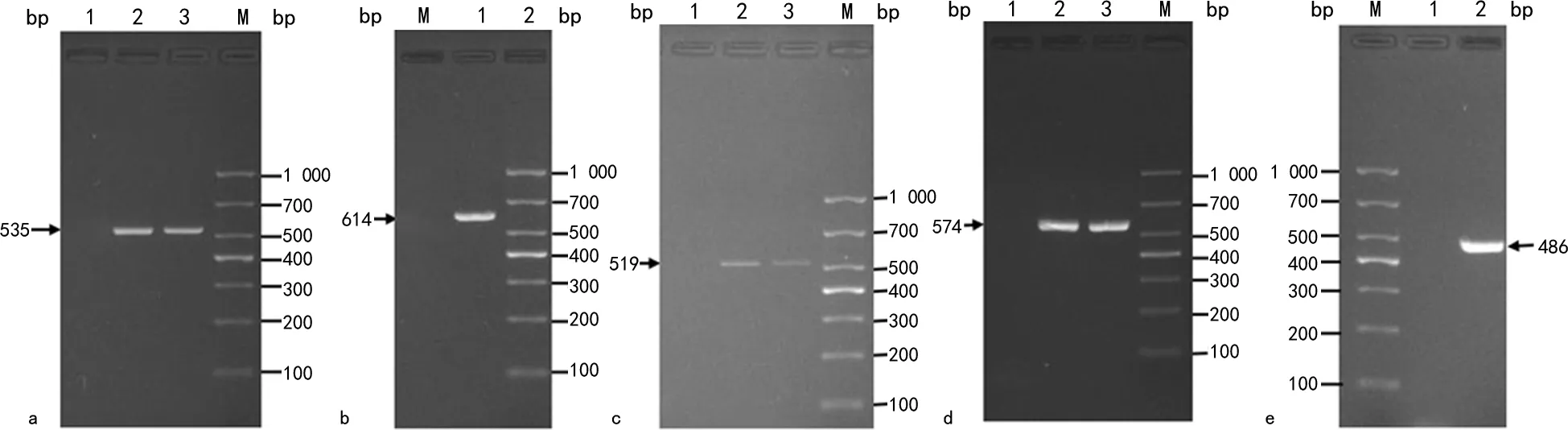
注:a为bca基因,M为DL1000标志物,1为阴性对照,2和3为阳性标本;b为cfa基因,M为DL1000标志物,1为阴性对照,2为阳性标本;c为bac基因,M为DL1000标志物,1为阴性对照,2和3为阳性标本;d为scpB基因,M为DL1000标志物,1为阴性对照,2和3为阳性标本;e为lmb基因,M为DL1000标志物,1为阴性对照,2为阳性标本。
3 讨 论
有研究表明,定植无乳链球菌的表型和基因型均存地理区域性差异,且定植无乳链球菌可引起流产、胎膜早破、产后宫内感染和新生儿感染等不良妊娠结局[9-10]。因此,了解某地区的定植无乳链球菌的ST和血清型分布、耐药性及所携带的耐药基因、毒力因子等菌群特征,对该地区无乳链球菌引起不良妊娠结局的防控至关重要。据国外文献报道,CC103菌株主要引起动物感染,以牛乳腺炎多见,人源性菌株较为少见[3]。然而,已有研究表明,人源性CC103定植菌株在我国的分离率呈上升趋势[1,2,4],但这些报道并未对CC103菌株的耐药性和分子流行病学特征进行系统性研究。本研究是首次对广州地区的人源性CC103菌株进行全面的分子流行病学调查和耐药性分析。
利用MLST对某地区的定植无乳链球菌进行分型,可了解其系统发育谱系特征。本研究共检出19种ST,来源于7个CC,这表明广州地区的定植无乳链球菌具有较高的遗传多态性。虽然本研究ST种类相对较多,但仍以ST19(28.50%)和ST17(13.10%)为主,这和来自其他地区的报道[11-12]相似。本研究通过eBURST3.1软件对所有ST进行归类分析,表明该地区CC103(26.30%)已成为仅次于CC19(42.30%)的主要定植菌株之一,CC103所占比例以及主要ST组成均与广西地区的报道[4]相似。此外,有研究报道,收集了2017年分离于广东省妇幼保健院的定植无乳链球菌72株,结果显示CC103占23.50%,且主要ST分布也和本研究相似[1]。据此,本文推测CC103是华南地区流行的主要定植株之一,且其主要ST分布相似,但这需要更多的来自于华南地区的流行病学数据才能支持该推测。研究表明,北京[12]和上海[7]地区的人源性CC103菌株以ST485或ST103为主,未发现ST651和ST862菌株,且CC103所占比例低于本研究和广西地区的报道。这表明同一CC的ST分布可能会因地理区域不同而存在差异。
目前,对于无乳链球菌引起妊娠不良结局的产时抗菌药物预防,指南多推荐采用青霉素作为首选药物[13]。本研究中的定植菌株对青霉素均敏感,这证实青霉素可作为本地区产时抗菌药物预防的经验性用药选择。对于青霉素过敏的孕妇而言,红霉素和克林霉素是其产时抗菌药物预防的重要替代药物[1]。但国内外的报道均表明无乳链球菌对两者的耐药率呈上升趋势[14-15]。本研究中,定植菌株对红霉素(67.20%)和克林霉素(47.40%)的耐药率较高,这与北京[16]、乌鲁木齐[17]、深圳[18]等国内城市相似。因此,采用红霉素或克林霉素进行产时抗菌药物预防,建议根据药敏结果选择药物。本研究中,CC103菌株对于红霉素、左氧氟沙星和四环素的耐药率以及多重耐药率均低于非CC103菌株,差异有统计学意义(均P<0.05),这表明不同CC的定植菌株耐药性存在差异。本研究中,定植菌株的耐药性差异还表现在同一CC的不同ST间,如ST103和ST485对于红霉素、克林霉素和氯霉素均敏感,而ST651和ST862对3者耐药率均>60.00%。此外,有研究表明广州地区定植菌株对四环素的耐药率较高(耐药率>80.00%)[1,19],但本研究的CC103菌株中仅ST485对四环素耐药率(84.60%)较高,而其他3种ST的耐药率均<10.00%,这也进一步表明同一CC的不同ST的耐药性的差异。无乳链球菌对红霉素耐药主要由ermB、mefA/E、ermTR基因介导,而linB基因主要是介导其对红霉素中介和克林霉素耐药[20]。耐药基因检测结果表明,ST651与ST862对红霉素的耐药机制不完全相同,前者对红霉素的耐药主要由ermB基因介导,而后者由ermB和mefA/E基因同时介导;ST651和ST862对克林霉素耐药均与linB基因有关。
无乳链球菌的荚膜多糖是其重要的毒力因子[20]。因此,根据荚膜多糖的抗原性不同对无乳链球菌进行血清学分型,对了解其致病性至关重要。此外,荚膜多糖还是疫苗设计的重要靶点[20],了解某地区的无乳链球菌血清型分布,对开发适用于该地区的荚膜多糖疫苗有重要价值。分子血清学分型结果表明,本研究中人源性CC103菌株的ST有与其相对应的特定血清型,如:ST103和ST485均为Ⅰa型,ST651和ST862菌株均为Ⅲ型,这与WANG[2]报道相似。无乳链球菌的致病性不仅取决于荚膜多糖,还与多种毒力因子相关[18]。本研究共检测了参与编码黏附、侵袭及免疫逃逸相关蛋白的5种主要毒力基因(bca、cfb、bac、scpB、lmb),结果显示,与侵袭力相关的毒力基因bca和cfa存在于所有CC103菌株中,而bac、scpB、lmb的检出率均<33.00%。此外,特定ST的CC103菌株毒力基因谱相对固定,且不同ST毒力基因谱存在差异。换而言之,部分毒力基因分布因ST而异,如:参与宿主细胞黏附的毒力基因lmb主要分布于ST103和ST862;与免疫逃逸相关的毒力基因bac主要分布于ST651。
综上所述,广州地区的定植无乳链球菌具有较高的遗传多态性,CC103菌株已成为该地区流行的主要的人源性CC之一。该地区人源性CC103菌株主要由ST103、ST485、ST651、ST862组成,其中ST651和ST862对红霉素和克林霉素的耐药率较高,但对红霉素耐药的机制不同。此外,4种ST的血清型和毒力基因分布存在差异。总体上,本研究初步阐明了广州地区人源性CC103无乳链球菌的主要ST分布、耐药特点和分子流性特征。但相对于广州地区的庞大人口基数而言,本研究收集的样本量相对较少,若要深入了解该地区人源性CC103菌株的耐药特点和分子流行特征,尚需扩大样本量进一步研究。
