磷化氢生物净化体系的微生物特性及过程强化
2021-07-28刘树根任林苏福家董占能
刘树根,任林,苏福家,董占能
(昆明理工大学环境科学与工程学院,云南昆明 650500)
除水体沉积物、湿地沼泽[1-2]等自然源外,磷化氢(PH3)也广泛产生于黄磷制备[3]、乙炔生产[4]、粮食薰蒸[5]、垃圾填埋[6]等过程。工业尾气中磷化氢浓度有时高达1100mg/m3[7],一般通过燃烧、吸附[8]、化学吸收[9]、催化转化[10]、光化学氧化[7]方式净化处理。受工艺设备腐蚀、催化剂再生困难、净化成本偏高等因素制约,垃圾填埋场、污水处理厂等产生的低浓度磷化氢尾气(浓度通常低于1mg/m3)并没有采用现有技术进行净化处理,其任意排放势必污染周围环境、危害人体健康。
生物法净化磷化氢尾气的有效性已经得到验证[11-12],碳源、pH、进气中磷化氢浓度等因素明显影响尾气净化效果。相比活性污泥体系,生物滴滤塔内的填料往往对磷化氢具有较强的基体吸附作用,且微生物种群结构更为丰富[12],磷化氢去除效果因而明显提升。磷化氢具有较强的生物毒性,浓度较高时,生物体内氧自由基浓度明显上升,引起细胞膜和其他结构中脂类过度氧化,从而抑制生物活性[11]。但低浓度磷化氢能诱导抗氧化酶活性的升高,对细胞增长具有一定的刺激作用[13],例如水稻生长过程中,根系土壤中的碱性磷酸酶随磷化氢浓度和暴露时间的增加而增加,反映出一定浓度的磷化氢对土壤磷表现出活化效应[14]。最新研究同时表明,生物净化体系中添加活性氧清除剂时,氧化酶活性得以增强,生化反应器内磷化氢去除效率明显提升。
目前,低浓度磷化氢尾气的生物净化已经颇受关注,在生化体系工艺参数优化[11]、气态磷化氢生物转化过程与机理[15]方面已经进行了诸多探索。但磷化氢难溶于水的特性如何影响生物转化效果、磷化氢降解功能微生物理化特性、能否有效分离或纯化鲜有报道。本研究从磷化氢长期驯化的活性污泥体系中分离纯化对磷化氢有耐性或降解作用的单一菌株,并对其典型特征进行对比测试,探究磷化氢净化过程中磷形态及其浓度转化规律。此外,从增强气-液传质效果的角度出发,在单一菌株形成的活性污泥体系中添加炭基材料以提升磷化氢净化效果。本研究为磷化氢生物净化体系的微生物特性分析、过程强化等提供技术支撑及理论指导。
1 材料与方法
1.1 功能微生物的分离与纯化
从驯化后[11]连续运行5 个月的磷化氢生物净化活性污泥体系中选取微生物样本,对其进行梯度稀释后,均匀涂布于固体培养基平板之上。将平板置于定制的培养箱中,每隔8h 连续通入10~12mg/m3的磷化氢气体4h,于25℃条件下培养3~5d。根据菌株的颜色、形状、大小、透明度等特征,采用平板划线法对典型菌株进行2~3次分离纯化,筛选具有磷化氢耐性或降解性能的单一菌株。
固体培养基的制备[11]:葡萄糖5g,(NH4)2SO40.5g, MgSO4·7H2O 0.3g, NaCl 0.3g, KCl 0.3g,FeSO4·7H2O 0.03g,MnSO4·H2O 0.03g,K2HPO4·3H2O 0.006g,酵母粉5g,琼脂20g,蒸馏水1000mL,采用5mol/L NaOH 溶液调整体系pH 至7.2,之后于116℃条件灭菌30min。
1.2 单一菌株对磷化氢的去除特性
利用有效容积为6L的微生物发酵装置对纯化后的单一菌株M1~M5进行增殖培养,其培养液参照固体培养基成分不添加琼脂的方式配制。当发酵装置中生物量达到850~1000mg/L时取微生物菌液开展后续试验,采用动态配气法配制待处理的磷化氢尾气。磷化氢、干空气、氮气在缓冲瓶内充分混合后送入有效容积为2L的净化吸收装置,混合气的进气流量为100mL/min,磷化氢浓度为12~15mg/m3;净化吸收反应器置于25℃、100r/min的恒温水浴摇床中,生物体系净化磷化氢尾气工艺流程如图1 所示。批式运行过程中,定期监测吸收装置进、出口气体中磷化氢浓度,对比不同菌株对磷化氢生物去除效果的差异。之后,选择两类磷化氢去除效果高的菌株开展半连续运行试验,每24h移出250mL吸收液,随即加入等体积营养液,并调整pH 至起始设定值7.2,重点考察碳源与磷源对磷化氢生物净化效果的影响。
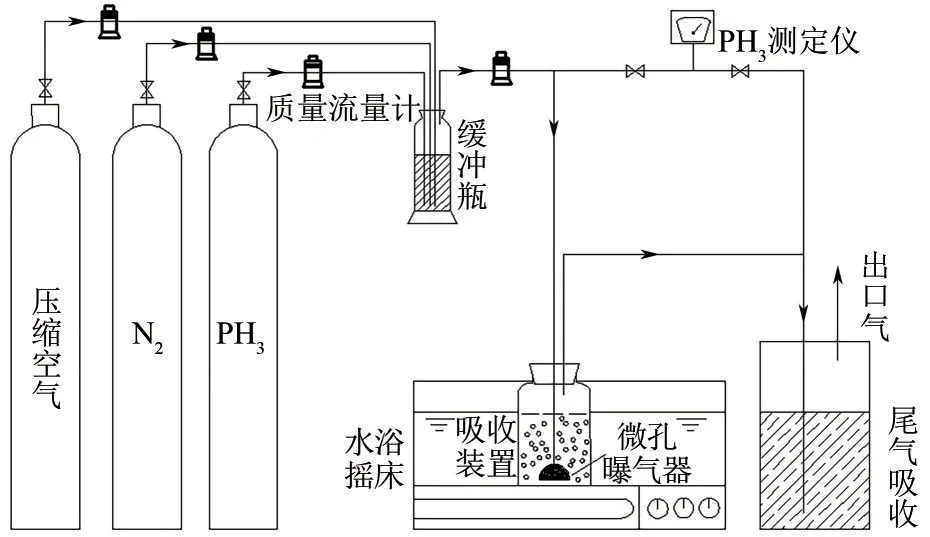
图1 磷化氢尾气生物净化工艺流程
1.3 碳基材料耦合生物体系对磷化氢的净化效果
对M4、M5菌株分别进行增殖培养:培养液以6.38g/L 的乳酸钠为碳源,以磷化氢为唯一磷源,配制的磷化氢混合气进气流量为300mL/min,磷化氢浓度4~5mg/m3;培养液其他组分按上述固体培养基配制,但不含琼脂、葡萄糖与K2HPO4·3H2O。取微生物发酵液2L 形成磷化氢尾气吸收体系,加入竹炭或椰壳基活性炭6g,4个吸收体系分别命名为RM4-竹炭、RM4-椰壳炭、RM5-竹炭、RM5-椰壳炭。鉴于碱性环境更有利于磷化氢的吸收[7],且添加乳酸钠为碳源的吸收体系pH 通常维持在碱性水平,耦合体系的吸收液pH初始值设定为9.0;每次移出吸收液并加入等体积培养液后,再次调整pH 至初始值,其余操作与1.2节所述方法相同。
1.4 分析测试方法
采用紫外可见分光光度计(HACH-DR600,美国哈希公司)于波长600nm处测试微生物增殖培养液以及净化体系吸收液的吸光度,间接反映微生物的生长状况。采用重量法分析微生物发酵液以及吸收液中的生物量,液相体系的pH 采用pH 计(PHS-3C,上海雷磁仪电公司)直接测定。所有物化指标均进行3次平行测试。
将收集的吸收液于12000g 条件下高速离心10min,上清液中化学需氧量(COD)以及正磷酸盐、总磷均按《水和废水监测分析方法》[16]测试,次磷酸盐采用离子色谱(IC2800,北京东西分析仪器公司)测定;吸收液经超声仪(Scientz-750F,宁波新芝生物科技公司)破碎处理5min 后,采用过硫酸钾消解-钼锑抗分光光度法[16]测定总磷含量。
采用气相色谱仪(GC-9790plus,浙江福立仪器公司)检测气相中磷化氢浓度[11],确定吸收体系对磷化氢的净化效果。采用比表面积及孔径分析仪(NOVA4200e,美国Coulter公司)测定炭基材料的比表面积。吸收体系的气液传质吸收速率[17-18]通过双驱动搅拌吸收器(JCH-501,华南理工大学实验仪器公司)予以测定,该反应器内上下各有一对独立搅拌浆,通过不同的驱动器进行控制,气相转速为300r/min,液相转速为150r/min,磷化氢进气流量100mL/min。前期实验表明,微生物体系中磷化氢去除率在90min 将下降至95%[15],因此测定气液传质吸收速率时吸收时间设定为2h。体系的磷化氢吸收速率计算如式(1)。

式中,N为吸收速率,mg/(m2·s);C0与C分别为进、出口气体中磷化氢质量浓度,mg/s;A为气液两相的传质面积,即双搅拌器横截面积2.64×10-3m2。
2 磷化氢降解功能微生物的特性分析
2.1 纯化菌株的典型特征
经3 次平板划线分离,得到5 株具有典型菌落特征的磷化氢耐性微生物。M1 号菌株的菌落边缘不规则,有白色绒状突起;M2 号菌株菌落较大,橙红色;M3号菌株呈灰白色,菌落较小;M4号菌株菌落较大、不透明、边缘整齐;M5 号菌株呈暗黄色,个体具有不规则短杆形状。
将M1~M5 菌株分别增殖培养后收集微生物样本,由北京诺禾生物公司完成提取基因组与高通量测序。以上5 个生物样本的基因组与NCBI(National center for biotechnology information)基因数据库进行同源性比较,其聚类分析结果表明:M1~M5菌株分别与微生物拟杆菌属(Bacteroides)、产甲烷菌属(Methanogenium)、金黄杆菌属(Chryseobacterium) 、 寡 养 单 胞 菌 属(Stenotrophomonas)、片球菌属(Pediococcus)具有极高的相似度。已有研究表明,寡养单胞菌属微生物广泛分布于水体、土壤、植物根系中,对苯系物、有机磷农药等具有良好的降解效果[19];该类微生物表面具有烃类物质、羧基、磷酸基团,可作为微生物捕收剂对废渣中的赤铁矿具有良好的浮选效果[20]。M5 菌株与Pediococcus pentosaceus相似度高,该类微生物具有生长繁殖速度快、环境耐受度高等特征,能显著降低12h菌液氨离子浓度、24天氨气排放量,也是理想的降氨除氮菌株[21]。
2.2 不同菌株对磷化氢尾气的净化效果
M1~M5 菌株增殖培养后,取2L 微生物菌液移入图1所示的尾气吸收装置,考察不同菌株对磷化氢生物去除效果的差异。在15 天的批式运行中,由分离、纯化菌株形成的5个活性污泥体系磷化氢去除率均呈缓慢下降趋势,但仍然维持有一定程度的磷化氢净化效果。相比而言,M4、M5两类菌株形成的活性污泥体系磷化氢去除率更高,生物净化效果更明显(图2)。由纯化菌株形成的活性污泥体系最高的磷化氢去除率均不超过36%,低于驯化的活性污泥体系中磷化氢去除率可达78.0%的前期水平[11],这也反映出复杂的微生物种群结构对高生物毒性的磷化氢尾气净化更为有利。鉴于M4、M5菌株对磷化氢尾气有更好的净化效果,后续研究均将这两类菌株进行增殖培养并在不同条件下开展系列试验。

图2 五类菌株对PH3尾气的净化效果
2.3 碳源对净化体系的影响
以M4、M5菌株为对象,考察葡萄糖、柠檬酸钠和乳酸钠3类典型碳源对活性污泥体系磷化氢净化效果的影响。微生物增殖培养时,培养液中碳源与磷源分别为葡萄糖与K2HPO4·3H2O,其各自的含量为5g/L与0.006g/L,体系pH为7.2。当2L微生物发酵液分别移至吸收装置后,启动半连续运行对比试验,每24h移出250mL吸收液,随即加入等体积不同碳源的营养液(葡萄糖3.86g/L、柠檬酸钠8.24g/L、乳酸钠6.38g/L;均不含磷化合物,其余成分与增殖培养液相同),并调整pH 至7.2。本试验污泥停留时间(SRT)设定值为8 天,微生物体系往往在8天左右开始逐步适应其生存环境,故本研究自第7天开始测试吸收装置碳、磷等指标,运行12~13天后,磷化氢去除率、吸收液磷含量、体系pH等指标逐步趋于稳定(图3)。采用的碳源不同时,吸收体系呈现出不同的磷化氢去除效果;在添加的营养液COD 相同条件下,以乳酸钠为碳源对磷化氢的生物净化最为有利。相比M4菌株,M5菌株形成的活性污泥吸收体系具有更高的磷化氢去除效果;当运行时间为13~21天时,以乳酸钠为碳源的M5 菌株对磷化氢的最大去除率达到37.9%[图3(a)]。
以葡萄糖、柠檬酸钠、乳酸钠为碳源时,无论是M4 菌株还是M5 菌株形成的生物净化体系磷化氢去除率均依次上升;上清液中COD 浓度反而呈降低趋势,以乳酸钠为碳源的M5菌株吸收体系上清液COD浓度始终保持在相对最低的水平[图3(b)]。可见,生物吸收体系中碳源的代谢与利用明显影响磷化氢尾气的净化效果,磷化氢的去除率与生物吸收体系剩余COD呈现明显的负相关性。
以葡萄糖为碳源,生物吸收体系上清液中正磷酸盐含量通常较低;而以乳酸钠为碳源时,RM4,Na-LA与RM5,Na-LA生化反应器均维持相对更高的正磷酸盐含量[图3(c)],这与两个吸收体系有较高的磷化氢去除率密切相关。尽管RM5,Na-CA与RM5,glu吸收体系磷化氢去除率均高于RM4,Na-LA与RM4,Na-CA,但其上清液正磷酸盐含量却反而相对较低,其原因分析如下:生物净化体系中,磷化氢经基体吸附、生物氧化后可转化为正磷酸盐[15],导致吸收液中磷酸盐含量上升;另一方面,微生物在好氧环境中通过同化代谢将磷吸收至生物体内,上清液中的正磷酸盐因而相应下降。
净化体系连续运行过程中,每次移除定量吸收液并补充等体积营养液时,pH 均调整至初始设定值7.2。以葡萄糖为碳源的RM4,glu与RM5,glu两个吸收体系均在运行24h 后pH 下降至5.6~6.2 的酸性水平[图3(d)]。相反,其他碳源的另外4 个吸收体系pH维持在9.0±0.3 碱性水平。虽然碱性环境比酸性环境更有利于磷化氢的吸收[7],但大多数微生物的生长与代谢在pH<6.5 或者pH>7.5 的环境中均会受到不同程度的抑制[22],磷化氢生物净化体系以pH 中性或弱碱性条件下运行为宜。综合考虑磷化氢去除率、碳源代谢与利用、吸收液中磷浓度与pH变化,磷化氢生物净化体系最适宜碳源为乳酸钠;若以葡萄糖为碳源,吸收液酸化现象甚为明显,碳源利用率较低,磷化氢净化效果相对较差。

图3 碳源对典型菌株磷化氢净化体系的影响
2.4 磷源对净化体系的影响
将M4、M5 菌株进行增殖培养,培养液以6.38g/L 乳酸钠为碳源;磷源分别为NaH2PO20.0015g/L、 Na2HPO30.002g/L、 K2HPO4·3H2O 0.003g/L;其余成分参照1.2 节配制。试验启动进程中,每24h移出吸收液后,加入等体积不同磷源的增殖培养液,其他工艺条件及操作与前述一致。磷源相同时,M5菌株形成的生物净化体系较M4菌株体系磷化氢去除率相对更高;当相同物质的量的次磷酸盐、亚磷酸盐、正磷酸盐分别加入吸收液时,磷化氢去除效果以正磷酸盐体系最高、亚磷酸盐体系次之、次磷酸盐体系最低[图4(a)]。以上变化规律表明,吸收液中适当添加高价态的磷化合物有利于提升磷化氢的生物净化效果。
磷源系列试验连续运行时,培养液中不同形态的磷换算为总磷时其含量均为0.5mg/L,明显低于生物吸收体系的吸收液泥水混合物总磷浓度[图4(b)]。理论上讲,吸收装置每天移出250mL吸收液并加入等体积增殖培养液将使得吸收液泥水混合物总磷浓度呈下降趋势,但6个生物吸收装置在7~15天期间泥水混合物总磷浓度维持较高水平且稍有上升,可以推断,气态磷化氢经生物作用已经持续转入吸收体系。
从图4(c)可以看出,分别添加亚磷酸盐与磷酸盐的RM4,P+3、RM4,P+5、RM5,P+3、RM5,P+5吸收体系均可以检测到次磷酸盐,且其含量高于每天添加含次磷酸盐增殖培养液的RM4,P+1、RM5,P+1两个净化体系。磷源系列试验中,增殖培养液中折算的总磷浓度均为0.5mg/L,6个吸收装置连续运行时,上清液中总磷均明显高于理论核算值[图4(d)],且磷化氢去除效果越好时总磷浓度相应越高;RM5,P+5吸收体系在11~15 天磷化氢平均去除率为36.5%,上清液中总磷与次磷酸盐平均浓度分别为7.3mg/L与0.82mg/L,泥水混合液总磷平均值为15.5mg/L。磷浓度变化表明,次磷酸盐是磷化氢生物氧化的必然产物,磷化氢从气相转入吸收体系后大部分以磷化合物形式储存至微生物体内。
磷化氢分子中磷的化合价为-3价,磷化氢可在弱氧化剂作用下最终转化为磷酸盐[23]。中性条件下,含磷化合物H2/PH3、PH3、H2、/的氧化还原电位分别为-0.66V、-0.76V、-0.74V、-0.65V[15]。氧化氛围中,磷化氢转化为次磷酸盐或亚磷酸盐、次磷酸盐转化为亚磷酸盐、亚磷酸盐转化为正磷酸盐理论上均可以实现。将高生物毒性的磷化氢代谢转化为次磷酸盐,微生物对磷化氢的耐性或抵抗能力将明显增强。但次磷酸盐对水生生物同样具有轻微危害[24],只有当其转化为更高价态的其他磷化合物时,次磷酸盐的潜在不利影响才得以消除。从氧化还原反应历程看,次磷酸盐的直接氧化产物为亚磷酸盐,进一步的氧化产物为正磷酸盐。正磷酸盐可在好氧条件下经生物代谢作用被生物体吸收;亚磷酸盐通常难以被微生物转化[25-26],且其结构与正磷酸盐相似而对生物代谢进程产生抑制作用。因此,吸收液中添加正磷酸盐时,生物净化效果将更为明显,RM5,P+5吸收体系磷化氢去除率维持在34.0%~36.8%的较高水平。

图4 磷源对典型菌株磷化氢净化体系的影响
3 磷化氢生物净化体系的过程强化
3.1 添加炭基材料促进磷化氢净化效果
炭基材料耦合生物体系净化磷化氢的试验结果(图5)表明,竹炭添加至活性污泥体系时,磷化氢去除率较原来的生物净化体系稍有提升,但并不明显;添加椰壳基粉末炭的生物体系,磷化氢去除效果明显增强,运行时间11~15 天时,RM5,椰壳炭与RM4,椰壳炭吸收装置中磷化氢去除率分别高达67.3%、55.1%,M5 菌株生物体系在添加椰壳基炭材料后,其耦合体系的磷化氢净化效果依然高于RM4,椰壳炭吸收体系。

图5 添加炭基材料对磷化氢去除率的影响
对竹炭、椰壳基炭材料进行比表面积测试,这两种炭基材料的N2吸附均为典型的Ⅰ型等温线,炭基材料以微孔为主[27],核算得到的比表面积分别为竹炭66.7m²/g,椰壳基炭766.6m²/g。椰壳基炭表面微观结构更为粗糙,孔隙结构更为发达,有利于增强磷化氢的基体吸附作用[7,15]、减小难溶气体磷化氢的传质阻力,从而促进生物体系对磷化氢的转化作用效果。
3.2 耦合体系中磷化合物变化
添加炭基材料后,混合吸收体系中磷含量变化如图6 所示。整体来讲,各吸收体系混合液总磷[图6(a)]高于相应的上清液总磷[图6(b)],而上清液总磷又高于上清液正磷酸盐含量[图6(c)]。另外,4个吸收体系中均可以检测到次磷酸盐存在[图6(d)]。在测试的7~15天,RM5,椰壳炭吸收装置内混合液总磷含量明显高于其他3个吸收体系[图6(a)],这与该生物体系维持相对最高的磷化氢去除效果(图5)完全一致。虽然耦合体系均以磷化氢为唯一磷源,但吸收液中次磷酸盐、正磷酸盐均可同时检测,这一结果再次证明,好氧条件下磷化氢可以氧化为次磷酸盐等含高价磷化合物。
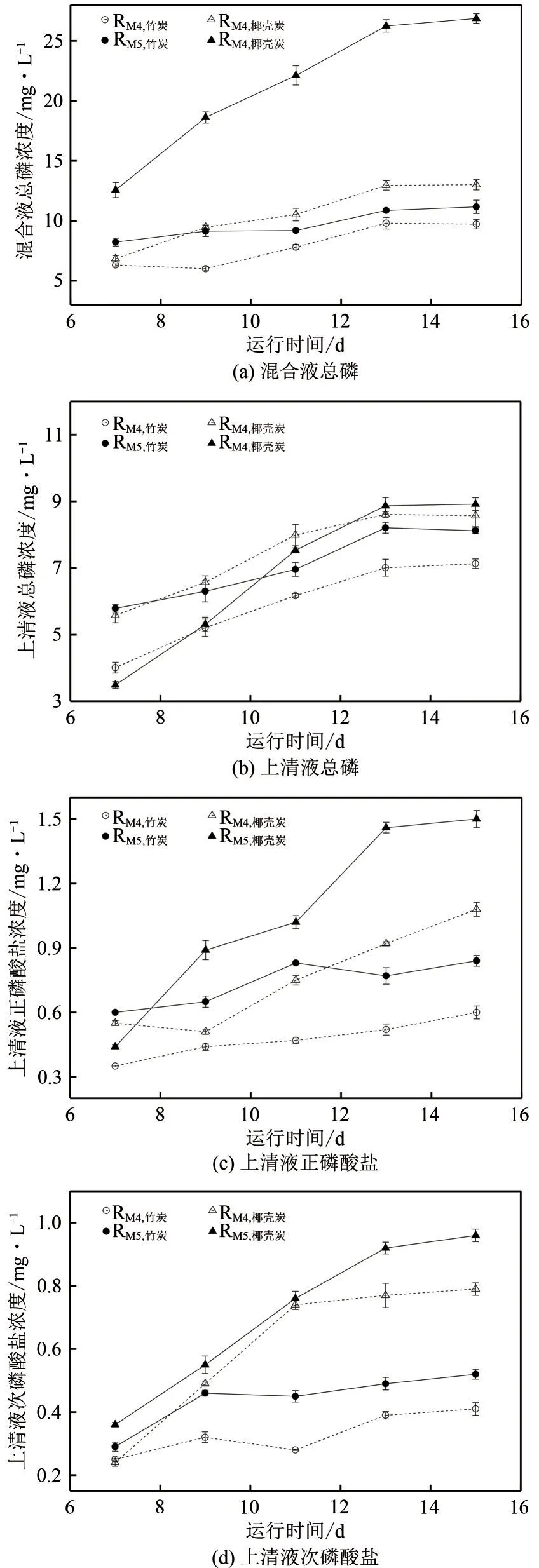
图6 耦合体系中磷含量变化
运行时间为13~15 天时,4 个耦合吸收体系RM5,椰壳炭、RM5,竹炭、RM4,椰壳炭、RM4,竹炭混合液总磷平均含量分别为26.6mg/L、11.0mg/L、12.9mg/L、9.8mg/L,其相应的上清液总磷平均浓度分别为8.9mg/L、8.1mg/L、8.6mg/L、7.1mg/L。可以看出,吸收液中部分转化的磷已经为生物体所同化或为炭基材料所吸附。相比上清液总磷,各吸收装置中上清液正磷酸盐浓度均不超过1.5mg/L,反映出其他形态的磷,如亚磷酸盐在液相中也有较高含量。RM5,椰壳炭与RM4,椰壳炭耦合吸收体系启动时生物量、投加的椰壳炭基材料相同,运行过程中上清液总磷浓度基本接近,但混合液总磷浓度却差异明显,以上研究表明:M5 菌株生物体系具有更好的嗜磷作用,其椰壳炭耦合微生物的混合体系具有极为不错的磷化氢生物净化效果。
3.3 生物净化体系磷化氢吸收速率分析
测定炭基材料-微生物耦合体系的磷化氢吸收速率,并与微生物体系、营养液吸收磷化氢进行对比。测试结果如表1 所示,椰壳炭-微生物耦合体系中磷化氢吸收速率最高,达到0.0552mg/(m2·s),较营养液-微生物体系中磷化氢吸收速率提升23.8%;生物体系中添加竹炭或椰壳炭后,磷化氢吸收速率均有所提升,也明显高于营养液体系中磷化氢吸收速率0.0423mg/(m2·s)。已有研究表明:磷化氢生物净化过程与生物吸附、生物转化两个过程均密切相关[15]。虽然磷化氢为难溶气体,气液传质将成为限制其高效净化的重要因素;但磷化氢具有较强的基体吸附作用[2,7];活性污泥生物净化体系在微生物被NaN3抑制活性后,连续运行89min时磷化氢净化效率才开始下降至95%[15]。相比竹炭,椰壳炭材料具有更为发达的孔隙结构、较高的比表面积,其投加至生物吸收体系后,磷化氢更容易从气相转入液相吸收体系,其吸收速率明显增强,因而提升了耦合体系对该高毒有害气体的净化作用效果。
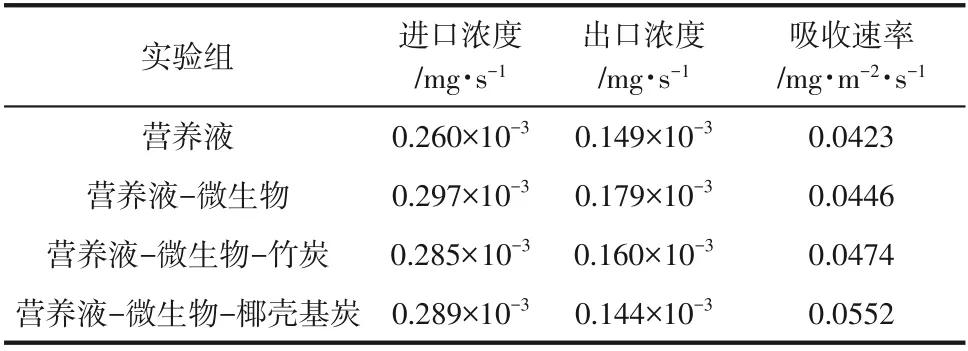
表1 不同吸收体系中PH3浓度及吸收速率比较
4 结论
(1)从磷化氢长期驯化的活性污泥体系中分离得到5 株对磷化氢有耐性或降解作用的典型菌株M1~M5,分别与拟杆菌属(Bacteroides)、产甲烷菌 属 (Methanogenium) 、 金 黄 杆 菌 属(Chryseobacterium) 、 寡 养 单 胞 菌 属(Stenotrophomonas)、片球菌属(Pediococcus)具有极高的相似度,M4、M5菌株形成的活性污泥体系对磷化氢去除率较高。
(2)M4、M5菌株最适碳源为乳酸钠,最适磷源为正磷酸盐,葡萄糖作为碳源会导致吸收液酸化现象明显,对磷化氢净化效率相对较差。生物净化体系以磷化氢为唯一磷源;相比次磷酸盐与亚磷酸盐,适当添加正磷酸盐更有利于生物净化进程,吸收体系磷化氢去除率可达36.8%的较高水平。
(3)单一菌株形成的生物体系中磷化氢去除率通常不超过37%,添加椰壳基炭材料可有效促进生物体系对磷化氢的净化作用效果,耦合体系中磷化氢吸收速率达到0.0552mg/(m2·s),去除率提升至67.3%。
