GDF15激活ERK/Bcl-2通路增强BM-MSCs放射抗性
2021-07-28张小梅李忠俊张克斌
吴 春,张小梅,向 阳,冉 茜,李忠俊*,张克斌
1陆军军医大学第二附属医院检验医学中心(输血科)放射生物学实验室,2临床医学研究中心,重庆 400037
随着放射技术在军事、医药和其他行业的大量应用,急性放射综合征(acute radiation syndrome,ARS)的研究也越来越受到人们的重视。放射造成造血系统损伤,导致骨髓造血功能障碍,严重时可危及生命。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)作为骨髓造血微环境的重要组成部分,其自身及其后代子细胞可为造血干细胞(hematopoietic stem cells,HSCs)提供物理支撑。此外,BM-MSCs也可通过分泌多种造血/细胞因子,对HSCs 的自我更新、分化及骨髓定植均发挥重要作用[1-3]。目前认为,相较于HSCs,BM-MSCs具有较强的放射抗性,其相关的放射抗性机制主要包括:DNA损伤的有效识别,双链断裂修复及细胞凋亡逃逸等,但目前其具体机制尚未被完全阐明[4]。鉴于BM-MSCs的存活可为放射损伤后造血重建提供基质干细胞基础,因此,深入研究其放射抗性机制,对探索骨髓型急性放射病救治的新策略具有重大意义。
生长分化因子15(growth differentiation factor 15,GDF15)是转化生长因子β(transforming growth factor β,TGF-β)超家族中的一员,在各种细胞和组织中广泛分布,伴随着不同的应激反应,如炎症、心脏缺血再灌注、急性组织损伤、放射、癌症等,GDF15的表达会大幅增加[5-9]。既往研究表明,GDF15在部分癌细胞中高表达,并且在癌症的不同进展阶段具有促凋亡和抗凋亡两种效应[10-12]。本课题组前期研究结果显示,BM-MSCs 放射后,GDF15 的表达显著升高[13],其是否在BM-MSCs的放射抗性中发挥关键作用,目前尚不清楚。本研究考察了放射后上调的GDF15表达在BM-MSCs放射抗性中的作用,并初步探讨了其可能作用机制。
1 材料和方法
1.1 材料
人BM-MSCs、人BM-MSCs 培养基(ScienCell 公司,美国),人GDF15 干扰片段(广州锐博生物科技有限公司),逆转录试剂盒、SYBR Premix Ex TaqⅡ试剂盒(大连宝生物工程有限公司),Western blot转膜液、一抗稀释液、二抗稀释液、封闭液、RIPA 细胞裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶电泳配制试剂盒、线粒体膜电位检测试剂盒JC-1(上海碧云天生物技术有限公司),PCR 引物(上海生工生物工程股份有限公司),PI staining 检测试剂盒、Annexin V-PE/7AAD 凋亡检测试剂盒(BD 公司,美国),CCK-8(同仁化工,日本),Lipofectamine 3000试剂(Invitrogen 公司,美国),GDF15、p-ERK1/2、ERK1/2 抗体(Abcam 公司,美国),Caspase3、Cleaved caspase3 抗体(CST 公司,美国),Bcl-2、Bax、β-actin抗体(上海碧云天生物技术有限公司)。
1.2 方法
1.2.1 细胞培养
BM-MSCs使用专用BM-MSCs培养基培养,原代细胞复苏于T-75 细胞培养瓶中,37 ℃,5%CO2的培养箱中培养,视为P1代细胞。细胞融合度达到85%~90%,1∶3传代为P2代细胞。本研究使用P6~P10代细胞进行后续细胞实验。
1.2.2 细胞分组及放射处理
实验分为3组:空白对照组、干扰对照组和干扰GDF15组。采用Co-60 γ射线对细胞进行放射处理,处理剂量为9 Gy,剂量率为0.65 Gy/min[14]。
1.2.3 GDF15 siRNA干扰片段转染BM-MSCs
取对数生长期的细胞,接种于6孔板中,融合度在70%。按Lipofectamine 3000 试剂说明书的比例配比各试剂,室温孵育15 min,加入6 孔板中,24 h后收集细胞检测mRNA 的表达,72 h 后收集细胞检测蛋白的表达。GDF15干扰片段靶序列如下:干扰片段1:5′-CCATGGTGCTCATTCAAAA-3′;干扰片段2:5′-GACTCCAGATTCCGAGAGT-3′;干扰片段3:5′-CCAACTGCTGGCAGAATCT-3′。
1.2.4 蛋白免疫印迹分析(Western blot)检测蛋白表达
收集细胞,PBS洗1次,加入RIPA裂解液提取细胞总蛋白;冰上裂解30 min,10 000g4 ℃离心15 min,收上清;BCA 蛋白浓度测定试剂盒进行蛋白浓度测定,加入1/5体积蛋白上样缓冲液,煮沸10 min,使蛋白变性。根据目的蛋白分子量配制浓度为12%的SDS-PAGE凝胶,按照30 μg总蛋白上样,100 V 电泳,200 mA 转膜;5%BSA 室温封闭1 h,一抗孵育4 ℃过夜,抗体使用浓度:GDF15抗体(1∶1 500)、p-ERK1/2、ERK1/2、Caspase3、Cleaved caspase3、Bcl-2、Bax、β-actin 抗体(1∶1 000),TBST 洗膜3 次,二抗室温孵育2 h,洗膜3次,ECL显影曝光并拍照,实验重复3次。
1.2.5 RT-qPCR检测mRNA水平
收集细胞,每管加入1 mL TRIzol试剂提取细胞总RNA,移液枪反复吹打直至无明显沉淀,室温裂解30 min;加入上述裂解液体积1/5 的氯仿,涡旋室温静置15 min,10 000g4 ℃离心15 min;取上层无色液体转移至新的无酶EP管中,向上述无色液体中加入同等体积异丙醇,混匀室温静置10 min,10 000g4 ℃离心10 min,弃上清;加入800 μL 75%乙醇清洗沉淀,7 500g4 ℃离心10 min,弃上清,室温干燥沉淀;加入20 μL DEPC 水,溶解RNA,测RNA 浓度。按照TaKaRa 的逆转录试剂盒说明书操作步骤反转录得到cDNA,进行RT-qPCR。引物序列:GDF15上游:5′-GACCCTCAGAGTTGCACTCC-3′,下游:5′-GCCTGGTTAGCAGGTCCTC-3′;β-actin 上游:5′-AGCCTCGCCTTTGCCGA-3′,下游:5′-CTGGTGCCTGGGGCG-3′,每组3个复孔,实验重复3次。
1.2.6 流式细胞仪检测细胞凋亡
取对数生长期细胞,1.5×105个/孔接种于6孔板中,接种24 h后转染各组细胞;9 Gy放射处理,24 h后收集细胞,1 000 r/min 离心5 min,冰PBS 清洗3 次;根据凋亡检测试剂操作说明书,按照每孔100 μL 结合液,5 μL Annexin V-PE 和5 μL 7-AAD 配制检测液,分别加入各组细胞中,重悬混匀,室温避光孵育15~30 min,流式细胞仪检测,每组3个复孔,实验重复3次。
1.2.7 流式细胞仪检测细胞周期
取对数生长期细胞,接种于25 cm2细胞瓶中,细胞融合度达60%转染各组细胞;9 Gy放射处理,24 h后收集细胞,1 000 r/min 离心5 min,PBS 清洗3 次,75%冰乙醇固定,4 ℃冰箱过夜;PBS 洗3 次,PI 染色,重悬混匀,室温避光孵育15 min,流式细胞仪检测,每组3个复孔,实验重复3次。
1.2.8 CCK-8检测细胞增殖
取对数生长期细胞,2 000 个/孔接种于96 孔板中,24 h 后转染各组细胞,9 Gy 放射处理;72 h 后弃培养基,按照每孔100 μL培养基,10 μL CCK-8试剂配制检测液,分别加入96 孔板中,37 ℃避光孵育2 h,酶标仪450 nm 检测吸光度,每组5 个复孔,实验重复3次。
1.2.9 免疫荧光染色
取对数生长期细胞2×104个/孔接种于激光共聚焦皿中,24 h 后转染各组细胞,9 Gy 放射处理;分别收取未放射、放射后8 h和放射后24 h 3个时间点细胞;弃培养基,PBS洗1次,37 ℃4%多聚甲醛室温固定30 min,PBS洗3次;0.2%Triton X-100破膜30 min,PBS 洗3 次:5% BSA 封闭1 h;GDF15 一抗(1∶200)4 ℃孵育过夜,PBS 洗3 次;二抗37 ℃避光孵育3 h,PBS 洗3 次;DAPI 染色10 min,室温避光,PBS 洗3次;抗荧光淬灭封片剂封片,荧光显微镜观察拍照,实验重复3次。
1.2.10 线粒体膜电位检测
取对数生长期细胞,2×104个/孔接种于24 孔板中,24 h 后转染各组细胞,9 Gy 放射处理;分别收取未放射、放射后8 h 细胞。阳性对照设置:阳性对照孔中加入碳酰氰基-对-氯苯腙(CCCP,使用浓度为10 μmol/L)处理细胞20 min。吸除培养基,PBS洗1 次,加入500 μL JC-1 染色工作液,细胞培养箱中孵育20 min;吸除上清,PBS 洗2 次,加入1 mL 细胞培养液,荧光显微镜观察拍照,实验重复3次。
1.3 统计学方法
采用SPSS 19.0软件进行统计分析,实验计量数据以均数±标准差()表示。同一测量值在不同的时间比较采用重复测量的方差分析;两组间比较采用独立样本t检验;多组间比较采用单因素方差分析和LSD-t检验,方差不齐数据采用Tamhane’s T2检验进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 放射诱导BM-MSCs中GDF15表达上调
为明确放射后BM-MSCs中GDF15的表达情况,分别通过RT-qPCR、Western blot和免疫荧光检测细胞经放射处理后不同时间点GDF15 的mRNA 和蛋白表达水平。结果显示,GDF15 的mRNA 和蛋白水平在放射后显著升高(图1A、B)。同时,免疫荧光的结果也证实,放射可诱导GDF15 的表达增加(图1C)。综上,在BM-MSCs 细胞经放射诱导后GDF15的表达上调。
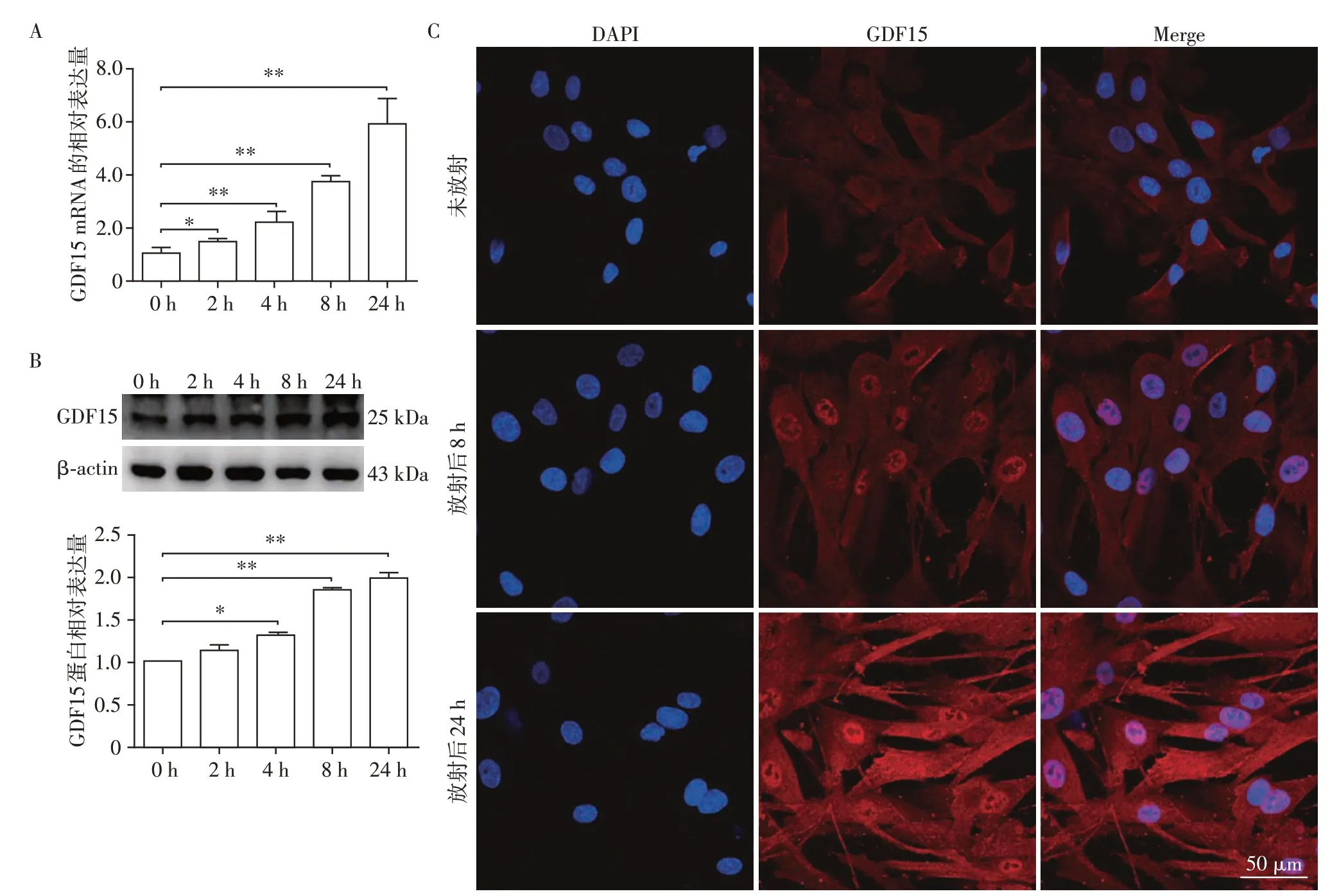
图1 BM-MSCs经放射后GDF15的表达情况Figure 1 The expression of GDF15 in BM-MSCs after irradiation
2.2 GDF15干扰效果验证
为明确放射后高表达的GDF15 在BM-MSCs 放射抗性中的作用,我们采用脂质体转染siRNA 片段干扰GDF15 的表达,并于细胞转染24 h 后,进行mRNA 检测。结果显示,与干扰对照组相比,3个干扰片段均能有效降低GDF15 的mRNA 表达水平(P<0.05,图2A),其中干扰片段1 的mRNA 抑制效率达到75%;细胞转染72 h后,进行蛋白检测,结果显示,与干扰对照组相比,3个干扰片段均能有效降低GDF15 蛋白表达(P<0.05,图3B、C)。综合上述结果,干扰片段1的抑制效果最好,并拟采用此片段进行后续的干扰实验。
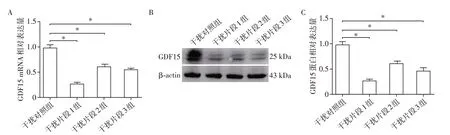
图2 RT-qPCR和Western blot验证GDF15干扰效果Figure 2 The interference effect of GDF15 in BM-MSCs were detected by RT-qPCR and Western blot
2.3 干扰GDF15的表达可降低BM-MSCs放射后细胞增殖
为明确GDF15 表达水平对放射前后细胞增殖的影响,我们检测了细胞周期和细胞增殖活力。收取未放射和放射后24 h 的BM-MSCs 细胞,通过PI染色检测细胞周期,结果显示,未放射条件下,干扰GDF15 对BM-MSCs 周期无明显影响;放射后24 h时,干扰GDF15 组G2 期比例显著增加(P<0.05,图3A、B)。收取放射3 d后的细胞,CCK-8法检测细胞增殖活力,结果显示与细胞周期结果相符,干扰GDF15几乎不影响未放射时的细胞增殖活力,却可导致放射后BM-MSCs 细胞增殖活力显著降低(P<0.01,图3C)。综上所述,干扰GDF15基因表达可导致放射后BM-MSCs细胞G2期阻滞并且降低细胞增殖活力。

图3 干扰GDF15抑制BM-MSCs放射后细胞周期及增殖Figure 3 GDF15 interference inhibited the cell cycle and proliferation of BM-MSCs after irradiation
2.4 干扰GDF15表达可增加BM-MSCs放射后细胞凋亡
为进一步明确GDF15 表达对BM-MSCs 放射抗性的影响,我们通过Annexin V-PE/7AAD 染色及检测Cleaved caspase3 和JC-1 变化水平,明确干扰GDF15 表达对BM-MSCs 放射后细胞凋亡的影响。检测结果如图4A、B 所示,未放射条件下,干扰GDF15 表达对细胞的凋亡无显著性影响。而放射后,干扰GDF15 可导致细胞凋亡率显著增加(P<0.05)。与之相应,Cleaved caspase3 的Western blot结果证实,干扰GDF15可使放射后Caspase3的剪切水平增加(图4C)。同时,检测JC-1细胞线粒体膜电位的变化情况发现,在未放射条件下,对照组与干扰GDF15 红/绿荧光强度比值无统计差异(P>0.05)。而放射后,干扰GDF15组与其干扰对照组相比,红/绿荧光强度比值显著降低,提示线粒体膜电位下降(P<0.001,图5)。上述结果表明,干扰GDF15表达可显著增加BM-MSCs细胞放射后凋亡。

图4 干扰GDF15对BM-MSCs放射前后细胞凋亡的影响Figure 4 The effects of GDF15 interference on the apoptosis of BM-MSCs before and after irradiation
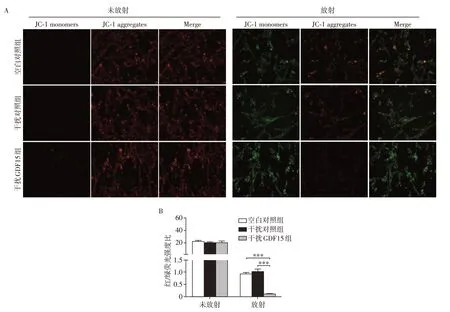
图5 干扰GDF15后BM-MSCs放射前后线粒体膜电位变化Figure 5 The effect of GDF15 interference on mitochondrial membrane potential of BM-MSCs before and after irradiation
2.5 干扰GDF15表达可抑制BM-MSCs 的ERK/Bcl-2信号通路活化
为进一步明确干扰GDF15 表达增加BM-MSCs放射敏感性的分子机制,我们检测了GDF15下游与细胞凋亡密切相关的关键通路ERK/Bcl-2的活化情况[15]。Western blot检测结果表明:与空白对照组和干扰对照组相比,干扰GDF15 后,ERK1/2 磷酸化水平明显降低,表明GDF15 可以通过增加ERK1/2 的磷酸化调节其下游蛋白的表达。与对照组相比,干扰GDF15导致抗凋亡关键分子Bcl-2蛋白水平明显降低,而促凋亡分子Bax 蛋白水平明显升高(图6)。综上所述,干扰GDF15表达可通过抑制ERK信号通路活化,调节下游Bcl-2 和Bax 蛋白表达,进而增加BM-MSCs放射后凋亡。
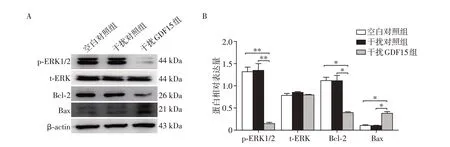
图6 干扰GDF15后BM-MSCs放射后ERK及其下游蛋白的表达Figure 6 The effect of GDF15 interference on ERK and its downstream proteins of BM-MSCs after irradiation
3 讨论
在ARS的研究中,骨髓造血损伤是各种放射病最基本和最致命的表现之一,并贯穿各型ARS的始终[16]。因此,对于骨髓造血功能损伤的防治是ARS防治的关键和重要研究领域。BM-MSCs 是一类具有自我更新和多向分化潜能的干细胞,可以分化为包括成骨细胞、脂肪细胞、软骨细胞、内皮细胞和成纤维细胞在内的骨髓基质细胞,以形成HSCs 骨髓内定植的龛位,也可分泌多种造血因子、细胞因子和趋化因子建立细胞因子网络,对于正常造血功能的维持和损伤后造血重建都至关重要[17]。因此研究BMMSCs的放射抗性,对于造血重建具有重大意义。
凋亡是放射诱导细胞死亡的主要原因之一,而BM-MSCs 对凋亡的抗性被认为是放射耐受的关键机制。已有研究表明,放射后BM-MSCs的抗凋亡作用与较强的DNA 损伤修复能力和较快的活性氧清除有关[18]。我们前期研究发现,GDF15 升幅高的BM-MSCs凋亡率较低[13],提示GDF15可能参与BMMSCs的放射抗性,但具体机制未明。本研究发现放射可诱导BM-MSCs中GDF15表达显著上调,而干扰其表达可导致放射后细胞凋亡率增加,证实GDF15可促进细胞的放射抵抗。细胞对放射的敏感性与所处的周期密切相关,处于G1/S期的细胞放射敏感性低,处于G2期的细胞放射敏感性高[19]。已有文献报道,GDF15参与细胞周期的调控。如在宫颈癌细胞中,GDF15 诱导c-Myc 的表达,c-Myc 作为调节细胞周期的经典转录因子,可诱导CDK1和cyclinB1的上调,CDK1-cyclinB1 形成复合物促进细胞通过G2期[7,20]。本研究也证实干扰GDF15,放射后BMMSCs 的G2期阻滞增加。但是否GDF15通过该机制参与放射后BM-MSCs的G2期调控有待进一步研究。
线粒体是放射损伤的重要靶点。放射可直接作用于线粒体DNA,也可间接通过辐解产生的活性氧损伤线粒体的蛋白及细胞膜系统,破坏电子传递链(ETC)复合物Ⅰ、Ⅱ等,从而导致线粒体膜通透性改变、融合-分裂动态平衡失衡、线粒体膜电位下降等一系列结构和功能损害[21]。此外,GDF15也是线粒体功能损伤的标志物[22]。因此,我们检测了干扰GDF15 对放射前后线粒体膜电位以及Caspase3 剪切情况的影响。正常的线粒体膜电位是维持线粒体功能的关键,而其膜电位的降低是细胞凋亡早期的一个标志性事件[23]。本研究结果显示干扰GDF15对正常BM-MSCs线粒体膜电位无显著影响,但放射后却可以显著降低线粒体膜电位。此外,干扰GDF15 的BM-MSCs 放射后Cleaved caspase3 水平最高。综上所述,干扰GDF15诱导BM-MSCs放射敏感性增加可能与线粒体凋亡途径增强有关。
ERK信号通路在BM-MSCs的增殖、分化和凋亡中具有重要作用。抑制ERK1/2 磷酸化可通过调控Bax 和Bcl-2 表达水平,激活Caspase3,导致细胞凋亡[24]。在多种肿瘤细胞中,已有研究证实GDF15可结合酪氨酸激酶受体ErbB2,激活ErbB2 的激酶活性,进而磷酸化ERK1/2 调控细胞增殖[7,25]。因此,我们检测了在BM-MSCs 中GDF15 对ERK1/2 磷酸化的影响,结果显示干扰GDF15 抑制了ERK1/2的磷酸化水平。ERK1/2 对细胞凋亡的调控主要通过对Bcl-2和Bax蛋白调节实现。研究表明,ERK1/2依赖性磷酸化可以激活cAMP反应性元素结合蛋白(CREB),磷酸化的CREB 入核并与Bcl-2 的启动子结合,从而促进Bcl-2 转录[24]。当Bcl-2 表达较Bax多时,两者可以结合形成异源二聚体,抑制细胞的凋亡,而Bcl-2表达较Bax少时,Bax自身会形成同源二聚体,促进细胞的凋亡[27]。既往研究表明,与放射敏感性细胞相比,MSCs高表达抗凋亡蛋白Bcl-2,低表达促凋亡蛋白Bax[1]。因此,本研究检测了干扰GDF15之后,Bcl-2和Bax在BM-MSCs中的表达。干扰GDF15 后Bcl-2 蛋白水平降低,Bax 蛋白水平升高,表明GDF15对BM-MSCs放射抗性的调控可能通过ERK/Bcl-2通路实现。
综上所述,本研究证明了GDF15作为放射应激分子,通过激活ERK/Bcl-2通路活性,参与BM-MSCs的放射抗性调控,为放射后造血微环境的重建提供了调控靶分子。然而,BM-MSCs细胞中GDF15影响ERK磷酸化的具体机制尚不清楚,有待进一步的研究探索。
