Chk2 敲除可通过增强抗氧化能力改善由Bmi-1 缺失所致的小鼠脑衰老表型
2021-07-28刘轶宁庄旻羽吕佳璐金瑶瑶张永杰
崔 敏,刘轶宁,庄旻羽,吕佳璐,金瑶瑶,张永杰*
1南京医科大学人体解剖学系,2衰老及相关疾病研究重点实验室,3第一临床医学院,江苏 南京 211166
B淋巴瘤Mo-MLV 插入区1(B cell-specific MLV integration site-1,Bmi-1)是转录抑制因子多梳基因家族成员[1],可通过抑制p16INK4a/Rb 和p19AFR/p53 途径参与调节细胞周期和细胞衰老[2-3],并在各种细胞的抗氧化防御中发挥重要作用[4-7]。Bmi-1在各类神经细胞(包括神经干细胞、神经元和星形胶质细胞等)中均有表达,并在脑发育过程中具有重要作用[8-9]。既往研究显示,Bmi-1 在老年人脑和老年小鼠脑中表达下调,提示Bmi-1与大脑衰老有关[4]。通过对利用基因重组技术建立的Bmi-1基因敲除(Bmi-1-/-)小鼠的研究发现,Bmi-1 缺乏的小鼠出现成熟前衰老的表型,神经系统和造血功能缺陷[10],抗氧化能力降低[2]。
细胞周期检查点激酶2(cell-cycle checkpoint kinase 2,Chk2)是重要的DNA 损伤检查点调节器[11],当Chk2 被激活时,能够迅速通过磷酸化,阻滞细胞周期进程,导致细胞发生程序性死亡[12-13]。先前研究表明,敲除Chk2基因(Chk2-/-)可以改善小鼠Bmi-1 缺失引起的多器官表型,并延长其生存时间[13-14],但Chk2 基因敲除是否能纠正Bmi-1 缺失小鼠的脑衰老表型,尚未见文献报道。因此,我们通过配笼生成Bmi-1 和Chk2 双基因敲除小鼠(Bmi1-/-Chk2-/-),比较同窝WT、Bmi1-/-、Chk2-/-和Bmi1-/-Chk2-/-小鼠不同脑区的表型及抗氧化酶等的表达变化,以进一步验证Chk2 敲除是否可通过中断DNA损伤应答途径,增强抗氧化能力,从而改善由Bmi-1缺失所致的小鼠脑衰老表型。
1 材料和方法
1.1 材料
1.1.1 动物
实验用2 月龄Bmi1-/-小鼠、Chk2-/-小鼠、Bmi1-/-Chk2-/-小鼠及同窝野生型(wild type,WT)对照小鼠各6只,雌雄不限。动物饲养、管理及使用均严格按照南京医科大学实验动物管理规范进行(IACUC:1809007)。
1.1.2 试剂
兔抗NeuN 单克隆抗体(Abcam 公司,英国),小鼠抗GFAP 单克隆抗体(Millipore 公司,美国),兔抗Iba1单克隆抗体(Abcam 公司,英国),兔抗p16多克隆抗体(Santa Cruz 公司,美国),鼠抗GAPDH 单克隆抗体(Proteintech 公司,美国),兔抗SOD1、SOD2单克隆抗体(Abcam 公司,英国)。羊抗鼠、羊抗兔IgG(武汉博士德公司),羊抗兔IgG-HRP、羊抗小鼠IgG-HRP(KPL 公司,美国),Elite ABC Kit(Vector 公司,美国)。
1.2 方法
1.2.1 动物基因型鉴定
将新生仔鼠剪尾(约5 mm),参见Miao等[2,13]方法结合PCR反应,鉴定小鼠基因型,引物序列见表1。

表1 PCR引物序列Table 1 Sequences of PCR primers
1.2.2 组织取材及切片
采用3%戊巴比妥钠(4 mg/100 g 体重)深度麻醉小鼠后,经心脏行生理盐水灌洗,取脑,沿大脑纵裂切开分左右两半,左侧半脑经4%多聚甲醛固定后,梯度酒精脱水、石蜡包埋后行矢状位石蜡切片,片厚5 μm,右侧半脑分脑区冻存,用于提取组织蛋白进行Western blot实验。
1.2.3 免疫组织化学染色
石蜡切片经37 ℃30 min烘干后,行常规脱蜡水化,然后用3%过氧化氢处理30 min 以灭活内源性过氧化物酶,10%正常羊血清封闭1 h,滴加一抗兔抗NeuN 单克隆抗体(1∶200)、小鼠抗GFAP 单克隆抗体(1∶200)、兔抗Iba1 单克隆抗体(1∶200)、兔抗p16多克隆抗体(1∶200),4 ℃孵育过夜,加生物素标记的羊抗鼠IgG(1∶100)、羊抗兔IgG(1∶100)室温孵育1 h,滴加Elite ABC 混合液室温孵育30 min,加DAB 底物(武汉博士德公司)室温避光孵育5~8 min,苏木精复染20 s,1%盐酸酒精分色2~3 s,流水蓝化3 min,常规梯度酒精脱水,二甲苯透明,中性树胶封片。正置显微镜采集图像,用Image Pro Plus 6.0 软件分析NeuN、Iba1、p16阳性细胞百分率(%),GFAP阳性面积百分率(%),每个动物每个相应脑区至少计数3张切片,结果取平均值。
1.2.4 Western blot实验
组织按质量/体积比约1∶20加入RIPA后剪碎、匀浆,冰上静置30 min,13 000 r/min 4 ℃离心15 min,提取蛋白并用BCA法进行定量,100 ℃金属浴10 min,使蛋白变性后置-80 ℃冰箱保存。10%SDS-PAGE胶,每组蛋白加样20 μg,110 V 恒压电泳2 h 后,280 mA 恒流转膜90 min,蛋白湿转至硝酸纤维素膜上,含5%脱脂奶粉的PBST 37 ℃封闭1 h,加入适量一抗:鼠抗GAPDH 单克隆抗体(1∶2 000)、兔抗SOD1、SOD2单克隆抗体(1∶1 000)、兔抗p16多克隆抗体(1∶1 000),4 ℃孵育过夜,PBST洗涤后,加入相应特异性二抗(1∶2 000),摇床室温反应1 h。洗膜后,滴加ECL发光混合液,自动成像仪曝光,保存显影图像。采用Image-Pro Plus 6.0软件进行分析,
1.3 统计学方法
采用GraphPad Prism 8.0 软件进行数据分析及作图。各组计量数据以均数±标准差()表示。采用单因素方差分析(one-way ANOVA)进行多组间数据比较,多组间数据两两比较用SNK 法,P<0.05为差异有统计学意义。
2 结果
2.1 Chk2敲除可促进Bmi-1-/-小鼠不同脑区小胶质细胞的发育以及神经元的分化与成熟
为了明确Chk2敲除对Bmi-1-/-小鼠小胶质细胞发育以及神经元分化、成熟的影响,我们采用免疫组化的方法检测小胶质细胞标志物Iba1、神经元特异性核蛋白NeuN的表达,分析比较了2月龄Bmi1-/-、Chk2-/-、Bmi1-/-Chk2-/-及同窝WT 对照小鼠大脑皮层、海马及下丘脑区Iba1、NeuN阳性细胞百分率的变化。结果显示,与同窝WT 小鼠相比,Iba1 和NeuN 阳性细胞百分率在Chk2-/-小鼠海马区及下丘脑区明显增加,而在大脑皮层虽有增加趋势,但差异无统计学意义;Bmi1-/-小鼠以上脑区的Iba1 和NeuN 阳性率明显减少;与Bmi1-/-小鼠相比,Bmi1-/-Chk2-/-小鼠以上脑区的Iba1 和NeuN 阳性率明显增加,但尚未达到WT小鼠水平(图1、2)。这些结果说明Chk2敲除能够促进Bmi1-/-小鼠大脑皮层、海马及下丘脑区小胶质细胞的发育及神经元的分化与成熟。
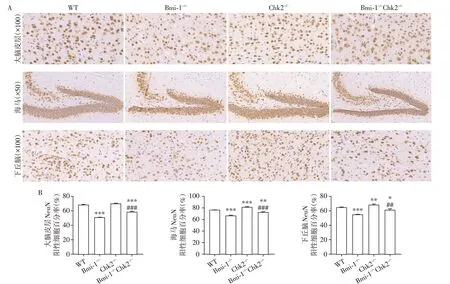
图1 Chk2敲除对Bmi-1-/-小鼠大脑皮层、海马、下丘脑区神经元发育的影响Figure 1 Effects of Chk2 knockout on neuronal development in the cerebral cortex,hippocampus and hypothalamus of Bmi-1-/- mice
2.2 Chk2敲除可通过增强抗氧化能力缓解由Bmi-1缺失所致的小鼠脑衰老表型
为了研究Chk2敲除对Bmi-1-/-小鼠脑衰老表型的影响以及可能机制,我们采用免疫组化的方法检测了2月龄Bmi1-/-、Chk2-/-、Bmi1-/-Chk2-/-及同窝WT对照小鼠脑中轻度反应型星形胶质细胞标志物GFAP及衰老指标p16的表达情况。结果显示,与同窝WT 小鼠相比,Bmi1-/-小鼠、Bmi1-/-Chk2-/-小鼠海马和下丘脑区均出现GFAP阳性星形胶质细胞的激活,且胞体肥大、表达增强,而Bmi1-/-Chk2-/-小鼠的GFAP 阳性率明显低于Bmi1-/-小鼠,但尚未达到WT小鼠水平(图3)。与WT 小鼠相比,p16 阳性细胞百分率及蛋白表达量在Chk2-/-小鼠大脑皮层、海马区及下丘脑区虽有减少趋势,但差异无统计学意义;而Bmi1-/-小鼠以上脑区的p16阳性率及蛋白表达量均明显增加;与Bmi1-/-小鼠相比,Bmi1-/-Chk2-/-小鼠以上脑区的p16阳性率显著降低,但尚未达到WT小鼠水平(图4、5)。这些结果说明Chk2 敲除能够缓解由Bmi-1缺失所致的小鼠衰老表型。

图3 Chk2敲除对Bmi-1-/-小鼠海马、下丘脑区星形胶质细胞发育的影响Figure 3 Effects of Chk2 knockout on astrocyte development in hippocampus and hypothalamus of Bmi-1-/-mice

图4 Chk2敲除对Bmi-1-/-小鼠大脑皮层、海马、下丘脑区p16表达的影响Figure 4 The effect of Chk2 knockout on p16 expression in cerebral cortex,hippocampus and hypothalamus of Bmi-1-/-mice
采用Western blot验检测2月龄Bmi1-/-、Chk2-/-、Bmi1-/-Chk2-/-及同窝WT对照小鼠大脑皮层SOD1及SOD2 的表达量,结果显示,与同窝WT 小鼠相比,SOD1 和SOD2 蛋白表达量在Chk2-/-小鼠脑内明显增加,而在Bmi1-/-小鼠和Bmi1-/-Chk2-/-小鼠脑内则明显减少(图5);与Bmi1-/-小鼠相比,Bmi1-/-Chk2-/-小鼠脑内的SOD1和SOD2蛋白表达量显著上调,但尚未达到WT小鼠水平(图5)。以上结果说明,Chk2敲除可通过增强抗氧化能力缓解由Bmi-1缺失所致的小鼠脑衰老表型。

图5 p16、SOD1、SOD2蛋白在2月龄WT、Bmi-1-/-、Chk2-/-、Bmi-1-/-Chk2-/-小鼠脑中的表达Figure 5 The expression of p16,SOD1,SOD2 protein in the brain of 2-month-old WT,Bmi-1-/-,Chk2-/-,and Bmi-1-/-Chk2-/-mice
3 讨论
衰老在生命进程中是一个不可逆的过程,但有希望通过增强或减弱某些基因的功能来延缓它的进程[15]。既往研究表明,Chk2 敲除可以部分挽救Bmi-1缺失小鼠的相关表型[16],但对于Bmi-1缺失小鼠脑衰老表型的影响尚不明确。故本实验中,我们通过比较Bmi-1和Chk2双基因敲除的Bmi1-/-Chk2-/-小鼠与Bmi1-/-、Chk2-/-及同窝WT小鼠不同脑区的脑衰老表型,探索Chk2敲除对Bmi-1缺失小鼠脑衰老的影响。
在脑衰老的研究中,大脑皮层[17-18]、海马[19-21]、下丘脑[22-23]等脑区的形态与功能变化在脑衰老过程中具有重要意义,故本研究首先将上述脑区作为研究目标区域。研究结果显示,Iba1和NeuN阳性细胞率在Bmi1-/-小鼠的上述脑区均明显减少。与Bmi1-/-小鼠相比,Bmi1-/-Chk2-/-小鼠以上脑区的Iba1 和NeuN阳性细胞率明显增加,但仍未达野生型小鼠水平。这些结果说明Chk2 敲除可促进Bmi1-/-鼠大脑皮层、海马及下丘脑区小胶质细胞的发育及神经元的分化与成熟。
轻度反应型星形胶质细胞增生表明星形胶质细胞活化,是脑衰老的病理学特征之一[6,24]。同样,既往研究已证明p16的表达上调与激活是衰老的重要标志之一[25]。本研究研究结果显示,在2月龄时,与同窝WT小鼠相比,Bmi-1基因敲除小鼠小胶质细胞的发育、神经元的发育与成熟均受到阻碍,轻度反应型星形胶质细胞增生,即活化的星形胶质细胞增多(因皮质区GFAP阳性纤维分布极为稀疏,故本研究中未对该区GFAP 阳性纤维进行分析),p16 阳性细胞百分率及蛋白表达量均明显上升,与既往研究发现的Bmi1-/-小鼠成熟前衰老表型相一致。本研究结果同时表明与Bmi1-/-小鼠相比,Bmi1-/-Chk2-/-小鼠的相应脑衰老表型得到明显改善,说明Chk2敲除能较好地改善Bmi-1缺失小鼠的脑衰老表型。
研究表明,衰老进程中,体内活性氧(reactive oxygen species,ROS)水平会相应增加[26],而超氧化物歧化酶SOD1、SOD2均为重要的抗氧化酶,具有清除体内过剩ROS 的功能[27]。为进一步明确Chk2 敲除是否能够通过对细胞抗氧化能力的调节来延缓Bmi-1 缺失对脑衰老的影响,我们检测了2 月龄Bmi1-/-、Chk2-/-、Bmi1-/-Chk2-/-及同窝WT对照小鼠脑内的抗氧化指标SOD1、SOD2 的表达变化。结果显示,与同窝WT小鼠相比,SOD1和SOD2蛋白表达量在Chk2-/-小鼠脑中明显增加,Bmi1-/-Chk2-/-小鼠脑中SOD1 和SOD2 蛋白表达量较Bmi1-/-小鼠显著增多,但尚未达WT小鼠水平。结果说明,Chk2敲除对Bmi-1-/-小鼠脑内降低的抗氧化能力有明显的纠正作用,说明Chk2敲除可通过增强抗氧化能力而改善小鼠的脑衰老表型。
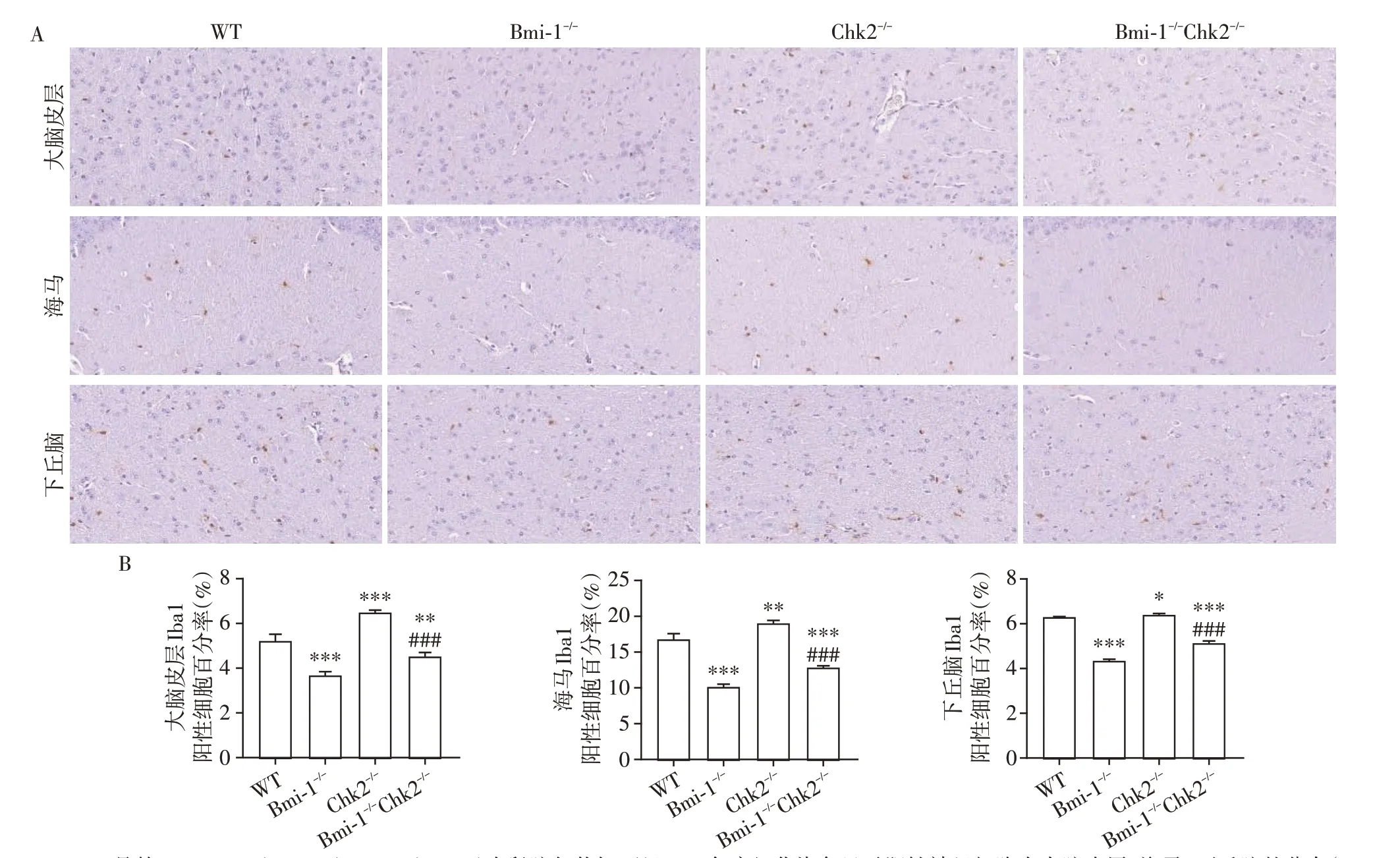
图2 Chk2敲除对Bmi-1-/-小鼠大脑皮层、海马、下丘脑区小胶质细胞发育的影响Figure 2 Effects of Chk2 knockout on microglia development in the cerebral cortex,hippocampus and hypothalamus of Bmi-1-/-mice
综上所述,本研究结果证实Chk2 敲除可缓解Bmi-1缺失所致脑内的神经细胞发育障碍及增强其脑内的抗氧化能力,进而在延缓Bmi-1 缺失所致的脑衰老中起重要作用。本研究将为延缓脑衰老进程的研究与临床药物研发提供新的靶点及初步的实验依据。
