成年小鼠ECSIT 3′-UTR的鉴定及功能分析
2021-07-28周小蓉李建涛阙玲琍李跃华
周小蓉,陆 霞,李建涛,阙玲琍,李跃华
南京医科大学心血管病转化医学协同创新中心,江苏 南京 211166
基因表达的调控大多数发生在转录过程中,mRNA 的稳定性、定位和可翻译性在这一过程发挥重要作用[1]。3′非翻译区(3′-untranslated region,3′-UTR)是mRNA非编码区的一部分,其碱基长度从编码区末端的终止密码子延伸至多聚A尾巴(poly A)的前端[2],3′-UTR 包含大量的调控元件,具有调节mRNA稳定性、定位、翻译以及介导蛋白与蛋白的相互作用等功能[3-4],通过3′-UTR 调节转录后的基因表达对维持细胞的内稳态非常重要。
Toll 途径进化保守信号介导因子ECSIT(evolutionarily conserved signaling intermediate in Toll pathways,ECSIT)是Toll 样受体/白介素-1 受体(Toll-like receptors/interleukin-1 receptor,TLRs/IL-1R)信号通路中高度保守的信号分子,在先天免疫、胚胎发育和线粒体相关功能中发挥重要作用[5-7]。Toll 样受体识别病原体相关分子模式并通过转化生长因子激酶1(TGF beta-activated kinase 1,TAK1)或有丝分裂原/细胞外信号调节激酶激酶1(mitogen/extracellular signal-regulated kinase kinase 1,MEKK-1)激活NF-κB和AP-1转录因子的表达,促进炎症信号的激活,肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6,TRAF6)是这两个级联下游信号分子。在应激条件下,ECSIT 与TRAF6结合,参与NF-κB 信号与MEKK-1 的信号通路调控[5]。骨形态发生蛋白(bone morphogenetic protein,BMP)是转化生长因子β(transforming growth factor β,TGF-β)超家族的成员。在BMP 通路中,ECSIT 可以作为Smad1 和Smad4 的辅助因子,并与特定BMP靶基因(如Tlx2)的启动子结合,在小鼠的胚胎发育过程中起关键作用,且ECSIT 敲除小鼠具有胚胎致死性[6]。此外,ECIST 与分子伴侣NDUFAF1 相互作用并参与线粒体复合物Ⅰ的组装,沉默ECSIT 的表达可导致线粒体复合物Ⅰ组装严重损伤,进而导致线粒体功能紊乱[7]。已有研究报道,ECSIT在成年小鼠骨骼肌、肝脏、肾脏和心脏中均有表达[5]。但是,ECSIT 的表达受哪些因素调控,尤其是在翻译水平上的调控尚不清楚。
在真核生物中,长为20~30 个核苷酸的非编码RNA 分子已成为基因组表达和功能的关键调控因子,根据其作用模式不同,其主要被分为两类,即微小RNA(microRNA,miRNA)和小干扰RNA(siRNA)[8]。miRNA是一类由内源基因编码的长度为20~24个核苷酸的非编码单链RNA,可在多种生物过程中调控基因表达,包括发育、细胞分化、脂肪代谢和生长控制[9]。转录后基因表达的抑制方法包括抑制翻译和mRNA 的剪切,miRNA 可直接与靶mRNA的3′-UTR序列互补结合,通过去烯化作用对靶mRNA 进行非切割降解,起到翻译抑制作用[10-11]。RNA 干扰(RNA interference,RNAi)是一种内源性RNA 干扰途径,通过精确调控基因表达,为调控细胞信号通路提供了强大的机制,作为RNAi 复合物的一个组成部分,siRNA 能够沉默具有互补序列的特定基因的表达[12]。ECSIT mRNA 的3′-UTR 作为其mRNA的重要组成部分,可能与miRNA 或siRNA 结合,引导ECSIT mRNA 发生翻译受阻或降解,从而引起下游信号通路的改变。目前,通过干预ECSIT 3′-UTR从而调节ECSIT 的表达尚无文献报道。因此,本研究使用3′RACE 技术克隆得到ECSIT 3′-UTR 的序列,并观察miRNA 和siRNA 对细胞中ECSIT 表达的影响,以验证调控ECSIT mRNA 翻译表达的序列区域,为后续从分子水平探明ECSIT 的作用机制及其在心血管疾病等防治方面的开发应用奠定良好的理论基础。
1 材料和方法
1.1 材料
C57BL/6J 小鼠为SPF 级(购自南京医科大学医药实验动物基地并饲养于此基地),研究经南京医科大学实验动物伦理委员会批准(批准号:IACUC 2008005)。
反转录试剂盒PrimerScriptTMRT、pMD-18T 载体、DL1000 Marker(TaKaRa 公司,日本);氨苄青霉素(上海生光公司);凝胶回收试剂盒、大肠杆菌DH5α感受态细胞(北京天根生化);Taq 酶(NEB 公司,美国);LipofectamineTM2000 转染试剂(Invitrogen公司,美国);ECSIT 抗体(Abcam 公司,美国);GAPDH抗体、HRP标记的山羊抗兔IgG、山羊抗小鼠IgG(上海碧云天生物有限公司);DMEM 细胞培养基(Gibco 公司,美国);胎牛血清(BI 公司,以色列)。PCR 仪、mini PROTEAN 3cell 电泳仪(Bio-Rad 公司,美国);SSC-24P 空气恒温摇床(江苏太仓实验设备厂);AE-100电子分析天平(METTLER公司,瑞士);台式离心机(Heraeus公司,德国)。
根据NCBI 数据库里的小鼠ECSIT 基因序列设计合成引物,测序由上海英骏生物技术有限公司完成。引物序列为3′Adaptor:5′-GCTGTCAACGATACGCTACGTAACGGCATGACAGTGTTTTTTTTTTTTT -TTTTT-3′,3′Adaptor MN:5′-GCTGTCAACGATACGCTACGTAACGGCATGACAGTGTTTTTTTTTTTTT -TTTMN-3′,3′musECSIT-F:5′-ATGAGTTTGACGTGGATGAA-3′,3′Nested-primer:5′-CGCTACGTAACGGCATGACAGTG-3′。
1.2 方法
1.2.1 3′RACE实验
使用TRIzol 法提取小鼠总RNA,再参照Prime-ScriptTMRT 试剂盒说明书方法将RNA 逆转录为cDNA。具体步骤为:①去除基因组DNA。5 × gDNA Eraser Buffer 2 μL,gDNA Eraser 1 μL,Total RNA(1 000 ng),RNase Free dH2O 补齐,42 ℃2 min。②反 转 录。PrimeScriptRT Enzyme Mix I 2 μL,5×PrimeScript Buffer(for real time)4 μL,步骤①的反应液10 μL,3′Adaptor、3′Adaptor MN 各1 μL,RNase Free dH2O 3 μL,反应条件为42 ℃30 min,85 ℃5 s,4 ℃保存。③PCR及其产物鉴定回收。使用逆转录产物cDNA 为模板,以musECSIT F 作为外侧上游引物,3′Nested-Primer 为下游引物和Taq 酶进行套式PCR扩增。反应条件如下:95 ℃预变性2 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,40个循环;72 ℃延伸10 min。反应结束后经琼脂糖凝胶电泳检测结果。
1.2.2 目的片段T载体克隆及序列分析
3′RACE 扩增条带切胶回收,连接于pMD18-T载体(具体操作参照产品说明书),转化大肠杆菌DH5α感受态,菌落PCR 鉴定的阳性克隆样品送测序。经过以上步骤,获得ECSIT 3′下游未知序列,将碱基序列提交到NCBI数据库做BLAST比对。
1.2.3 miRNA和siRNA的设计和合成
使用TargetScan 软件预测ECSIT 基因潜在结合的miRNA,其中miR-7-5p(序列为3′-UGUUGUUUUAGUGAUCAGAAGGU-5′)和miR-296-5p(序列3′-UGUCCUAACUCCCCCCCGGGU-5′)预测可能与ECSIT 3′-UTR的序列结合,因此将2种miRNA序列交由广州锐博生物技术有限公司合成。根据3′RACE 实验结果及NCBI 数据库中ECSIT 的序列设计4个干扰不同序列的siRNA,它们干扰ECSIT靶基因段为siRNA1:5′-GCCACGTGGACTTCATCTA-3′,位于第601~619 个碱基;siRNA2:5′-GCCTGATCTCAGTGCTAAA-3′,位于第992~1 009 个碱基;siRNA3:5′-GGAAGATGATGAGGCCATT-3′,位 于 第1 547~1 565 个碱基;siRNA4:5′-GTAATAAGTGCGTCTATTA-3′,位于第1 547~1 565 个碱基,siRNA均交由广州锐博生物技术有限公司设计并合成。
1.2.4 细胞培养
从液氮中取出RAW264.7细胞和Hepa1-6细胞,迅速在37 ℃水浴锅中摇晃,融化后转移至预先装好培养基的离心管内,500 r/min 4 ℃离心5 min,弃上清,加入含有10%血清的DMEM 培养基进行重悬后种板,置于细胞培养箱中培养。当细胞铺满皿底80%~90%时,进行传代,每48 h换1次完全培养基。
1.2.5 miRNA和siRNA转染
将siRNA 和miRNA 配成浓度为20 μmol/L 的储液,并分装冻存于-80 ℃冰箱。密度为30%~50%的细胞换新鲜无血清和不含双抗的DMEM培养基,使用LipofectamineTM2000,按照说明将50 nmol/L 的siRNA 和miRNA 转染至RAW264.7 细胞和Hepa1-6细胞,4 h 后换完全培养基,培养36 h 后进行下一步实验。
1.2.6 蛋白免疫印迹(Western blot)
提取细胞总蛋白并使用BCA法测定其浓度,加5×加样缓冲液后99 ℃煮5 min 使蛋白变性,再进行聚丙烯酰胺凝胶电泳,电泳结束后使用湿转法将蛋白转移至PVDF 膜上,将膜置于TBS-T 配制的5%脱脂奶粉溶液中,室温封闭1 h,TBS-T 清洗膜3 次,加入一抗置于4 ℃摇床孵育过夜,次日回收一抗,TBST清洗膜3次,二抗室温孵育1.5 h,清洗膜3次后,使用ECL显色液曝片,采用Image Lab图像分析软件进行灰度分析。
1.3 统计学方法
应用GraphPad Prism5软件统计数据,计量数据用均数±标准差()表示。使用单因素方差分析(one-way ANOVA)方法分析组间变异度,组内的两两比较采用Tukey 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 ECSIT mRNA 3′-UTR的鉴定及测序
ECSIT 的3′RACE-PCR 产物经2%琼脂糖凝胶电泳检测可见阳性条带(图1A),凝胶回收扩增的片段,克隆于pMD-18T载体,转化大肠杆菌DH5α感受态,菌落PCR鉴定阳性克隆(图1B),测序结果显示有效序列的长度为346 bp(图1C)。将序列与NCBI数据库中ECSIT的mRNA序列进行比对,一致率达到99%。

图1 3′RACE的克隆鉴定和序列Figure 1 Clone identification and sequence of 3′RACE
2.2 miR-7-5p调节小鼠细胞中ECSIT蛋白的表达
图2A 为预测软件识别的ECSIT 与miRNA 的互补序列。Western blot 结果发现,与NC 组相比,Hepa1-6细胞转染miR-7-5p可以明显抑制ECSIT 的蛋白表达(P<0.05,n=3),而转染miR-296-5p对ECSIT的表达没有明显影响(P>0.05,图2B),并且在RAW264.7 中观察到相同的变化趋势(P<0.01,图2C)。以上结果提示miR-7-5p可能是ECSIT的潜在调节因子。

图2 miR-7-5p抑制Hepa1-6细胞和RAW264.7细胞中ECSIT的表达Figure 2 MiR-7-5p inhibits ECSIT expression in Hepa1-6 cells and RAW264.7 cells
2.3 siRNA干扰小鼠细胞系中ECSIT蛋白的表达
Western blot结果显示,与NC组相比,在Hepa1-6 细胞中转染siRNA 1、2 后ECSIT 的表达显著下降(P<0.01,n=3),但siRNA 3、4对其表达没有明显影响(P>0.05,图3A);此外,在RAW264.7中观察到相同的变化趋势(P<0.05,图3B)。
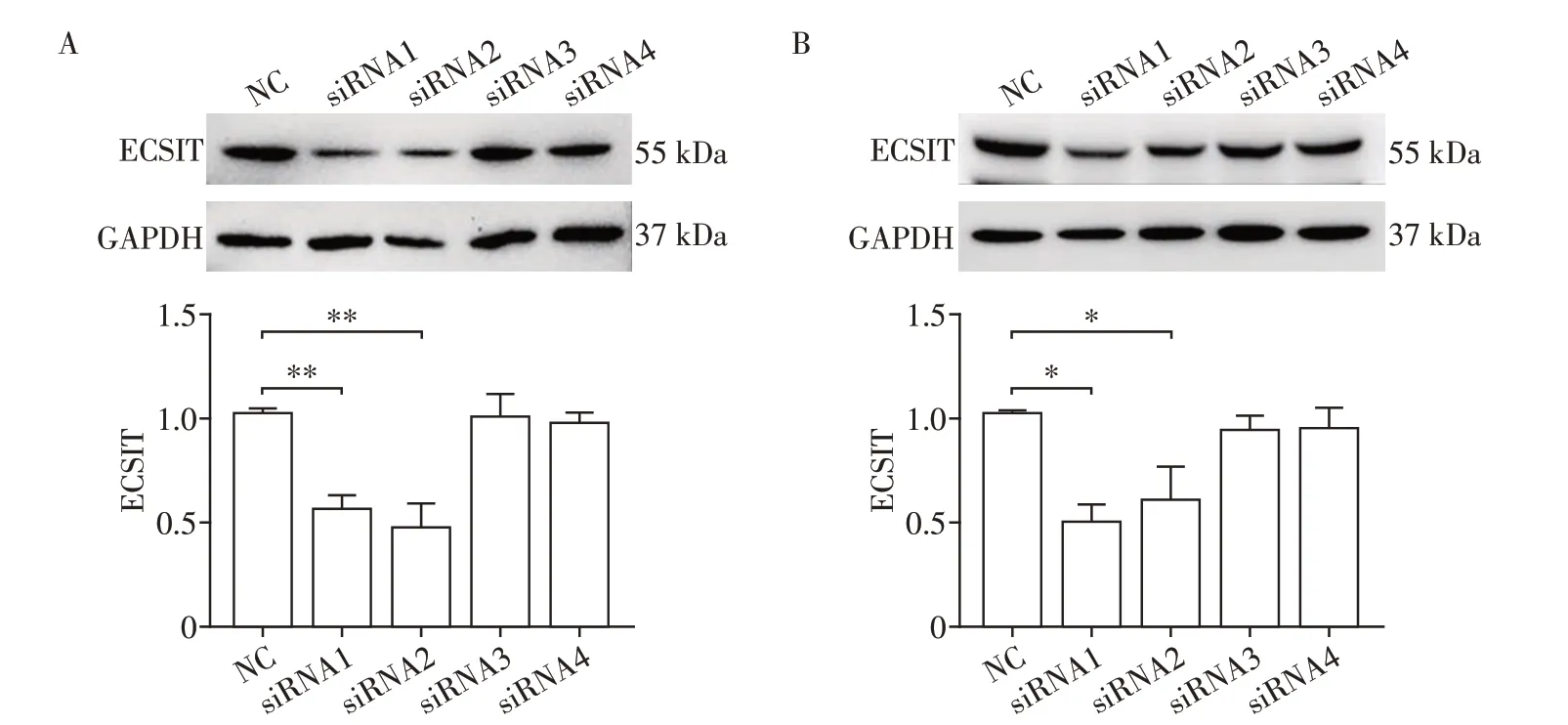
图3 siRNA干扰RAW264.7和Hepa1-6细胞中ECSIT的表达Figure 3 siRNAs in RAW264.7 and Hepa1-6 cells interfere with the expression of ECSIT
3 讨论
本研究采用3′RACE实验获得ECSIT 3′-UTR区域的碱基序列;通过miRNA 及siRNA 干扰实验发现,ECSIT 3′-UTR区域可被miR-7-5p调控,但siRNA作用于ECSIT 编码区更有效率,这可能是由于siRNA 识别靶序列具有高度特异性,而降解首先发生在相对于siRNA 来说的中间位置,所以这些中央位置的碱基位点就显得极为重要,一旦发生错配就会严重抑制RNAi 的效应,相对而言,3′末端的核苷酸序列并不要求与靶mRNA完全匹配[13]。
基因mRNA 3′-UTR 区域作为转录后控制的枢纽,是miRNA 和RNA 结合蛋白(RBPs)的靶点,3′-UTR 介导的信息传递可以调控氨基酸序列中未编码的蛋白质特征,在调节生物复杂性中发挥重要作用[14-15]。ECSIT 是多个信号通路的关键蛋白,参与先天免疫、炎症和线粒体功能等多方面的调节,ECSIT的转录后表达调控对研究其分子作用机制是非常重要的。基因库中ECSIT的序列是预测的,其3′-UTR 区域是未知的,这给后续的一些研究带来困难。本研究测序所得ECSIT 3′-UTR 长度为346 bp,与基因库中ECSIT mRNA(XM_011242538.4)的第2 231~2 576碱基序列一致率达99%。
已有研究报道,当miRNA 与mRNA 3′-UTR 序列不完全互补结合时,主要影响翻译过程,对mRNA稳定性没有明显影响;当miRNA 与mRNA 3′-UTR序列完全互补结合时,可能通过特异性切割mRNA抑制翻译或者导致mRNA 降解[16]。本研究结果发现miR-7-5p 可能在ECSIT 的表达调节中起重要作用,预测软件提示miR-7-5p与ECSIT 3′-UTR为不完全序列互补,因此miR-7-5p可能通过影响翻译过程从而影响ECSIT的表达。
哺乳动物细胞中内源性RNA干扰通路的存在,使其能够精确地调控基因表达,使用siRNA 疗法在治疗各种疾病方面取得了重大进展[17]。siRNA治疗的序列可以根据编码靶蛋白的mRNA 序列来确定,一旦进入细胞质,siRNA 分子将被并入RNA 诱导沉默复合体(RNA-induced silencing complex,RISC)[18],siRNA 双链将在RISC 复合体中分离,5′端更稳定的链被整合到活性的RISC复合体中,然后siRNA 通过启动催化性RISC 蛋白,引导RISC 复合物寻找和剪切目的分子,从而达到抑制mRNA 表达的目的[19]。本研究结果显示,siRNA1、2 号干扰序列分别为第601~619和第992~1 009碱基,这些区域可能是调节ECSIT mRNA表达的功能序列。
已有研究报道,脂多糖刺激巨噬细胞TLR4 受体后,ECSIT 与TAK1、TRAF6 结合形成内源性高分子复合体,调节TAK1的活性,通过影响下游的级联信号,促进炎症信号NF-κB的激活[20]。在巨噬细胞中,Toll样受体的激活促进TRAF6易位至线粒体,在线粒体外周与ECSIT 相互作用,ECSIT 发生泛素化并在线粒体外周富集,导致线粒体和细胞活性氧生成增加,有助于巨噬细胞内细菌的清除[21]。此外,ECSIT的缺失导致巨噬细胞代谢由有氧呼吸转变为糖酵解,线粒体复合物Ⅰ的组装受损、活性下降。线粒体功能障碍时,ECSIT 通过与自噬调节因子Parkin结合并发生泛素化,导致线粒体自噬受损[22]。以上研究表明ECSIT在炎症相关Toll样受体信号级联和线粒体功能中发挥重要作用。
心力衰竭的机制是复杂和多样的,研究发现,TLR4 受体信号的激活通过促进炎症因子的产生和基质降解,促进心肌梗死后左室不良心室重构发生发展[23]。健康小鼠心脏驻留的巨噬细胞约占心肌非心肌细胞群的6%~8%,抑制巨噬细胞招募并中和巨噬细胞破坏性的促炎功能,可以促进衰竭心脏的恢复[24]。线粒体功能障碍是心力衰竭发展的一个关键因素,线粒体通过氧化磷酸化维持心肌收缩所必需的能量,心力衰竭时期线粒体功能障碍,导致能量代谢障碍,活性氧释放增加,加重心力衰竭后的心脏损伤[25]。这些结果提示ECSIT在心力衰竭中可能发挥重要作用,需要进一步的研究证实。本研究获得了ECSIT 3′-UTR碱基序列,并验证了miR-7-5p 作为ECSIT 3′-UTR 潜在结合分子调控ECSIT 表达,这可为后续ECSIT的研究提供分子基础。
