一株撒坝猪源大肠杆菌噬菌体的生物学特性研究
2021-07-28高飞龙单春兰赵维薇高利波
万 全,张 博,高飞龙,单春兰,赵维薇,邓 静,王 喜,赵 汝,高利波,高 洪*
(1. 云南农业大学 动物医学院,云南 昆明 650201;2. 云南农业大学 动物科学技术学院,云南 昆明 650201; 3.云南农业大学 食品科学技术学院,云南 昆明 650201)
大肠埃希氏菌(Escherichiacoli,E.coli)通常称大肠杆菌,革兰氏阴性菌,显微镜下呈杆状,无芽孢,是人和温血动物肠道内正常菌群成员之一[1-2]。后来陆续有研究发现某些特殊血清学的大肠杆菌可引起人畜类疾病,尤其对婴幼儿和幼畜,极易引起严重腹泻及败血症甚至死亡[3]。D'rlerelle等[4]发现噬菌体并成功地将噬菌体应用于细菌性疾病的治疗,拉开了噬菌体研究的帷幕。噬菌体是一类能够专一性感染其宿主菌的病毒,宿主菌可以是细菌、真菌、放线菌或螺旋菌等微生物[5],具有病毒的一般特性,个体微小、无完整的细胞结构且只有一种核酸作为遗传物质,利用宿主菌的复制合成自身成分并组装,通过破坏宿主菌来释放子代噬菌体,通常情况下,有细菌的地方就有相应的噬菌体存在,与宿主菌共斗争共进化,在应对细菌感染疾病方面具有重要的潜力[6-7]。迄今为止对噬菌体的研究主要集中于革兰阳性菌源,常见革兰阴性菌源噬菌体的研究则鲜见报道,故而本研究从大肠杆菌源噬菌体出发,旨在探究噬菌体的分离鉴定方法并了解其生物学特性,以期为噬菌体的进一步应用及相关研究提供一定参考依据。
1 材料与方法
1.1 试验材料
云南撒坝猪源大肠杆菌分离株,由云南农业大学动物医学院病理实验室鉴定并保存(96株撒坝猪源大肠杆菌中92株已确定血清型,分属9个血清型,其中优势血清型为O12、O16和O119,分别占分离菌株的20.83 %、14.58 %和15.63 %)。LB肉汤培养基、LB琼脂培养基、SM缓冲液,细菌基因组DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒、DNA片段纯化试剂盒均购自于天根生物科技有限公司。其他试剂均为国产分析纯产品。
1.2 噬菌体的分离与纯化
噬菌体的分离采用増殖分离法[8],并对其进行纯化培养后保存以备开展后续实验研究。
1.3 噬菌体的衣壳蛋白gp23基因鉴定
根据GeneBank基因库中噬菌体衣壳蛋白gp23基因序列保守区域设计引物,序列为F:5'-TGTTATGGTATGGTCGCGTGCTAT-3';R:5'-TGAAGTTACCTTCACCACGACCGG-3',经PCR扩增得到衣壳蛋白gp23基因,目的片段大小预期为850 bp左右。扩增产物经纯化回收送至公司测序,经序列比对后进行遗传进化分析。
1.4 噬菌体效价及裂解谱的测定
双层平板法测定噬菌体效价,纯化后的噬菌体悬液用SM缓冲液作10倍连续稀释,每个稀释度取100 μL,加入到0.1 mL宿主菌悬液中混合均匀,并于37 ℃温箱培养过夜,测定噬菌斑数量根据公式计算噬菌体效价,每个稀释度重复试验3次,取平均值。噬菌体的裂解谱测定采用单斑法[9],取200 μL培养至对数期的待测菌悬液均匀涂布于普通琼脂平板上,分别取5 μL噬菌体悬液滴于平板上,干燥后置于37 ℃温箱培养8 ~10 h后观察结果。试验重复3次并设置对照组。
1.5 噬菌体生化特性的鉴定
1.5.1 最佳感染复数的测定 将噬菌体悬液接种至10 mL LB培养基中,于37 ℃恒温振荡培养至对数前期,噬菌体悬液和宿主菌分别按照10-2、10-3、10-4、10-5、10-6和10-7的比例混合均匀,加入LB液体培养基使各管总体积相同。37 ℃、160 rpm振荡培养4 h,2 000 g离心10 min,收集上清,经稀释后测定效价。
1.5.2 噬菌体热稳定性的测定 取100 μL纯化增殖后的噬菌体悬液于无菌EP管中,分别于40 ℃、50 ℃、60 ℃水浴中作用30 min和60 min。水浴结束后立即将EP管置于冰浴中冷却,经稀释后测效价。试验重复3次。
1.5.3 噬菌体pH稳定性的测定 取无菌EP管分别加入不同pH(4、5、6、7、8、9、10、11)的LB培养基,置于37 ℃恒温水浴,待温度平衡后加入100 μL纯化增殖后的噬菌体悬液,37 ℃恒温作用10 h。作用时间结束后测定各管噬菌体效价。试验重复3次。
1.5.4 生长曲线的绘制 参照Lu等[10]和Zhang等[11]的方法测定生长曲线。以感染复数为10-5的比例将噬菌体及宿主菌充分混匀,37 ℃温育15 min后,12 000 g离心30 s,弃上清液,用SM缓冲液洗涤沉淀以去除游离的未吸附于宿主菌的噬菌体,加入10 mL LB培养基并充分混匀,于37 ℃、160 rpm振荡培养并开始计时,从感染开始起每隔10 min取样100 μL,12 000 g离心30 s,取上清测定噬菌体滴度,试验重复3次并取平均值,同时设置对照组。
2 结 果
2.1 噬菌体的分离与纯化
试验分离过程中对噬菌体原液反复纯化5~6次,直至得到的噬菌斑形态、大小均一致,即为1株纯化噬菌体,本试验得到的噬菌斑为直径0.5~1 mm,边缘整齐,呈乳白色的圆形噬菌斑。
2.2 衣壳蛋白gp23基因的扩增及遗传进化分析
经PCR扩增噬菌体衣壳蛋白gp23基因,于琼脂糖凝胶电泳后呈现出850 bp左右的扩增条带,与预期大小相一致(见图1)。
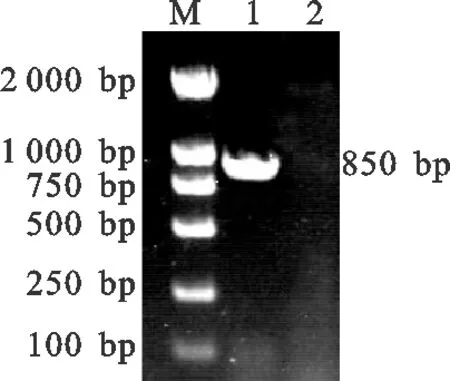
图1 噬菌体衣壳蛋白gp23基因 PCR扩增产物M. DL2000 DNA marker;1. 衣壳蛋白gp23基因;2. 阴性对照Fig.1 The amplification product of phage capsid proteingp23 gene by PCRM. DL2000 DNA marker;1. Capsid protein gp23 gene;2. Negative control
用DNAstar软件对序列进行比对及遗传进化分析。结果显示,分离得到的噬菌体与有尾噬菌体目、肌尾噬菌体科,T4-like噬菌体属的slur14处于同一小分支,亲缘关系最近(见图2)。
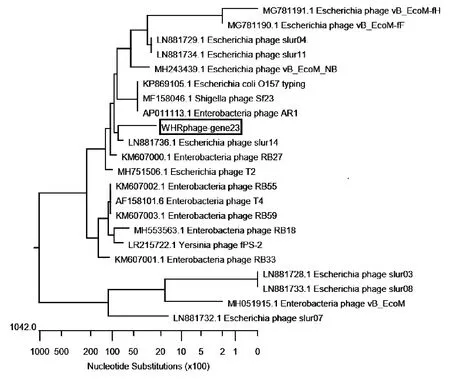
图2 基于衣壳蛋白gp23核苷酸序列构建的系统进化树Fig.2 Phylogenetic tree constructed based on thenucleotide sequence of capsid protein gp23
2.3 噬菌体效价和裂解谱的测定结果
由表1知,分离株对57株大肠杆菌具有裂解性,裂解率为61.95%,对25株大肠杆菌具有完全裂解性,完全裂解率为27.17%,针对优势血清型O12、O16和O119的裂解率分别为70%、71.4%和60%,表明该噬菌体具有较宽泛的噬菌谱和较强的裂解性。
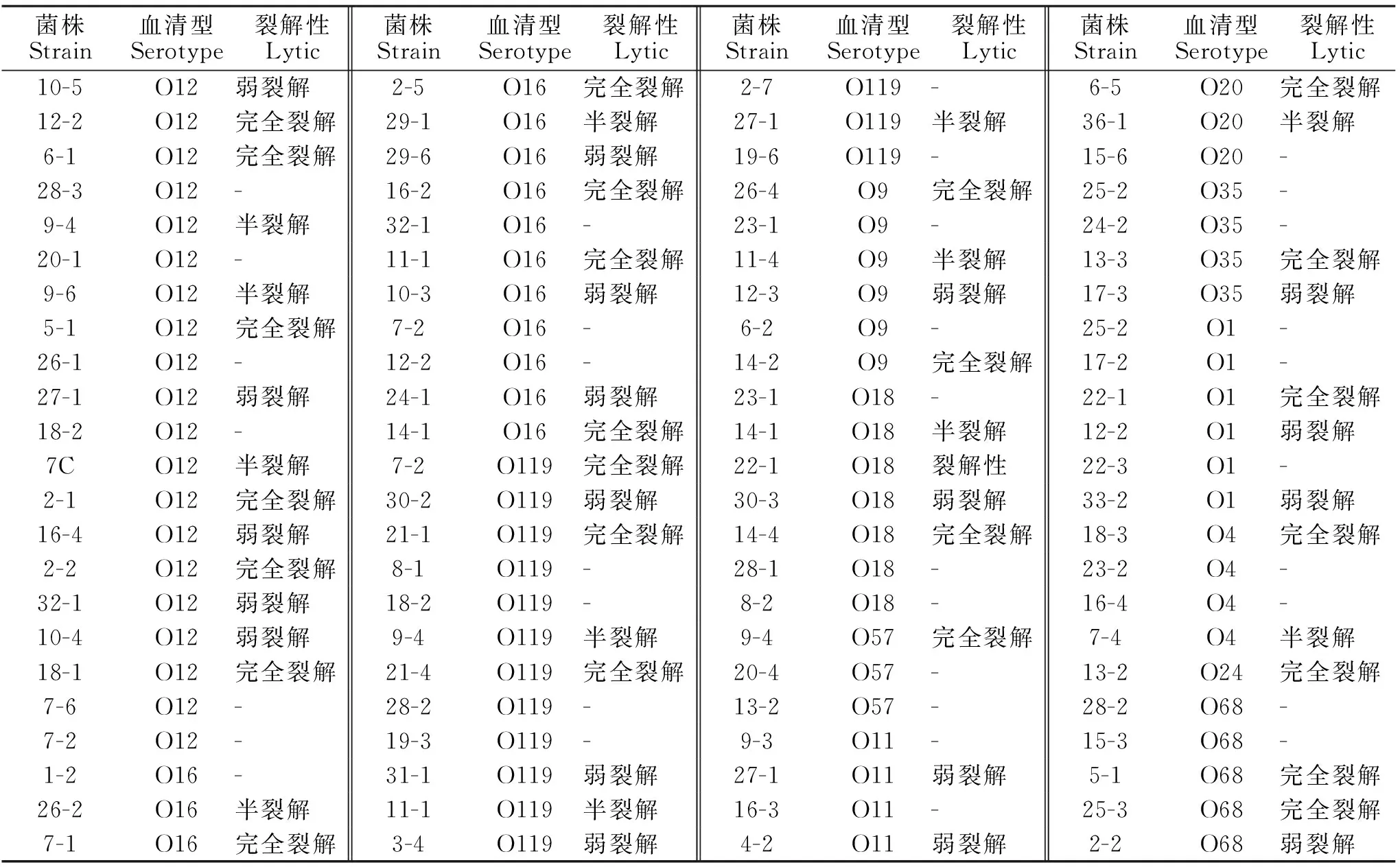
表1 噬菌体的裂解谱结果Table 1 Experimental results of phage fragmentation spectrum
2.4 噬菌体生化特性分析
2.4.1 最佳感染复数测定结果 由表2可见,当噬菌体和宿主菌以10-6比例混合后,产生的子代噬菌体数量最多,噬菌体的效价高达6.95×109pfu/mL,表明噬菌体最佳感染复数为10-6。
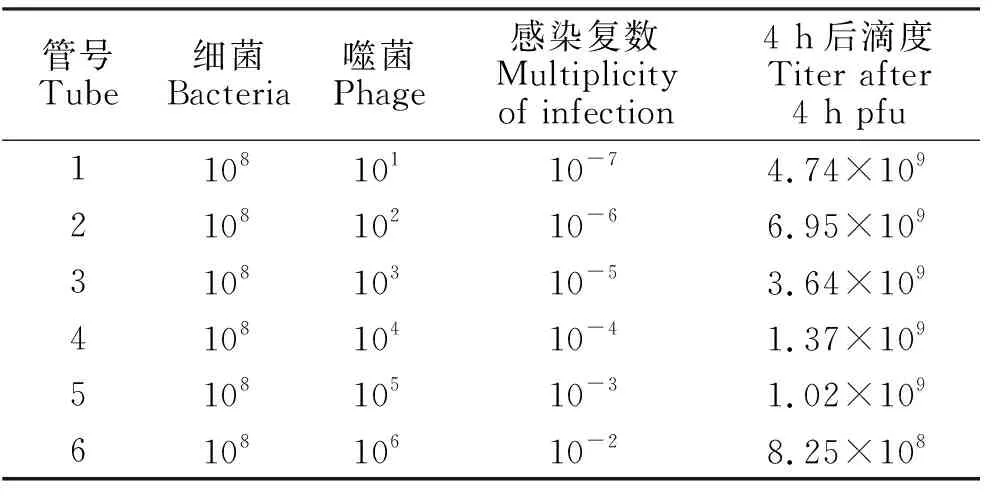
表2 不同感染复数下噬菌体的效价Table 2 Bacteriophage titers at differentmultiplicities of infection mL
2.4.2 热稳定性测定结果 由表3可见,在40 ℃环境下作用30 min后,噬菌体基本保持原活性,作用60 min后,效价下降不明显;在50 ℃下分别作用30 min和60 min后,其效价仍维持在108pfu/mL以上;60 ℃作用30 min和60 min后,噬菌体效价下降变化较大,分别降低了3个和4个数量级。
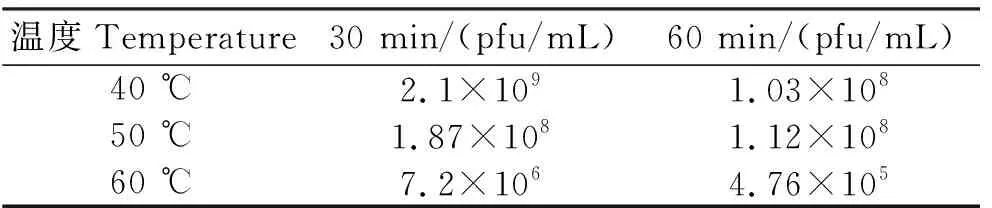
表3 不同温度下噬菌体的效价Table 3 Phage titers at different temperature
2.4.3 pH稳定性测定结果 由表4可见,在pH 5~9范围内,噬菌体效价均可保持在108pfu/mL以上,特别是在pH为7和8的时候,噬菌体的活性最高;随着pH的逐渐降低或升高,在pH<5或pH>9时,噬菌体的效价显著下降。
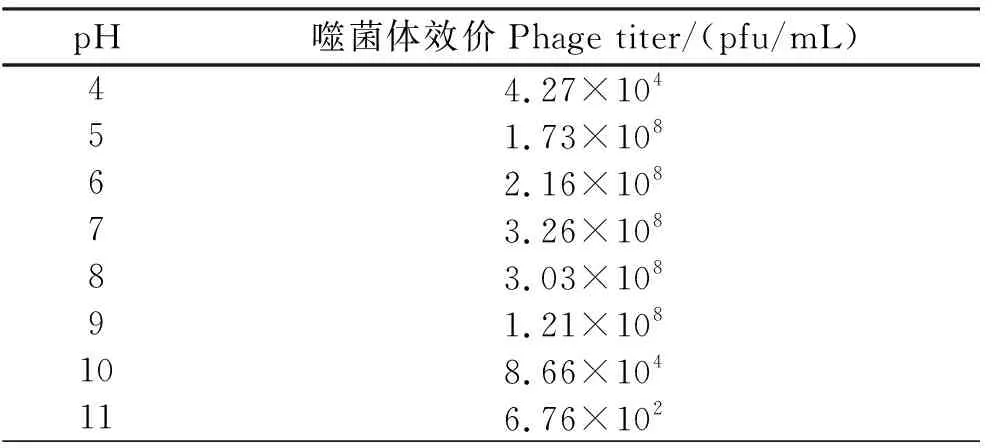
表4 不同pH环境作用下噬菌体的效价Table 4 Phage titers in different pH environments
2.4.4 生长曲线绘制结果 由图3可见,噬菌体感染宿主菌的潜伏时间约为30 min,爆发时间约为120 min。根据裂解量计算公式,计算得出该噬菌体裂解量为41 pfu/cell。
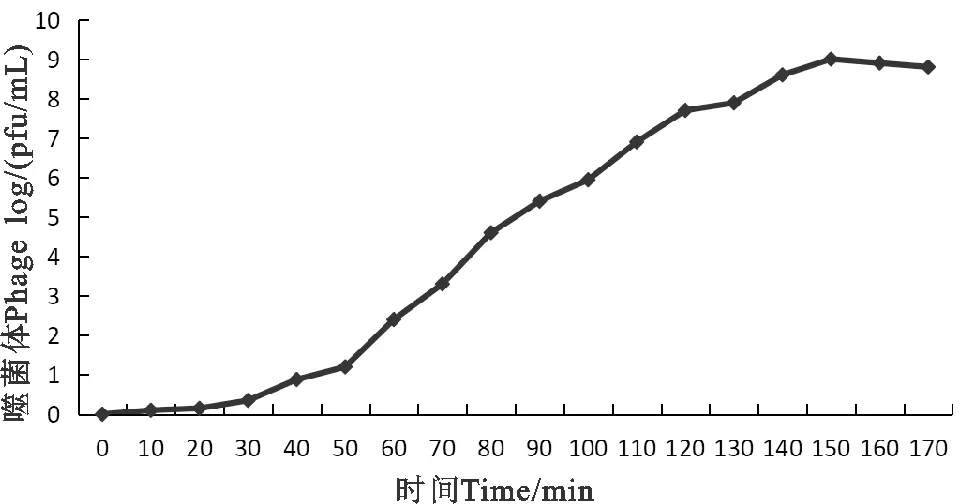
图3 噬菌体一步生长曲线Fig. 3 One-step growth curve of phage
3 讨 论
大肠杆菌作为食源性疾病及肠道感染疾病的重要病原,伴随抗生素的大量和不合理使用,多重和交叉耐药性问题日趋严重,已经威胁到公共卫生安全[12]。在新型抗菌制剂的研发极为迫切之时,噬菌体作为一种潜在的抗菌制剂重新得到大家的重视[13]。此外,作为细菌的天敌,噬菌体被认为是一种潜在的抗生素替代物,或者说,是当前多重耐药性背景下对抗生素的一种重要补充[14]。对噬菌体进行分离和鉴定是进一步开展研究的基础和前提,对噬菌体生化特性的探究可为了解噬菌体的适用范围,保障其更好的发挥效能而奠定基础。
本研究采用双层琼脂平板法,自某规模化养殖场采集的粪便所分离的大肠杆菌増殖分离纯化出1株裂解性噬菌体,并通过相关基因鉴定及生物信息学软件分析,判定出分离株属有尾噬菌体目、肌尾噬菌体科T4-like噬菌体。本研究结果显示,该噬菌体效价较高,表明其可能具有良好的抑菌应用价值。裂解试验结果显示该噬菌体具有较宽的裂解谱,为1株宽泛噬菌体。姜姗等[15]所分离得到的噬菌体也表现出宽宿主谱特性,可同时裂解不同动物来源的肠道内和肠道外大肠杆菌。鉴于大肠杆菌种类繁多,宽宿主谱的噬菌体的获得具有非常重要的意义[16]。该噬菌体在大肠杆菌宿主菌上的最佳感染复数为10-6,其确定将有利于获得高效价的噬菌体悬液,为噬菌体的大量制备提供数据支撑。该噬菌体在较广的温度范围内均能保持较高活性,60 ℃作用30 min后,效价才表现明显下降。Lu等[17]分离的乳酸杆菌源噬菌体甚至可耐受100 ℃高温,推测不同噬菌体之间的温度稳定性可能存在明显差异。研究表明,噬菌体温度稳定性的差异可能是由噬菌体表面特异性吸附蛋白的不同造成的[18]。pH通过影响噬菌体和宿主细胞表面所带电荷的改变,进而影响噬菌体对宿主细胞的吸附作用,适宜的pH更有利于噬菌体的吸附[19]。本研究中,该噬菌体对pH的稳定性较好,可以在pH为5~9范围内保持较高效价。一步生长曲线可以清楚的显示噬菌体的生长规律,体现噬菌体的潜伏期、裂解期和裂解量等参数。本试验测得噬菌体的潜伏期为30 min,裂解量达41 pfu/cell相关研究表明潜伏期短和裂解量大的噬菌体是比较理想的选择[20]。
4 结 论
本研究结果表明,从撒坝猪源大肠杆菌分离到的一株裂解能力较强、裂解谱较广且对理化因素耐受力较强的T4-like噬菌体。
