微小RNA-34a对A549细胞增殖的影响及其可能机制▲
2021-07-28左清平张顺芝何鸽飞刘晓慧
左清平 张顺芝 何鸽飞 刘晓慧 袁 立
(湖南省长沙市第一医院药剂科,长沙市 410000,电子邮箱:aahyxaa@163.com)
肺癌又称为原发性支气管肺癌,根据病理分级可分为非小细胞肺癌和小细胞肺癌两大类[1]。肺癌发病机制所涉及的生物学过程较为复杂,恶性程度高,易复发与转移,近年来肺癌的发病率明显上升,其死亡率在恶性肿瘤死因中位居第一位[2],但目前临床上尚无肺癌的特异性治疗方法,晚期肺癌患者的病情难以控制,复发率高,患者5年生存率低于14.5%[3]。研究表明,肺癌本质上是一种多基因疾病,其发病机制受多个基因的共同调节,疾病的发展与转归机制复杂[4]。因此,从肺癌的发病机制出发寻找新的治疗途径,做到早期诊断与早期治疗是目前肺癌治疗的重点[5]。微小RNA(microRNA,miRNA)是一类非编码RNA序列,可在转录后水平上对基因的表达进行调控[6],参与细胞的增殖、凋亡、癌变等多种生物学过程,miRNA的异常表达与疾病的发生发展密切相关[7-8]。miRNA-34a被证明在多种肿瘤疾病中呈低表达,并具有抑癌作用。研究显示,miRNA-34a在肺癌患者血清中低表达,并与患者预后直接相关[9]。但miRNA-34a是否可以抑制肺癌细胞的侵袭和增殖,是否可作为肺癌的早期诊断和预后评估指标,目前尚未完全清楚。本研究旨在探讨miRNA-34a对肺癌细胞增殖与迁移的影响,并分析其可能的分子作用机制,为肺癌的防治和预后评估提供参考。
1 材料与方法
1.1 细胞来源 人肺癌细胞株A549(批号:XTK20181215S)、H1299(批号:HKT20190111)、PC9(批号:FGF20190104)及人正常肺上皮细胞系BEAS-2B细胞(批号:FDG20190212)均购自美国菌种保藏中心。
1.2 主要试剂与设备 PCR试剂盒(批号:120111157ST),RNA提取试剂盒(批号:151411158TR)均购自日本TaKaRa公司;澳洲胎牛血清(批号:TH2019514S)购自鼎国公司,RPMI 1640培养基(批号:TH2019042B)购自Gibco公司;Opti-MEM培养基(批号:GH2019043G)购自Gibco公司;转染试剂Lipofectamine 3000(批号:JT20190108)购自Invitrogen公司;MTT试剂盒(批号:20190318)购自日本TaKaRa公司;荧光素酶检测试剂(批号:H20190224)购自Promega北京生物技术有限公司;miRNA-34a模拟物(批号:20181227)和阴性对照(批号:20181227)购自上海吉玛生物科技有限公司;miRNA-34a模拟物序列为:UGGCAGUGUCUUAGCUGGUUGU。目标基因探针和内参基因探针的5′ 端均采用 FAM 报告荧光标记,3′ 端均采用TAMRA淬灭荧光标记;Transwell小室(批号:S5478RTA)购自美国Millipore 公司;信号传导与转录激活因子3(signal transducer and activator of transcription,STAT3) 兔单克隆抗体(批号:GT20181114)购自Abcam公司;辣根过氧化物酶标记二抗(批号:20181217)购自北京中杉金桥公司;磷酸缓冲盐溶液(phosphate buffered saline,PBS,批号:20190425),0.25%胰蛋白酶(批号:20190502)均购自四季青生物有限公司;TRIzol试剂购自日本TaKaRa公司(批号:14111164ER);二甲基亚砜购自阿拉丁试剂有限公司(批号:2019S0124);总蛋白提取试剂盒购自碧云天生物有限公司(批号:20180928);聚偏二氟乙烯膜于甲醇溶液购自北京生物技术有限公司(批号:20180830);三羟甲基氨基甲烷缓冲液(T-TBS)购自碧云天生物有限公司(批号:20190221)。病理图像分析仪(型号:OLYMPUSDP71)购自奥林巴斯映像销售有限公司,凝胶成像仪购自美国Bio-Rad公司,恒温水浴箱购自上海亚荣生物仪器厂,荧光定量PCR仪(型号:IQ5)购自美国Bio-Rad公司,5804R型高速台式冷冻离心机购自艾本德中国有限公司,722S型紫外分光光度计购自上海精密科学仪器有限责任公司。
1.3 方法
1.3.1 细胞培养:取A549、H1299、PC9、BEAS-2B细胞,分别复苏后,观察细胞培养液颜色,并在显微镜下观察细胞形态与细胞密度。轻轻倒出瓶内的细胞培养基,用移液枪吸取2 mL PBS,打入瓶底,将培养瓶来回轻晃几次,使PBS与细胞充分接触清洗细胞,重复两次,弃去培养瓶内的PBS,加入RPMI 1640细胞培养基(含10% 胎牛血清及双抗)5 mL,于37℃、5% CO2培养箱中培养。当细胞铺满瓶底80%以上时,弃去培养瓶内培养液,加入PBS 2 mL,按上述方法清洗细胞两次后,弃去培养瓶内PBS,滴入0.25%胰蛋白酶(不含乙二胺四乙酸)1 mL消化细胞,按1 ∶3进行分瓶传代培养,取对数生长期细胞进行实验。
1.3.2 实时定量PCR方法:分别取上述对数生长期的实验用细胞,加入TRIzol试剂1 mL,吹打数次,静置5 min。按照RNA提取试剂盒说明书提取总RNA,采用分光光度计检测其纯度与浓度,然后按照反转录试剂盒说明书操作将RNA反转录成cDNA,采用实时荧光定量PCR法检测人肺癌细胞系A549、H1299、PC9及人正常肺上皮细胞系BEAS-2B中miRNA-34a的表达情况,反应体系为20 μL(2×SYBR 10 μL+RNA Free Water 8.2 μL+Primer F 0.4 μL+Primer R 0.4 μL+Cdna 1 μL),反应条件:94℃~98℃ 30 s,60℃30 s,72℃30 s,35个循环,72℃延伸8 min,各设置3个复孔,实验重复3 次,以U6为内参基因,目的基因及内参基因的引物序列见表1。采用2-ΔΔCt法计算miRNA-34a的表达量。

表1 实时荧光定量PCR引物序列
1.3.3 细胞转染:(1)将miRNA-34a模拟物用Opti-MEM培养基配置成 20 μmol/L母液,放入-20℃冰箱保存备用。取对数生长期的A549细胞,用0.25%胰蛋白酶(不含乙二胺四乙酸)消化,重悬,调整细胞密度为2×105个/mL,接种于6孔板中,于37℃、5%二氧化碳培养箱中培养。待细胞铺满瓶底80%左右时,采用0.25%胰蛋白酶消化后吸出至12孔板培养基中。(2)配置FAM标记和未标记的miRNA 模拟物转染液:取5 mL EP管,分别加入Opti-MEM培养基10 μL,然后加入20 μmol/L的miRNA模拟物母液5 μL,轻轻混匀,室温下孵育5 min,加入Lipofectamine 3000 10 μL,轻轻混匀,室温下孵育15 min,最后加入Opti-MEM 990 μL,使miRNA模拟物终浓度为100 nmol/L,将配置好的FAM标记的miRNA-34a 模拟物(100 nmol/L)和FAM未标记的miRNA-34a 模拟物(100 nmol/L)转染液加入12孔板中,于37℃、5%二氧化碳培养箱中转染8 h后去除转染液,加入Opti-MEM培养基1 mL,继续培养24 h。在荧光显微镜下观察,转染后发绿色荧光为转染成功。本研究中,转染效率达90%以上。
1.3.4 MTT法检测miRNA-34a对肺癌细胞增殖的影响:取对数生长期的A549细胞接种于96孔板中,密度为2×105个/mL,分为miRNA-34a模拟物组、阴性对照组和空白对照组,其中miRNA-34a模拟物组、阴性对照组进一步分为200 nmol/L、100 nmol/L、50 nmol/L组。除空白对照组外,其余各组均按上述miRNA-34a模拟物瞬时转染步骤对细胞进行瞬时转染(miRNA-34a模拟物各亚组分别加入不同浓度miRNA-34a模拟物,阴性对照组加入不同浓度的miRNA模拟物序列),转染24 h及48 h后吸去培养基。每孔加入20 μL新鲜配制的含0.2 mg/mL MTT的PBS溶液,37℃继续孵育4 h。吸去PBS,并加入二甲基亚砜150 μL,用微型超声振荡器混匀后,在酶标仪上以试验波长为570 nm,参比波长为450 nm测定光密度值。细胞增殖抑制率(%)=[(B-A)/B×100%],其中,A为实验药物组光密度值,B为空白对照组光密度值。
1.3.5 双荧光素酶报告:采用预测软件Targetscan(http://www.targetscan.org)和miRanda(http://www.microrna.org/microrna/home.do)进行miRNA-34a作用靶基因预测。结果显示,STAT3可能为miRNA-34a的下游靶基因。构建STAT3野生型(STAT3WT-Luc)与突变型(STAT3MUT-Luc)荧光素酶报告基因质粒,将STAT3WT-Luc、STAT3MUT-Luc分别与200 nmol/L miRNA-34a模拟物和200 nmol/L阴性对照(miRNA模拟物随机序列)同时转染到A549细胞内(转染方法同1.3.3中的miRNA-34a模拟物瞬时转染步骤)。转染48 h后获取细胞,检测各组的萤火虫荧光素酶(Firefly)的活性。
1.3.6 蛋白免疫印迹法检测STAT3蛋白的表达情况:取对数生长期的细胞接种于6孔板,密度为2×105个/mL,分为miRNA-34a模拟物组、阴性对照组、空白对照组,阴性对照组采用miRNA模拟物随机序列(200 nmol/L)转染至A549细胞,miRNA-34a模拟物组采用miRNA-34a模拟物(200 nmol/L)转染至A549细胞,24 h后收集细胞,采用总蛋白提取试剂盒提取细胞总蛋白,采用BCA法进行蛋白定量测定。制作10% 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳胶,置于电泳槽,每孔加入20 μL的蛋白样品,以110 V恒压电泳70 min分离蛋白。聚偏二氟乙烯膜于甲醇溶液中浸泡20 s,放入转移缓冲液平衡,以110 V恒压将蛋白转移至聚偏二佛乙烯膜。转印结束后,将膜放入T-TBS(含5% 脱脂奶粉)中,于37℃条件下封闭1 h,然后采用T-TBS漂洗3次,10 min/次;4℃孵育一抗(目的蛋白稀释度为1 ∶100,β-actin稀释浓度为1 ∶2 000,孵育液含3%脱脂奶粉)24 h;采用T-TBS漂洗3次,5 min/次;37℃孵育二抗(稀释浓度为1 ∶2 000,孵育液含2%脱脂奶粉)1 h,用T-TBS漂洗5次,5 min/次;制备约1 mL电化学发光工作液,室温孵育转印膜1 min,保鲜膜密封,暗盒中放入X线片光曝光5~10 min后进行显影和定影,采用Image J软件统计灰度值,以β-actin为对照,计算STAT3蛋白的相对表达量。实验重复3次。
1.4 统计学分析 采用SPSS 19.0软件进行统计分析,计量资料以(x±s)表示,两组间比较采用成组设计t检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 miRNA-34a在肺癌细胞系中的表达情况 相对于BEAS-2B细胞,A549、H1299、PC9细胞系中miRNA-34a的表达量均下降(均P<0.05),见表2。

表2 A549、H1299、PC9 和BEAS-2B细胞系中miRNA-34a的表达情况(x±s)
2.2 miRNA-34a对A549细胞增殖的抑制作用 200 nmol/L、100 nmol/L的miRNA-34a模拟物转染细胞24 h、48 h后,其对A549细胞的增殖抑制率均高于相同剂量的阴性对照组和空白对照组(均P<0.05),其中转染200 nmol/L miRNA-34a模拟物48 h后,抑制率可达(47.32±7.32)%。见表3和图1。
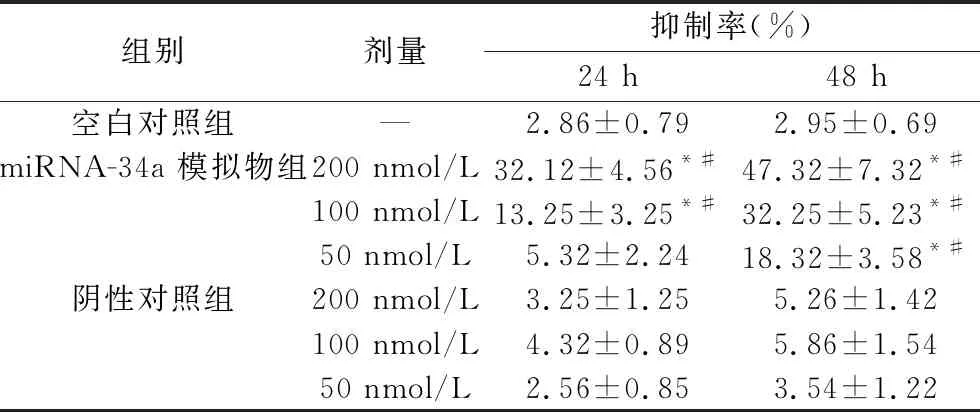
表3 miRNA-34a 模拟物对A549细胞增殖的抑制作用(x±s)

图1 转染48 h后A549细胞增殖情况(×100)
2.3 双荧光素酶报告分析结果 相比于阴性对照组,野生型STAT3WT-Luc和miRNA-34a模拟物共转染明显降低STAT3的3′UTR区荧光酶活性(P<0.05),而突变型STAT3MUT-Luc和miRNA-34a模拟物对STAT3的3′UTR区荧光酶活性无影响,见表4。

表4 双荧光素酶活性检测(x±s)
2.4 miRNA-34a对A549细胞中STAT3蛋白表达的影响 蛋白免疫印迹试验结果显示,转染24 h后,miRNA-34a模拟物组STAT3蛋白表达水平低于阴性对照组和空白对照组(均P<0.05),而阴性对照组与空白对照组差异无统计学意义(P>0.05)。见表5和图2。

表5 3组细胞的STAT3蛋白表达水平的比较(x±s)

图2 3组细胞STAT3蛋白表达水平
3 讨 论
肺癌是全球发病率和死亡率最高的肿瘤,每年约有150万人死于肺癌[10]。肺癌的发生受多种因素影响,发病机制至今尚未被完全阐明。随着分子生物学的进步,人们已经认识到肿瘤的发生发展是一个复杂的生物学过程,该过程涉及多基因、多因素的共同作用[11]。近年来,肺癌的基因治疗逐渐成为研究者关注的热点。
miRNA 通过与其靶基因mRNA的3′UTR区域互补结合,在转录后水平调控靶基因的表达[12]。研究证实,在肺癌中存在多种 miRNA异常表达,miRNA在肺癌生长侵袭过程可能主导调控作用,如在人肺癌细胞中,miRNA-15通过调控相关靶基因及下游信号通路,抑制肺癌细胞的增殖与侵袭,使肺癌患者的血清miRNA-155呈低表达[13]。李元滨等[14]对肺癌组织与正常肺组织进行miRNA表达谱差异研究,结果发现38种差异表达的miRNA,如miRNA-21、miRNA-191、miRNA-17-5p及miRNA-155等。Sun等[15]利用miRNA基因芯片技术对正常肺组织、非转移性小细胞肺癌组织和转移性非小细胞肺癌组织进行分析发现,在肺癌组织中存在miRNA-18b-5p、miRNA-643、miRNA-150、miRNA-3940-5p表达,且这些差异表达的miRNA与患者预后存在一定联系。
miRNA-34a家族作为与肿瘤相关的众多miRNA家族中的重要一员,其在恶性肿瘤中的表达及调控作用受到了研究者的关注[16]。miRNA-34a编码基因位于1p36.22,该区域在多种恶性肿瘤中缺失或在启动子区存在高度的甲基化,导致miRNA-34a的表达异常[17]。荧光素酶报告基因分析结果显示,miRNA-34a的编码基因存在肿瘤抑制蛋白p53的结合位点,p53可促进miRNA-34a的转录与表达[18]。将miRNA-34a转染神经瘤细胞质,肿瘤细胞凋亡增加,肿瘤细胞的增殖与侵袭受到抑制[19]。miRNA-34a的作用机制具有多样性,并可能依赖于细胞周期,比如外源性miRNA-34a转染H1299肺癌细胞,可诱导细胞M期阻滞,而将其转染于U-2OS骨肉瘤细胞则仅引起细胞的G1期停滞[20]。此外,有研究显示,肺癌细胞中miRNA-34a的表达量较低,其表达水平与肺癌细胞增殖速度、存活能力呈负相关[21]。 Fu等[22]研究发现,在卵巢癌细胞中miRNA-34a呈低表达,而在卵巢癌细胞中使miRNA-34a过表达则可抑制肿瘤血管生成,其作用靶点可能为人表皮生长因子受体2和人表皮生长因子受体3。
本研究结果显示,在肺癌细胞系中,miRNA-34a均呈低表达,转染miRNA-34a 模拟物后,A549细胞的增殖受到抑制。STAT3蛋白是细胞内的重要转录因子之一,是多个细胞增殖、癌变、凋亡信号通路汇聚的交点。研究发现,在多种肿瘤细胞中均发现STAT3持续性过度激活与过表达[23]。本研究利用TargetScan、miRanda等预测软件对miRNA-34a的靶基因进行预测发现,STAT3可能为miRNA-34a的下游作用靶点。进一步行双荧光素酶标记,结果证明STAT3为miRNA-34a的直接作用靶点。进一步的蛋白免疫印迹结果显示,转染miRNA-34a模拟物后,A549细胞STAT3蛋白相对表达水平低于空白对照组和阴性对照组(P<0.05),表明miRNA-34a能够降低A549细胞中的STAT3蛋白表达水平,从而抑制STAT3下游信号通路的激活,进而抑制A549细胞的增殖。
综上所述,肺癌细胞miRNA-34a呈低表达水平,上调miRNA-34a的表达水平,可抑制肺癌细胞的增殖,其机制可能与miRNA-34a抑制STAT3下游信号通路的激活有关。
