超声响应性纳米粒子用于超声/光声成像引导下声动力/饥饿治疗小鼠结直肠癌
2021-07-27顾海涛张剑波王志刚王继见
徐 伟,李 洋,顾海涛,张剑波,王志刚,王继见*
(1.重庆医科大学附属第二医院胃肠外科,2.超声科,重庆 400010;3.重庆医科大学超声影像学研究所 重庆市重点实验室,重庆 400010)
声动力治疗(sonodynamic therapy, SDT)无创、操作简便、超声穿透范围深并可定点靶向辐照,广泛用于治疗肿瘤[1],但肿瘤的异质性和复杂性使单一治疗方式无法达到根治效果[2]。通过阻断营养供应使肿瘤细胞处于饥饿状态成为抗肿瘤治疗的潜在策略[3]。随着精准医疗理念的提出,可视化治疗成为目前研究热点[4]。多模态成像可更加全面地获取肿瘤影像学信息[5]。本研究将卟啉锌(zinc porphyrin, TPZ)声敏剂和葡萄糖氧化酶(glucose oxidase, GOD)装载于脂质体内,制备超声响应性纳米粒子(nanoparticles, NP)TPZ-GOD NP,以期实现超声/光声双模态成像引导下声动力联合饥饿治疗小鼠结直肠癌。
1 材料与方法
1.1 主要动物、材料与仪器 37只无特定病原体(specific pathogen free, SPF)级雌性BALB/c小鼠,4~6周龄,体质量18~25 g,由重庆医科大学实验动物中心提供,饲养于室温37℃、相对湿度40%~70%环境下,光照明暗周期12 h,自由采食与饮水。
二棕榈酰磷脂酰胆碱(dipalmitoyl phosphatidylcholine, DPPC),二硬脂酰基磷脂酰乙醇胺-甲氧基聚乙二醇2000(distearoyl phosphoethanolamine-methoxy polyethylene glycol 2000, DSPE-mPEG 2000)及胆固醇(西安瑞禧有限生物科技有限公司),3,3’,5,5’-四甲基联苯胺(tetramethylbenzidine, TMB),辣根过氧化物酶(horseradish peroxidase, HRP),活性氧荧光探针2’,7’-二氯二氢荧光素二乙酸酯(2’,7’-dichlorodihydrofluorescein diacetate, DCFH-DA),GOD、TPZ及全氟戊烷(perfluoropentane, PFP)(Sigma),三氯甲烷(重庆川东化工有限公司),DMEM细胞培养基(Gibico),胰酶(上海碧云天生物技术有限公司),细胞计数试剂盒-8(cell counting kit-8, CCK-8)(Dojindo)。
旋转蒸发仪(上海亚荣生化仪器有限公司),声振仪(Sonic),Malvern Zetasizer Nano ZS90粒径测量仪,Hitachi S-3400N透射电镜仪,BD流式细胞仪,UV2500-VIS紫外分光光度计,低强度聚集超声(重庆医科大学超声分子影像学研制),Esaote诊断超声仪,Visual Sonics Vevo LASER光声成像仪。
1.2 制备TPZ-GOD NP 采用薄膜水化法制备TPZ-GOD NP。按12∶4∶4∶5比例将DPPC、DSPE-mPEG 2000、胆固醇及TPZ溶解于三氯甲烷溶剂中,50℃下旋转蒸发2 h,待圆底烧瓶内形成紫色薄膜时加入5 ml磷酸盐缓冲液(phosphate buffer solution, PBS)冲洗底部脂质膜;于冰浴条件下超声乳化200 μl(5 mg/ml)GOD和200 μl PFP,功率100 W,时间2 min(工作5 s间歇5 s),之后将其加入上述脂质膜溶液中继续乳化3 min,功率同前,以低温离心机离心5 min (5 000 rmp),收集制备出的TPZ-GOD NP。
1.3 检测基本性质 以透射电镜观察TPZ-GOD NP形态、结构,以马尔文激光粒度仪检测其粒径;利用UV-2 500紫外分光光度计检测TPZ与GOD的吸收光谱并绘制相关标准曲线,计算TPZ与GOD的包封率与载药量;检测TPZ、GOD与TPZ-GOD NP紫外吸收图谱。采用TMB法验证TPZ-GOD NP中GOD活性,先配制pH 5.5的醋酸-醋酸钠缓冲液、1 mg/ml的HRP水溶液、10 mmol/L的葡萄糖溶液以及含10 mg/ml的TMB二甲基亚砜溶液,按缓冲液、TPZ NP/GOD/TPZ-GOD NP、HRP、TMB、葡萄糖的顺序混合溶液,待显色后拍照。吸取上述溶液至96孔板,采用酶标仪测定TMB吸光度值。将制备的TPZ-GOD NP置于EP管内,以超声辐照(功率2 W/cm2,频率1 MHz),200 kDa透析膜过滤溶液,收集液体后采用紫外分光光度计检测其吸光度值,计算不同时间点下GOD的累计释放量,绘制GOD药物释放曲线。
1.4 细胞吞噬作用 体外培养结直肠癌CT-26细胞,胰酶消化对数生长期细胞,并以1×105个/孔的浓度接种于6孔板内。24 h后弃置孔板内培养基,加入浓度为1 mg/ml DiI修饰的TPZ-GOD NP无血清培养基,继续培养1、2、3、4、24 h。待胰酶消化收集细胞,以流式细胞仪分析。
1.5 体外活性氧检测 细胞接种于6孔板24 h后,将其分为对照组、超声组、TPZ-GOD NP组及TPZ-GOD NP+超声组。分别向后2组中加入TPZ-GOD NP溶液(1 mg/ml),孵育3.5 h后加入DCFH-DA溶液继续孵育0.5 h,以PBS洗去孔板内的TPZ-GOD NP和未进入细胞内的DCFH-DA,再对超声组及TPZ-GOD NP+超声组施加超声辐照30 s,以荧光显微镜观察各组荧光强度。
1.6 体外SDT联合饥饿治疗 取对数生长期细胞以1×104个/孔的浓度接种于96孔板内,将细胞分为对照组、超声组、SDT组、饥饿治疗组及联合治疗组,每组5个复孔。待各孔内细胞密度至80%后,对SDT组加入TPZ NP,饥饿治疗组及联合治疗组均加入TPZ-GOD NP溶液(1 mg/ml),孵育4 h;以PBS洗涤孔板3次后,对超声组、SDT组及联合治疗组施加超声辐照30 s;加入CCK-8溶液,检测各组细胞活性。另将细胞培养于共聚焦培养皿中,待细胞生长至70%~80%、予相同处理后加入钙黄绿素/碘化吡啶染料染色,于激光共聚焦下观察细胞颜色。
1.7 体外超声/光声成像 将不同浓度TPZ-GOD NP(100、200、300、400、500 μg/ml)转入凝胶膜型中,超声辐照30 s,之后采集超声造影(contrast enhanced ultrasound, CEUS)图像。将TPZ-GOD NP溶液(2.5 mg/ml)注入凝胶模型中,行光声激光仪全波长(680~970 nm)扫描,获取最佳激发波长。体外配置TPZ-GOD NP(0.5、1.0、1.5、2.0、2.5 mg/ml)溶液,以移液器吸取100 μl至凝胶模型中,以最佳激发波长照射,采集相应浓度光声成像图,定量分析ROI光声信号值。
1.8 模型制备及体内超声/光声成像 收集对数生长期CT-26细胞,以0.25%胰酶消化后离心重悬。将0.1 ml细胞悬液(约1×106个)于小鼠背部皮下注射,使之形成皮丘;待肿瘤体积约100 mm3时,以Esaote超声诊断仪,频率7 MHz线阵探头采集二维超声声像图。对3只小鼠经尾静脉注射200 μl TPZ-GOD NP溶液(5 mg/ml),超声激发并即刻行肿瘤CEUS。另取3只小鼠行体内光声成像,分别于经尾静脉注射NP前后采集肿瘤光声成像图。
1.9 体内SDT联合饥饿治疗 对6只小鼠尾静脉注射DIR荧光染料标记TPZ-GOD NP溶液(5 mg/ml),于注射后0.5、1、2、4、6、8、24 h经眼球内眦静脉取血,测量DIR荧光强度,绘制体内血液代谢曲线,计算TPZ-GOD NP半衰期。 8 h后处死小鼠,剖取肿瘤、心、肝、脾、肺、肾组织,测量其内荧光强度。
将其余25只移植瘤小鼠随机分为5组(n=5),同1.6。经尾静脉注射TPZ-GOD NP(5 mg/ml)8 h后,对超声组、SDT组及联合治疗组以超声辐照小鼠肿瘤区域10 min,间隔5天重复,期间监测小鼠重量与肿瘤体积。15天后处死小鼠并剥离肿瘤,称重、切片后行HE染色。
1.10 统计学分析 采用SPSS 22.0统计分析软件。以±s表示计量资料,组间比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 TPZ-GOD NP基本性状 透射电镜下TPZ-GOD NP呈球形,大小均一(图1A),平均粒径(262.10±62.92)nm;其中TPZ包封率(76.83±6.07)%、载药量(14.78±1.16)%,GOD包封率(14.67±3.01)%、载药量(0.56±0.12)%。TPZ-GOD NP紫外吸收光谱可见2个峰值(257 nm与425 nm处),即TPZ-GOD NP成功包裹TPZ和GOD(图1B)。酶活性检测见GOD和TPZ-GOD NP溶液呈现明显蓝色,而TPZ NP溶液颜色未发生改变(图1C);GOD和TPZ-GOD NP的TMB OD值升高(图1D)。超声辐照后TPZ-GOD NP释放 GOD量逐渐增加,随时间延长,药物浓度增加,于240 s达到峰值[(78.60±4.62)%],300 s后逐渐平稳[(77.52±2.89)%](图1E)。

图1 TPZ-GOD NP基本性状 A.透射电镜图; B.紫外吸收峰图; C.GOD酶活性反应; D.GOD酶活性反应后吸光度值; E.超声激发后TPZ-GOD NP中GOD药物释放曲线
2.2 细胞吞噬作用 DiI修饰的TPZ-GOD NP与CT-26细胞共同孵育后细胞内荧光信号逐渐增强,4 h后荧光强度值达到峰值(58.95±6.44)%,24 h后呈下降趋势。
2.3 体外活性氧检测 荧光显微镜下见超声激发后TPZ-GOD NP产生大量细胞毒性活性氧,呈明显绿色荧光;TPZ-GOD NP组可见微弱荧光,其余2组几无荧光(图2)。

图2 荧光显微镜下观察各组活性氧 A.对照组; B.超声组; C.TPZ-GOD NP组; D.TPZ-GOD NP+超声组
2.4 体外SDT联合肿瘤饥饿治疗 CCK-8结果显示,超声辐照后,联合治疗组细胞存活率明显低于其余各组(P均<0.05),见图3。激光共聚焦显微镜下见联合治疗组细胞呈红色荧光,即明显凋亡/坏死;SDT组与饥饿治疗组见较多绿色荧光;对照组及超声组细胞呈绿色荧光(图4)。

图3 各组细胞存活率比较

图4 体外钙黄绿素/碘化吡啶双染色CT-26细胞图 A.对照组; B.超声组; C.SDT组; D.饥饿治疗组; E.联合治疗组 (红色为死亡细胞,绿色为存活细胞)
2.5 双模态成像 体外CEUS显示,随着TPZ-GOD NP浓度增加,超声显影效果越强(图5),超声信号逐渐增强。680~970 nm波段激发下,TPZ-GOD NP产生光声信号,强度值在790 nm处最大。体外光声成像显示,随纳米酶浓度增加,光声信号值逐渐增加,呈明显线性增强(图6)。经尾静脉注射TPZ-GOD NP后,二维超声及CEUS均可见肿瘤区域超声信号值显著增高(P均<0.05),见图7。体内光声成像中,注射TPZ-GOD NP后,肿瘤内光声信号较注射前明显增加(P<0.05),见图8。
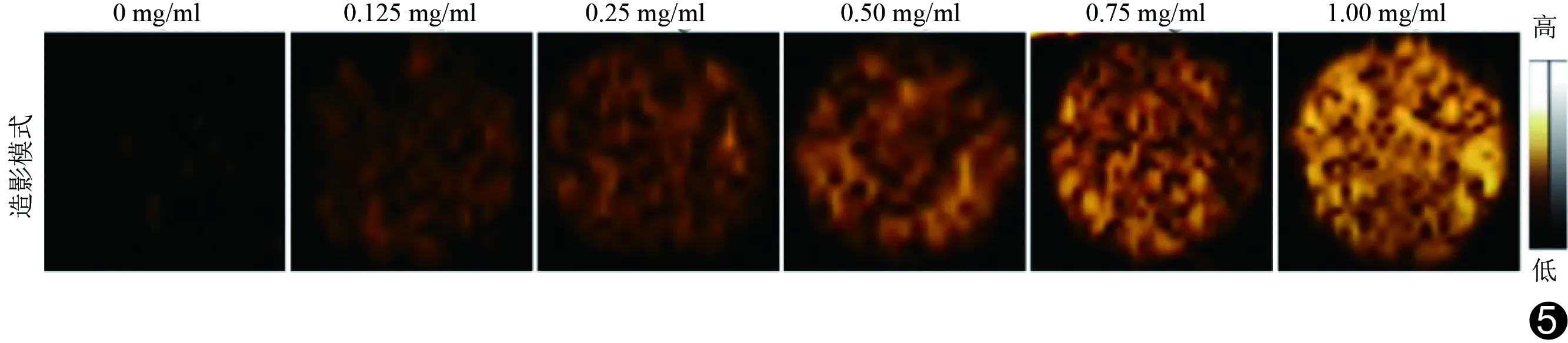
图5 体外CEUS图

图6 体外不同浓度TPZ-GOD NP光声信号

图7 小鼠体内超声图像

图8 小鼠体内光声成像图
2.6 体内SDT联合肿瘤饥饿治疗 小鼠体内TPZ-GOD NP半衰期为17.32 h。注射后TPZ-GOD主要分布于肝脏、脾脏,富集于肿瘤内。联合治疗组肿瘤生长缓慢,平均(0.19±0.04)g,明显小于其他各组(P均<0.05),抑瘤率高达(73.13±5.14)%。各组小鼠体质量均无明显变化(P均>0.05)。病理结果显示,联合治疗组肿瘤细胞损伤严重,见大量核固缩、核溶解与核坏死;其余各组内仍存在较多肿瘤细胞(图9)。
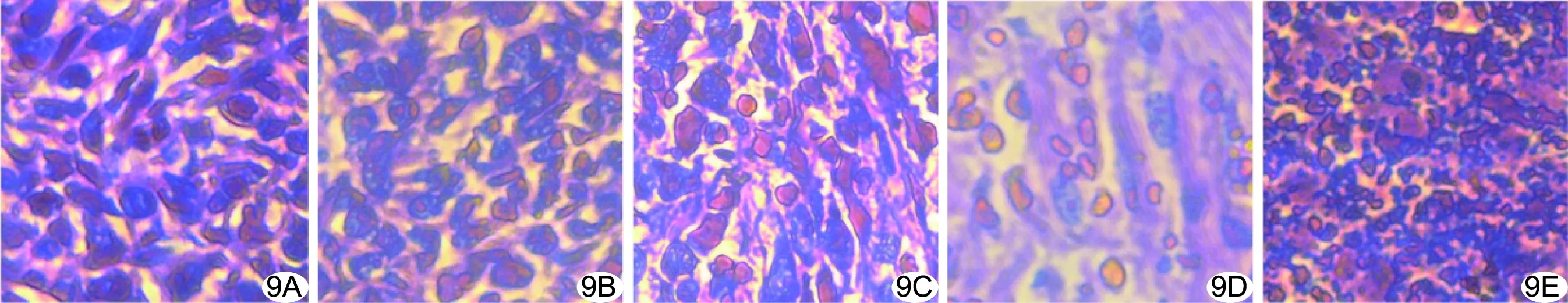
图9 小鼠移植瘤病理图(HE,×400) A.对照组; B.超声组; C.SDT组; D.饥饿治疗组; E.联合治疗组
3 讨论
SDT是在光动力治疗(photodynamic therapy, PDT)基础上发展而来的新型无创治疗肿瘤技术[6],利用声敏剂与氧在超声作用下产生具有生物毒性的活性氧而杀伤肿瘤细胞[7],但杀伤效率有限。近年针对肿瘤微环境进行治疗逐渐受到重视。肿瘤较正常组织细胞需要更多葡萄糖以供生长[8];GOD对β-D-葡萄糖具有高效催化性能及良好的生物安全性[9]。联合应用声动力治疗与GOD消耗葡萄糖产生的饥饿效应,可实现声动力/饥饿联合治疗。
卟啉类化合物可增强多种影像学成像[10]。TPZ结构明确、性质稳定、活性氧产量高,可较强吸收超声声能,且锌金属有利于产生单线态氧[11],但为脂溶性有机物,不溶于水,生物利用度较低。本研究将声敏剂TPZ装载于脂质体壳层,以改善其溶解性能;超声辐照下可释放大量活性氧而产生SDT效应,同时可发生“声致相变”,即液态PFP在超声作用下气化,使探针由纳米级颗粒变成微气泡,以增强超声显像;此后探针发生爆炸,释放GOD,与葡萄糖发生反应,产生饥饿效应而杀伤肿瘤细胞。
本研究制备的装载磷脂的TPZ/GOD纳米颗粒形态均一,在水中的分散性好,可凭借肿瘤血管的高通透性和滞留效应透过肿瘤血管内皮间隙,经超声辐照实现SDT;“声致相变”产生微气泡增强超声信号,局部定点可控释放GOD而实现SDT。除本身可作为治疗剂外,本研究制备的声敏纳米酶颗粒还可作为光声/超声分子造影剂,超声辐照下壳层内PFP发生液气相变,增强CEUS效果。体外实验显示,激光照射后,光声信号值在690 nm处出现峰值;体内动物实验进一步证实TPZ成功包裹于NP内,并可用作光声成像造影剂。双模态成像支持对比分析2种不同的成像方式,可取长补短,综合得出更丰富的影像学信息[12]。
本研究制备的相变型声敏纳米酶颗粒在体外成功被CT-26细胞吞噬。TPZ-GOD NP+超声组细胞内荧光强度明显高于其余各组,提示活性氧产量较大,为SDT提供了理论基础;体外联合治疗组细胞存活率最低,而其余各组细胞仍有大量存活,初步证实了联合治疗的作用;体内实验中,联合治疗组可显著抑制小鼠肿瘤生长,且生长期间小鼠体质量未发生明显改变。
总之,本研究成功制备的超声响应性TPZ-GOD NP可用于超声/光声双模态成像引导下声动力联合饥饿治疗小鼠结直肠癌,为治疗肿瘤提供了新的思路和方法。
