TiO2-锌卟啉催化剂的制备及光催化降解甲基橙实验设计
2021-07-27陈韶蕊余旭东
陈韶蕊, 余旭东
(河北科技大学理学院,石家庄050018)
0 引 言
随着经济全球化和工业化的持续发展,环境污染问题日益严重。有机污染物因为成分复杂、来源广泛和危害巨大而成为防治的重点。光催化技术作为一种新型的利用太阳能来解决环境污染问题的技术手段,备受广大科研学者的关注[1]。锐钛矿二氧化钛以其优异的催化稳定性成为半导体光催化剂的代表[2],但是,TiO2的带隙较宽导致其对可见光的利用率低,再加上电子和空穴容易复合等缺陷[3-4],使其应用前景受到限制,因此对TiO2改性势在必行。表面敏化是TiO2改性的一种常用方式,通过物理或化学吸附将光活性化合物固定于TiO2表面,使其能更充分地利用可见光,从而大幅提高其催化活性。卟啉在紫外可见光区表现出强的光吸收(B带在350~450 nm,Q带在500~700 nm),且具有大的π电子共轭体系[5-7],正是由于其特殊的结构,卟啉和金属卟啉在光合作用、光敏染料和分子识别等方面有广泛的应用[8-9]。另外,卟啉是一种n型半导体,拥有较快的电子注入效率,其带隙也可与大多数无机金属半导体匹配。
本文合成了TiO2-锌卟啉的光催化剂,并通过光催化甲基橙溶液研究降解有机污染物的活性。实验涉及催化剂的合成、结构、形貌和降解有机物等多方面知识,通过实验的设计和开展,学生掌握了复合材料的合成方法,大型仪器的工作原理和操作方法,培养学生处理和分析实验数据的能力,提高了学生的实验水平,为培养创新型人才奠定了基础。
1 实验部分
1.1 实验试剂与仪器
主要试剂:二氯甲烷、乙酸锌、石油醚和甲基橙等购于天津大茂试剂厂。
主要仪器:磁力搅拌器,电子天平,三用紫外仪,扫描电子显微镜,红外光谱仪,漫反射紫外光谱仪,氙灯光化学反应仪等。
1.2 锌卟啉的合成
将卟啉(Pp)0.2 g(0.24 mmol),乙酸锌.2H2O 0.1 g(0.46 mmol)加入25 mL二氯甲烷中,室温下搅拌2 h,蒸除溶剂,柱色谱分离得锌卟啉,产率90.2%,m.p.>300℃;1H NMR(500 MHz,CDCl3)δ,2.28~2.29(m,4H,—CH2),4.34(m,2H,—CH2O),4.38(m,2H,—OCH2),6.87(m,1H,Nap),7.25(m,2H,Ph),7.37(m,2H,Ph),7.45(m,2H,Nap),7.73~7.78(m,10H,Ph+Nap),8.12(m,2H,Ph),8.21(m,6H,Ph),8.21(m,1H,Nap),8.93~8.99(m,8H,pyrrole);UV-vis(CH2Cl2):λmax,nm,419(Soret band),548,586(Q bands)。锌卟啉的合成路线如图1所示。
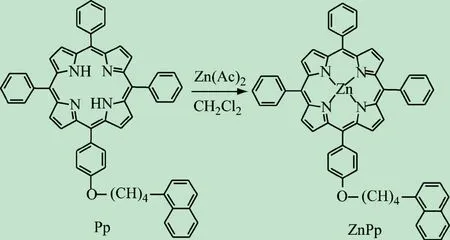
图1 锌卟啉(ZnPp)的合成路线
1.3 TiO2-锌卟啉催化剂的制备
将6μmol的锌卟啉溶于25 mL二氯甲烷中,加入0.2 g TiO2室温下搅拌8 h,蒸除溶剂并在真空干燥箱中干燥2 h得TiO2-锌卟啉复合催化剂[10]。
1.4 催化剂的表征
使用扫描电子显微镜(SEM,JSM-6700F microscope,操作电压10.0 kV)观察样品的微观形貌;漫反射紫外光谱仪(DSR,Shimadzu UV 2550)表征样品的吸收性能,X射线电子能谱(XPS,PHI 5000C ESCA)和X射线衍射(XRD,Rigaku D/MAX)测定样品的结构信息。
1.5 光催化性能评估
称取0.1 g TiO2-锌卟啉催化剂,加入到100 mL质量浓度为10 mg/mL的甲基橙溶液中,避光搅拌30 min达到吸附平衡。在300 W、24 V的氙灯下照射30 min,取样3 mL,离心10 min,取上清液在464 nm下测定其吸光值。补加蒸馏水,使甲基橙溶液体积仍为100 mL,重复上述操作,总体照射时间150 min。
2 结果与讨论
2.1 TiO2-锌卟啉催化剂的形貌及组成分析
为了验证锌卟啉是否负载到TiO2表面,进行了XPS的测试,如图2所示。由图2(a)可知,化合物中只含有C,O和Ti 3种元素且质量比分别为8.55%、40.68%和50.78%,Ti 2p,O 1s and C 1s的能级分别是455.7、526.9和282.85 eV。而由图2(b)可知,化合物中含有C、O、Ti、N和Zn元素,质量比分别是13.99%、40.61%、44.07%、0.97%和0.36%,Ti2p、O1s、C1s、N1s和Zn 2p相应的能级分别是455.8、527.0、281.9、397.8和1 019.3 eV[11]。因此,证明了锌卟啉负载到TiO2表面。
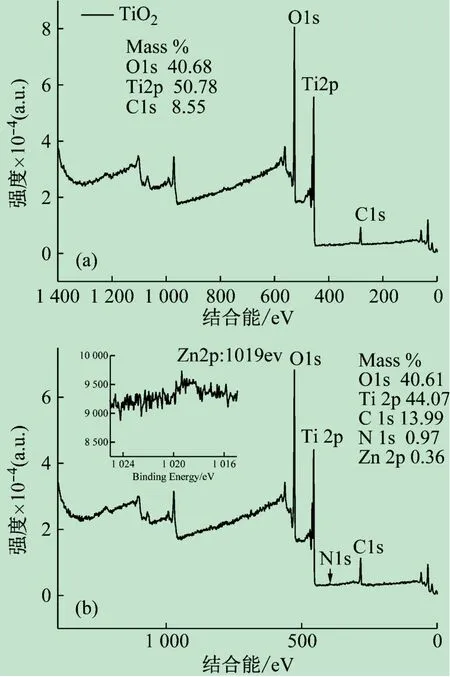
图2 TiO2(a)和TiO2-锌卟啉(b)催化剂的XPS图
由图3中的TiO2-锌卟啉催化剂和TiO2的SEM图可知两种物质表面具有相同的形貌;图4中TiO2-锌卟啉催化剂在25.4°、37.9°、48.1°、54.1°、62.8°和68.4°出现特征的衍射峰,其衍射峰位置与TiO2一致,以上现象均说明锌卟啉负载在TiO2表面但并不影响其晶体结构。

图3 TiO2(a)和TiO2-锌卟啉催化剂(b)的SEM图
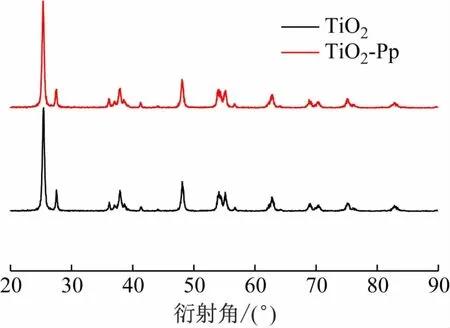
图4 TiO2和TiO2-锌卟啉催化剂的XRD图
2.2 TiO2-锌卟啉催化剂的光吸收性能
TiO2在400 nm以上没有吸收,而催化剂TiO2-锌卟啉431 nm(Soret band)、554 nm和598 nm(Q band)均有特征吸收,此吸收峰与锌卟啉在二氯甲烷中的吸收峰一致(见表1),且发生了红移(419~431 nm,548~554 nm,586~598 nm),这意味着TiO2和锌卟啉分子之间存在弱的相互作用,如静电吸引力和物理吸收等[12-13]。由此可知锌卟啉负载到TiO2表面,并且拓宽了TiO2吸收范围,更利于充分吸收太阳光而提高其催化活性(见图5)。
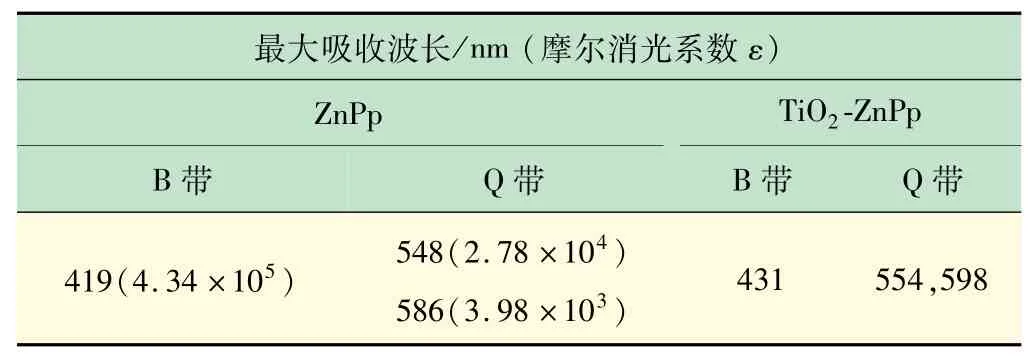
表1 锌卟啉在二氯甲烷溶液中的紫外光谱数据和TiO2-锌卟啉漫反射紫外光谱数据
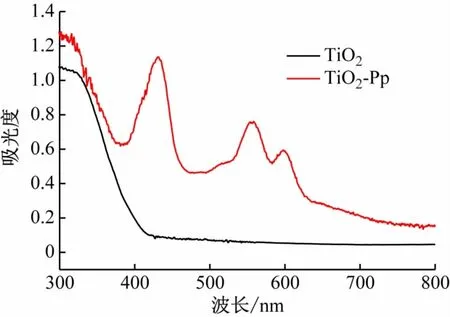
图5 TiO2和TiO2-锌卟啉催化剂的DSR图
2.3 TiO2-锌卟啉光催化降解活性及动力学
图6 中的纵坐标是不同时间样品的浓度与甲基橙原液浓度的比值。由图可知:TiO2-锌卟啉催化剂在150 min内降解率达到84.7%,由此可知当锌卟啉负载到TiO2表面后增强了其催化活性。光催化降解低浓度污染物一般符合表观一级动力学方程,其动力学方程如下式[14-15]:
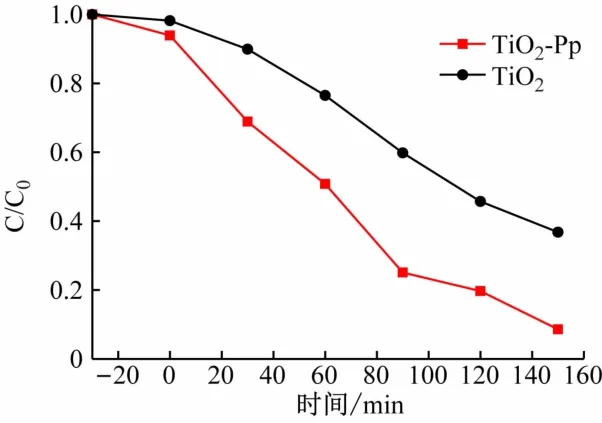
图6 TiO2-锌卟啉和TiO2对甲基橙的催化降解曲线
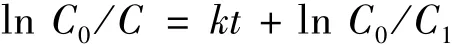
式中:C0、C1和C分别为甲基橙原液浓度(10 mg/mL)、吸附平衡后和光照一段时间后溶液的吸光度;lnC0/C1为催化剂对有机物的吸附能力;k为表观速率常数。
通过对图6数据进行拟合处理,得到的TiO2-锌卟啉和TiO2的光催化动力学曲线见图7。TiO2-锌卟啉和TiO2的R2分别为0.963和0.971,说明光催化过程符合一级动力学方程。由动力学方程拟合得到TiO2-锌卟啉反应速率常数为0.015 8 min-1是TiO2的2.3倍,表明对TiO2改性后得到的TiO2-锌卟啉催化剂的活性显著提高。
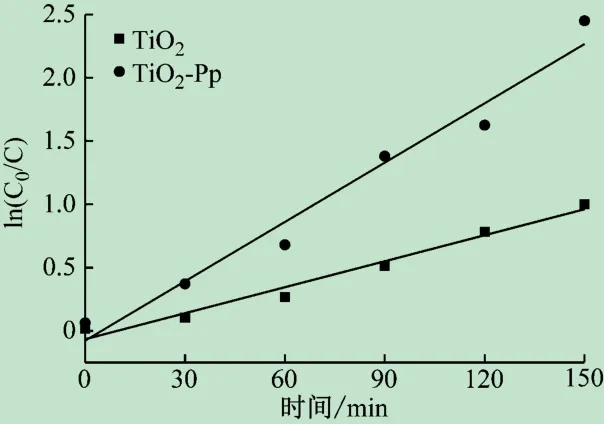
图7 甲基橙降解的动力学模拟曲线
3 教学效果
基于传统化学实验教学缺乏研究性和创新性,综合考虑应用化学专业学生的专业特色,本实验结合环境污染和新能源开发的研究热点,设计了TiO2-锌卟啉催化剂的制备及光催化降解甲基橙的综合实验。不同于传统的“一讲课二巡视”的教学方法,实验过程中充分发挥学生的主动性,采用“开放式”的教学方式,充分激发学生的主动性,放手让学生自己查阅文献、设计路线,老师在实验过程辅助引导学生。通过本实验学生进一步提高了操作能力、分析问题和解决问题的能力;通过对材料的分析表征及其在有降解有机污染物方面的应用了解了大型仪器的工作原理、操作方法,同时进一步掌握Chemdraw、MestRec和Origin等软件,并能对实验中自己得到的数据作图、分析和讨论,增强了学生的成就感和自信心,培养了学生的综合素质和独立进行科研的能力。
4 结 语
本实验设计合成了TiO2-锌卟啉催化剂的制备及光催化降解甲基橙,涵盖了有机化学中有机化合物的合成及有机-无机配合物的制备,仪器分析中大型仪器的原理和操作方法及数据处理等多学科知识点。实验立足于学术前沿,围绕社会热点问题,充分发挥了学生的主观能动性,全面训练学生的实验技能和科学素养,是培养复合型和创新型人才的有效途径。
