益气活血方及其拆方对气虚血瘀型脑梗大鼠影响的比较研究❋
2021-07-26宋文婷孙明谦马彦雷马京泉刘建勋
宋文婷, 苗 兰, 孙明谦, 曹 慧, 史 跃, 马彦雷, 李 磊, 马京泉, 刘建勋△
(1.中国中医科学院西苑医院基础医学研究所, 北京 100091;2.北京市中药药理重点实验室, 北京 100091)
气血理论是中医学的基本理论之一,其核心在于“气血相关,相互为用”,即“气为血之帅,血为气之母”。在不同的疾病和疾病的各个阶段,气与血的不平衡导致各不相同的症状与证候。气虚会导致血的运行不畅,而血瘀反过来又加重气虚,两者互相影响,缠绵难愈。中风病(脑梗死)是中医学四大顽疾之首,经学者统计,中风辨证过程中气虚血瘀是缺血性中风的重要病机之一[1],临床常表现为半身不遂、气短乏力、脉沉细等[2]。
清代医家王清任认为,中风病人体内“血赖元气运行,元气既虚,必不能达于血管,血管无气,必停留而瘀”“亏损五成元气”,遵循“虚则补之”治则,创补阳还五汤以益气活血[3]。补阳还五汤由黄芪、当归尾、赤芍、地龙、川芎、红花、桃仁组成,是益气活血法的代表性经典名方,具有补气、活血、通络的功效。益气活血法治疗中风之气虚血瘀证,具有良好的临床疗效。
本课题组使用的益气通络颗粒是补阳还五汤的加减方,在临床中应用于治疗缺血性心脑血管病,症见气虚血瘀者疗效显著[4-5]。近年来,在脑缺血复合气虚血瘀证的动物模型方面,显示出较为满意的药效[6],且学者们还从大鼠血管新生[6]和内皮功能[7]等方面阐释了益气活血方的药理机制,但尚未见益气活血方的拆方研究。因此本实验从益气活血两方面来研究益气活血颗粒中益气药与活血药的功效,并初步考察这两类药物对于气虚血瘀型脑缺血模型大鼠的恢复是否具有协同作用。本研究经中国中医科学院西苑医院伦理委员会审批通过,编号2018XLC003-2。
1 材料与方法
1.1 动物
SPF级雄性SD大鼠60只,体质量200~220 g,购自维通利华实验动物技术有限公司,动物合格证号 SCXK(京)2016-0006。饲养于中国中医科学院西苑医院 SPF 级实验动物中心,许可证号 SYXK(京)2015-0011。
1.2 药物
益气活血方临床用药药量为19.4 g·d-1,相当于生药143 g·d-1(处方组成为黄芪60 g,赤芍15 g,川芎12 g,当归尾20 g,地龙12 g,红花12 g,桃仁12 g),其中黄芪为益气药,剩余6药为活血药。
华润三九药业提供的黄芪、川芎、赤芍、红花、桃仁、地龙、当归尾配方颗粒的饮片当量分别为10 g·g-1,6 g·g-1,5 g·g-1,6 g·g-1,20 g·g-1,6.7 g·g-1,5 g·g-1,在配药时先将各个颗粒剂分别进行称量后再混合,以蒸馏水配制成混悬液。大鼠自睡眠剥夺第5天开始给药,全方组每天给予配方颗粒3.49 g·kg-1,益气药组和活血药组分别给予1.08 g·kg-1和2.408 g·kg-1配方颗粒,2倍临床等效剂量。各组药物均以蒸馏水配制成混悬液,每天灌胃给药,给药体积为 10 ml·kg-1,空白组和模型组每日给予相应体积蒸馏水。
1.3 试剂
荧光微球(UVPMS-BY2)Sigma公司;异氟烷(批号64170902),鲁南贝特制药有限公司;医用水合氯醛(批号Z16J10Y80098),上海源叶生物有限公司;纯净水,中国娃哈哈有限公司;丙二醛(MDA)测试盒(批号20190410)、大鼠白细胞介素-6(IL-6)酶联免疫检测试剂盒(批号20191016)、大鼠白细胞介素-1β(IL-1β)酶联免疫检测试剂盒(批号20191016)、大鼠内皮素-1(ET-1)酶联免疫检测试剂盒(批号20191016)、大鼠血管紧张素Ⅱ(Ang-Ⅱ)酶联免疫检测试剂盒(批号20191016),南京建成生物工程研究所。
1.4 仪器
Mouse Ox 型小动物无创脉搏血氧仪(美国 Starr Life Science Inc公司);VIP 3000 型小动物麻醉机(美国Matrx公司);ES-1100 型电子天平(长沙湘平科技发展有限公司);LBY-N6C 型全自动血液流变测定仪(北京普利生仪器有限公司);睡眠剥夺用水环境平台盒(本实验室自制);22 R高速离心机(德国Mikro公司);低温冰箱(美国Thermo公司);VCX 150PB 型匀浆机(美国Sonics公司)。
1.5 动物造模——睡眠剥夺复合多发性脑梗(MCI)大鼠模型
因本课题采用SD大鼠构建气虚血瘀型脑梗模型,基于本课题组前期对气虚血瘀证及脑梗死的相关研究[8-9],确定采用微球致多发性脑梗合并水平台不完全睡眠剥夺法建立病证结合动物模型,即气虚血瘀证脑梗死大鼠。将60只雄性健康 SD 大鼠随机分为假手术组(Sham)、睡眠剥夺复合脑梗组(模型,Model)、益气活血药组(YQHX,3.49 g·kg-1)及益气药组(YQ,1.08 g·kg-1)、活血药组(HX,2.408 g·kg-1)5组各12只。先睡眠剥夺2周,然后进行微球致多发性脑梗手术,术后复合睡眠剥夺,并给药4周。
表1示,睡眠剥夺方法参考文献[10]中“水环境小平台法”,即把大鼠放入水深3.5 cm 的水环境小平台盒里,每个盒里有6个小平台(直径6 cm,高4 cm),每盒放5只大鼠,用带有食槽的铁丝网盖住,大鼠不能逃脱但可以自由进食饮水,每天睡眠剥夺16~24 h不等。睡眠剥夺结束后回笼正常饮食饮水。为避免大鼠耐受睡眠剥夺,每天不在同一时间进行操作。

表1 睡眠剥夺时间表
多发性脑梗(MCI)大鼠模型制备:麻醉大鼠颈部正中切口,分离颈总动脉、颈内动脉和颈外动脉。用动脉夹夹闭颈总动脉,颈外动脉的远心端用线结扎,用注射器从颈外动脉向颈内动脉注入荧光微球0.1 mL,微球经由颈内动脉分散至大脑各动脉。假手术组大鼠则从颈外动脉向颈内动脉注入生理盐水0.1 mL。松开动脉夹将颈外动脉近心端结扎,逐层缝合伤口回笼正常饲养,术后24 h 进行神经功能缺陷评分。淘汰死亡、0 分及 4 分大鼠,1~3 分为多发性脑梗死模型建造成功。
手术结束3 d后开始给药,并恢复睡眠剥夺操作,每天剥夺16 h,干预4周后取材。
鄂东古城蕲州镇东,有一绿林掩映的村舍,名曰油铺。相传明末清初朱姓皇族为避清军杀戮,改名换姓逃难至此安家落户,屈指算来已历两百多个春秋。
1.6 负重力竭游泳时间
按照参考文献[12],在大鼠尾巴根部绑定小铅锤,质量约为大鼠体质量的5% ,水深75 cm,使大鼠游泳至全身力竭(鼻头沉入水下10 s以上)及时捞出,用毛巾擦干大鼠身上的水,回笼正常饮食饮水。
1.7 大鼠脉象分析(脉搏幅度)
给药后4周,2%异氟烷进行持续气体麻醉,使用 Mouse Ox 小动物无创脉搏血氧仪对大鼠脉搏幅度进行检测,每次每只记录10 个有效数据并取平均值。
1.8 大鼠血液流变学分析
麻醉大鼠腹主动脉取血,自制肝素抗凝管(肝素2 mL,生理盐水稀释至10 mL,每只试管加入50 μL,挥干待用)抗凝,LBY-N6C血液流变测定仪检测血液流变学,选用切变率 5,60,150 s-1,血浆 100 s-1。
1.9 血清中ET-1、Ang-Ⅱ、IL-1β、IL-6、MDA水平检测
大鼠腹主动脉取血,试管内静置1.5 h,4 ℃预冷,2500 r/min离心15 min,分离血清冻存在-80 ℃冰箱中。取冻存大鼠血清,按照ELISA试剂盒说明书操作,检测血清中ET-1、Ang-Ⅱ、IL-1β、IL-6、MDA水平。
1.10 大鼠海马组织病理形态学检查
将大鼠脑组织经固定后修块,脱水后石蜡包埋、切片(4 μm)制片、HE染色,观察镜下大鼠脑组织在缺血再灌注损伤之后神经元及微血管病变以及炎性反应等情况,并观察药物干预情况。
1.11 统计学方法

2 结果
2.1 各组大鼠负重力竭游泳时间比较
图1示,与假手术组比较,模型组大鼠负重游泳时间明显缩短(P<0.01);与模型组比较,各给药组游泳时间均延长,但与活血药组比较差异无统计学意义,益气药和益气活血药组与模型组比较差异有统计学意义(P<0.05,P<0.01)。
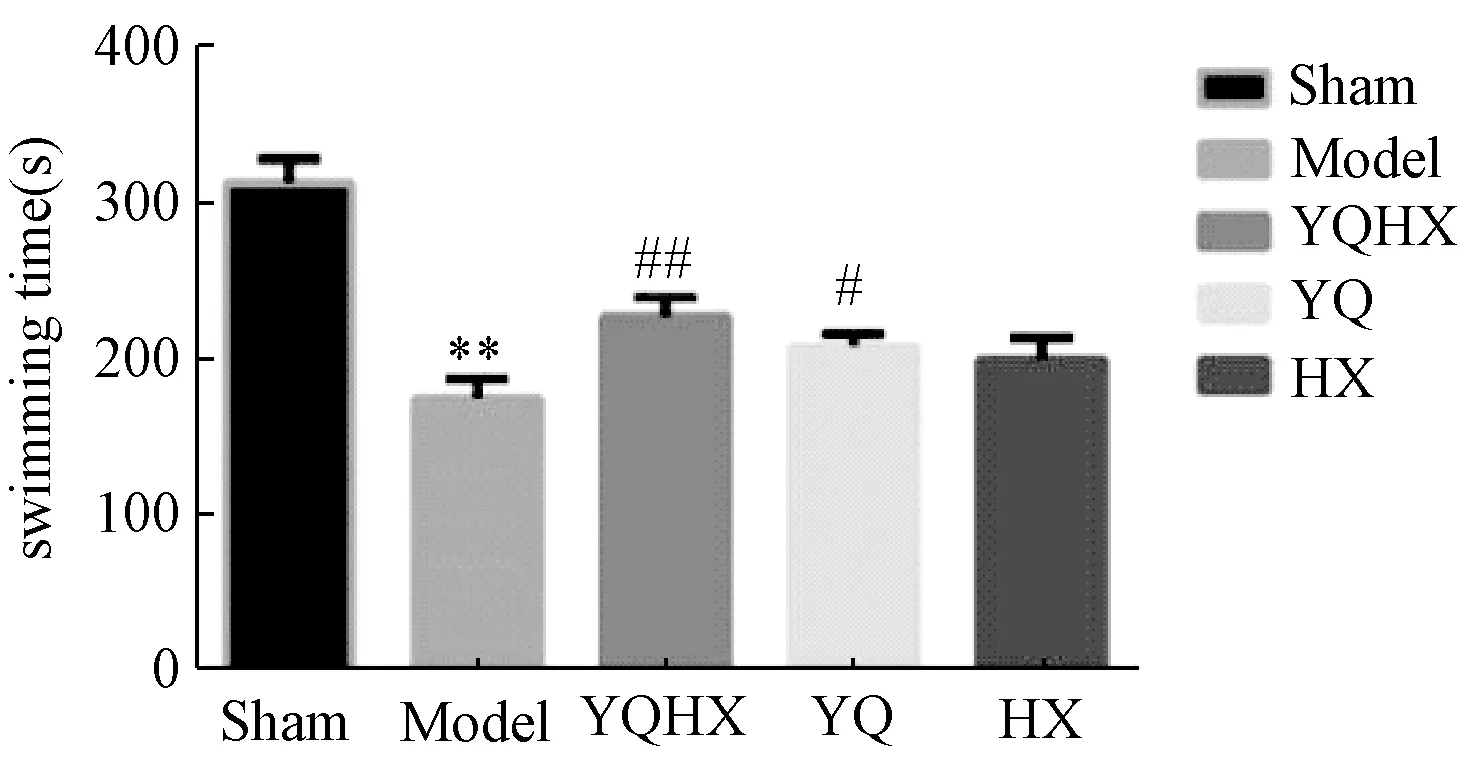
注:与假手术组比较:**P<0.01;与模型组比较:#P<0.05,##P<0.01
2.2 各组大鼠脉象分析
图2示,与假手术组比较,模型组大鼠脉搏幅度明显下降(P<0.01);与模型组比较,各给药组脉搏幅度均有明显增加,与模型组比较差异有统计学意义(P<0.01)。

注:与假手术组相比,**P<0.01;与模型组相比,#P<0.05,##P<0.01
2.3 各组大鼠血浆及全血黏度比较
表2示,与假手术组比较,模型组在各切变率下的全血黏度和血浆黏度均有升高趋势(P<0.01);相比模型组,各给药组全血黏度和血浆黏度均有升高趋势,其中益气活血药和益气药对血浆黏度有明显的抑制作用,活血药对各切变率下的全血黏度有明显降低作用(P<0.05)。

表2 各组大鼠血浆及全血粘度分析结果表
2.4 各组大鼠血清ET-1、Ang-Ⅱ值比较
图3、4示,与假手术组比较,模型组ET-1、Ang-Ⅱ值均升高,Ang-Ⅱ无统计学意义,ET-1有统计学意义(P<0.05);相比模型组,各给药组ET-1、Ang-Ⅱ值均降低,差异有统计学意义(P<0.05,P<0.01)。

注:与假手术组比较:*P<0.05;与模型组比较:#P<0.05,##P<0.01

注:与假手术组比较:*P<0.05;与模型组比较:#P<0.05,##P<0.01
2.5 各组大鼠血清IL-6、IL-1β值比较
图5、6示,与假手术组比较,模型组IL-6、IL-1β值均升高,差异有统计学意义(P<0.05);相比模型组,各给药组IL-1β值均降低,差异有统计学意义(P<0.01);各给药组IL-6值也均降低,其中活血药组差异有统计学意义(P<0.01)。

注:与假手术组比较:*P<0.05;与模型组比较:##P<0.01

注:与假手术组比较:*P<0.05;与模型组比较:##P<0.01
2.6 各组大鼠血清MDA水平比较
图7示,与假手术组比较,模型组MDA水平升高(P<0.05);相比模型组,各给药组MDA值也均降低,其中益气活血组和活血药组比较差异有统计学意义(P<0.05,P<0.01)。

注:与假手术组比较:*P<0.05;与模型组比较:#P<0.05,##P<0.01
2.7 各组病理形态学观察
模型组改变最多,依据结构改变的程度排列顺序:模型组>黄芪组>益气组>活血组>全方组>正常组。
假手术组皮质神经元细胞厚薄均匀,排列如常,未见变性、凋亡和坏死灶。海马CA区及其他核团组织的神经元形态规则,层次丰富,排列整齐、均匀,细胞密集,大小适中,胞核、胞质清晰,血管壁正常,无增生及出血现象。模型组结构改变明显,表现为海马神经元水肿、阶段性消失,在海马CA区存在炎细胞淋巴细胞聚集团。皮质的外椎体细胞层、内颗粒层、内椎体细胞层以及多形细胞层,均有炎细胞浸润,偶见坏死灶。
药物组中,全方组则最接近正常组,结构变化罕见,神经元大小适中突触完整,未见炎细胞。拆方组虽然各有不同,但是综合表现,病理改变多于全方及正常组而少于模型组,其特点是益气组充血明显,偶见炎细胞浸润;活血组接近于全方组,未见炎细胞浸润及明显的坏死区域。

注:1.假手术组;2.模型组;3.益气组;4.活血组;5.全方组
3 讨论
本实验运用睡眠剥夺法复合微球致多发脑梗死造大鼠气虚血瘀证模型,造模成功且与正常对照组比较差异显著,符合中医临床“日久则虚”的病因病机。实验中运用的水环境小平台站立睡眠剥夺,在精神及体力上造成大鼠的双重消耗,日久导致气虚,气虚则无力推动血行,导致气和血的亏虚与阻滞。从“气”的角度来看,实验动物脉搏幅度小、力竭游泳时间短皆表明,实验动物处于气虚的状态,且益气活血对气虚的改善作用明显优于益气药,活血药作用稍弱于益气药。从“血”的角度来看,模型组大鼠血液黏度增加,符合相关文献报道气虚血瘀证血液流变学变化[11]。药物干预后,各组血液黏度明显降低,可有效改善血瘀。综合来看,益气活血药既改善气虚又对血瘀具有较好的治疗作用,对气虚血瘀的治疗作用为3组中最优。病理形态学检查结果也很好地说明了益气药与活血药配伍后的全方对脑组织结构有较好的保护,全方组病理改变最少且可见炎症病灶中细胞呈恢复状态。
《医林改错》中记载: “元气既虚,必不能达于血管,血管无力,血液在血管中运行势必迟缓乃至滞阻”,说明气虚状态下,气无力推动血液正常运行而导致血瘀。现代研究表明,气机异常可能涉及血液流变学改变[12]、内皮功能损伤及炎症等多方面损伤[7,13-15]。ET-1是维持血管基础张力稳定的重要因素[16],Ang-Ⅱ是一类促血管生成因子,可促进血管生成而加重血管疾病[17]。研究发现,ET-1、Ang-Ⅱ与气虚血瘀证病理生理过程密切相关[18-19]。在病理情况下,血管过度收缩与ET-1、Ang-Ⅱ水平过高有关,会形成血管舒张障碍,影响微循环[20-21]。本实验模型组大鼠较假手术组ET-1、Ang-Ⅱ显著升高,提示其血管内皮细胞舒缩功能失调,即气对血液的管控能力下降,给予益气药和全方药后,两者的水平有不同程度的降低,趋近正常值,证明益气药物能通过调节相关血管因子水平,恢复受损的血管内皮细胞舒缩功能,改善微循环,且当益气药配合活血时使用时效果更佳。
内皮功能障碍会导致内皮介导的血管舒张减弱、血流动力学紊乱、纤溶能力受损、黏附分子以及炎症因子、活性氧簇产物、氧化应激增加以及细胞渗透增强[22],这不仅会造成血瘀还可能导致炎症反应及氧化应激的发生。IL-6、IL-1β是重要的炎症因子。本实验结果显示,气虚血瘀证大鼠 IL-6、IL-1β较假手术组均显著升高,提示在气虚血瘀证大鼠模型中存在炎性免疫反应。MDA是主要的氧化产物,慢性氧化应激会加重炎症反应[23]。本实验观察到,模型组实验动物体内出现氧化产物的堆积,说明气虚血瘀大鼠体内出现氧化应激。炎症及氧化应激是脑缺血后导致脑损伤的2个主要环节[24-25],药物干预后,3组实验动物的炎症反应及氧化应激都得到缓解,益气药与活血药能一定程度清除炎症因子和氧化产物,但二者配伍使用益气以助血行,同时活血化瘀改善血液循环,能显著降低炎性因子和氧化产物水平,对气虚血瘀型脑梗发挥重要的治疗作用。
现有研究发现,补阳还五汤方中起补气活血作用的主要药物是黄芪与红花[26]。黄芪是1味具有扶正益气功效的传统中药,其含量最高的活性成分是黄芪甲苷。前期研究证明,黄芪甲苷对缺血性损伤的保护机制可能为抗炎及恢复血管内皮功能[27-28]。而红花具有活血化瘀、散湿消肿的作用,其与当归配伍广泛用于血瘀证,当归中的阿魏酸与红花中的羟基红花黄A是活血化瘀的主要活性成分,可调节血管与中枢神经系统疾病相关的蛋白质表达[29]。因此,益气活血方发挥益气活血化瘀作用的物质基础可能是黄芪甲苷、阿魏酸及羟基红花黄A。值得注意的是,阿魏酸亦是川芎的活性成分之一,有研究证实川芎口服生物利用度大,因其良好的理化特性易于通过血脑屏障能够抑制氧化应激,同时降低IL-1β及IL-6水平,从而抗脑缺血损伤[30]。这与传统理论认为川芎可上行巅顶、活血行气相符。以上研究结果表明,益气药与活血药均能表现抗炎、抗氧化作用。但是通过对复方的代谢组学研究发现,复方配伍不仅可促使药物发挥协同作用,还有可能对方中有效成分的体内含量起维持作用,起到促进及维持功效的作用[26],因而出现全方组既优于益气药组也优于活血药组的实验结果。
综上所述,益气药与活血药对气虚血瘀有一定的治疗作用,但二者配伍使用可显著改善气虚、降低血液黏度,通过补气改善受损的血管内皮功能而推动血行,进而减轻气虚血瘀导致的炎症及氧化应激,在多个指标上益气药与活血药存在协同作用,使得全方组既优于益气药组也优于活血药组。
