山楂叶金丝桃苷对LPS诱导的RAW264.7巨噬细胞炎症反应的抑制作用❋
2021-07-26姚新月李海波
杨 莺, 姚新月, 李海波
(1.辽宁中医药大学附属医院, 沈阳 110032; 2.辽宁中医药大学研究生部, 沈阳 110847;3.辽宁中医药大学基础医学院, 沈阳 110847)
炎症是指机体受到外界刺激时所产生的防御反应,正常情况下炎症有利于清除致病炎症因子。但过度的炎症反应可导致机体组织损伤使病情加重,如神经退行性疾病、动脉粥样硬化、关节炎等[1-2]。迄今在临床使用的抗炎药主要包括甾体抗炎药(如地塞米松)和非甾体抗炎药(如阿司匹林)。但因为其诸多不良反应(如引起类肾上腺皮质功能亢进症、严重的胃肠道反应等),限制了其在临床的应用[3-4],因此研发高效、低毒的抗炎药物是目前研究的重点。
山楂又称山里红,来源于蔷薇科植物山里红或山楂的干燥成熟果实,具有消食健胃、行气散瘀之功效[5]。山楂叶富含黄酮类化合物,其中金丝桃苷(hyperoside, Hyp)是其主要活性成之一,具有广泛的药理活性,主要包括抗氧化、抗肿瘤、抗缺血性脑卒中等[6-9]。但是Hyp能否通过激活Sirt6抗炎作用未见报道。因此,本研究拟采用脂多糖(lipopolysaccharides, LPS)诱导巨噬细胞RAW264.7炎症损伤,探索山楂叶提取物金丝桃苷是否通过调控Sirt 6发挥抗炎作用,为其临床用于抗炎症相关疾病提供药理学依据。
1 材料
1.1 药物
图1示,山楂叶提取物金丝桃苷(Hyp)由遵义医科大学高建美教授赠予,纯度 ≥98%。采用二甲基亚砜溶解Hyp后配成10 mmol.L-1母液,在超净台内采用0.22 μmol/L微孔滤器过滤除菌,-20 ℃冻存备用。

图1 Hyp高效液相色谱图
1.2 细胞培养
RAW264.7细胞购自中国科学院上海细胞研究所,采用含10%胎牛血清RPMI1640培养基,置于37 ℃、5% CO2培养箱中培养。
1.3 试剂与仪器
RPMI1640培养液(#8116408),Gibco公司;LPS(#L2630)、MTT(#M2128),Sigma公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)(#20171015)、白细胞介素-1β(interleukin-1β, IL-1β)(#20171015)、白细胞介素-6(interleukin-6, IL-6)(#20171123)、诱导型一氧化氮合酶(induciblenitric oxide synthase, iNOS)(#20171123)、酶联免疫吸附实验(enzyme linked immunosorbent assay, ELISA)试剂盒,上海江莱上海江莱生物科技有限公司;TNF-α、IL-1β、IL-6 和iNOS及 β-actin引物合成、Trizol和DEPC,上海生工生物工程股份有限公司;anti-p-p38 (#ab47363) 多克隆抗体、anti-p38(#ab170099)多克隆抗体、anti-p-核转录因子κB p65(nuclear factor-κB, NF-κB p65)(#ab86299)多克隆抗体、anti- NF-κB p65多克隆抗体(#ab16502)、沉默信息调节因子6(sirtuin 6, Sirt6, #ab88494),Abcam公司。
二氧化碳培养箱(Thermo Fisher Scientific公司);CFX96型RT-PCR仪 (Bio-Rad公司);DDY-10型三恒电泳仪(Bio-Rad公司);半干转印槽(Bio-Rad公司);全自动电泳凝胶成像分析系统(Bio-Rad公司)。
1.4 方法
1.4.1 Hyp对RAW264.7细胞活力的影响 将处于对数生长期的RAW264.7细胞以1×105个/ml接种于96孔培养板中,加入不同浓度的Hyp(0 μmol/L, 1.563 μmol/L, 3.125 μmol/L, 6.25 μmol/L, 12.5 μmol/L, 25 μmol/L, 50 μmol/L, 100 μmol/L, 200 μmol/L, 400 μmol/L)作用24 h确定Hyp的安全浓度范围;将RAW264.7细胞随机分为正常对照组、模型组、模型组+ Hyp低浓度组、模型组+ Hyp中浓度组、模型组+ Hyp高浓度组、模型组+ 地塞米松组。LPS(1 μg/ml)和不同浓度(25 μmol/L, 50 μmol/L, 100 μmol/L)的Hyp或地塞米松(20 μmol/L)作用24 h后,加入MTT(5 mg/L)继续培养24 h后弃上清,每孔加入DMSO(150 μL),振摇10 min,于570 nm波长处测定吸光度值。
1.4.2 Hyp对LPS诱导的RAW264.7细胞内NO含量的影响 RAW264.7细胞按照1.4.1项方法处理后取上清,采用Griess法检测细胞内NO含量,取50 μL上清液与等体积的Griess试剂混合,在室温下培养15 min。在540 nm波长的条件下检测吸光度,并利用已知浓度的亚硝酸钠作为标准,计算各组对应的实际浓度值。
1.4.3 Hyp对LPS诱导的RAW264.7细胞炎症因子释放的影响 RAW264.7细胞按照1.4.1项方法处理后取上清,采用ELISA法测定NO和TNF-α、IL-1β、IL-6和iNOS含量,严格按照试剂盒说明操作。取40 μL稀释液与10 μL上清液混合,置于37 ℃条件下反应 30 min后,将浓缩液稀释按照要求稀释用于洗涤各孔;移取50 μL酶标液加入各孔充分反应30 min(37 ℃条件下);移取50 μL A、B显色剂,37 ℃环境下反应20 min(尽量避光);移取50 μL终止液加入反应;在波长为450 nm条件下测定样本的OD值。
1.4.4 Hyp对LPS诱导的RAW264.7细胞炎症因子mRNA水平的影响 RAW264.7细胞按照1.5.1项方法处理后,收集细胞提取RNA,逆转录合成cDNA,通过RT-PCR检测TNF-α、IL-1β、IL-6和iNOS mRNA表达,引物序列如表1所示。RT-PCR反应条件如下:95 ℃变性5 min、60 ℃变性30 s、72 ℃延伸20 s条件扩增40次。以β-actin为内参,采用2-ΔΔCt法计算炎症因子mRNA水平。

表1 炎症相关因子的基因引物序列
1.4.5 Hyp对LPS诱导的RAW264.7细胞Sirt 6表达和NF-κB p65磷酸化水平的影响 RAW264.7细胞按照1.5.1项方法处理,收集细胞后采用BCA试剂盒进行蛋白定量。蛋白变性后,上样20 μg蛋白,采用10% SDS-聚丙烯酰胺凝胶电泳分离蛋白,转膜后用5%脱脂奶粉封闭1 h,加入一抗p38(1∶1000)、Sirt6 (1∶1000)、p-NF-κB p65(1∶1000)和NF-κB p65(1∶1000)4 ℃孵育过夜,TBST洗膜3次后,加入二抗(1∶5000)封闭1 h后,采用ECL显影,以Image J统计灰度值。
1.4.6 计算机虚拟分子对接检测Hyp与p38的亲和力 采用Autodock 4.2以及AutodockTools软件进行分子虚拟对接,观察Hyp及p38的亲和力情况。从Protein Data Bank (http://www.rcsb.org) 数据库获取p38蛋白的pdb格式文件,其PDB ID为1ZZL。采用Autodock 4.2分别对Hyp与p38蛋白进行分子对接。
1.4.7 流式细胞术检测细胞周期和凋亡变化 将细胞按照1.4.1描述的方法处理后,收集细胞加入70%预冷的乙醇溶液4 ℃条件下孵育过夜后,加入50 mg/ml的碘化丙啶染色液及100 mg/ml RNase A,在室温条件下避光孵育15 min后,用流式细胞仪检测各组细胞周期和凋亡改变。
1.5 统计学方法

2 结果
2.1 Hyp对RAW264.7细胞活力的影响
图2示,Hyp(0 μmol/L, 1.563 μmol/L, 3.125 μmol/L, 6.25 μmol/L, 12.5 μmol/L, 25 μmol/L, 50 μmol/L, 100 μmol/L)单独处理或与LPS共同作用均对RAW264.7细胞活力无影响;而Hyp(200 μmol/L, 400 μmol/L)单独处理或与LPS共同作用均明显抑制细胞活力;表2、3示,各组细胞形态无明显改变,与MTT研究结果一致,表明Hyp在浓度100 μmol/L以下为其安全范围(P<0.05)。

注:不同浓度Hyp作用24 h后,采用MTT法检测细胞活力。 A.正常对照组;B. LPS组;C. Hyp (25 μmol/L);D. Hyp (50 μmol/L);E. Hyp (100 μmol/L);F. 地塞米松(放大400×)

表2 Hyp对RAW264.7细胞活力的影响
2.2 Hyp对LPS诱导的RAW264.7细胞炎症因子释放的影响
表4示,LPS(1 μg/ml)刺激RAW264.7细胞后,NO、TNF-α、IL-1β和IL-6 的含量较正常对照组明显升高。Hyp(25、50、100 μmol/L)和阳性药地塞米松组能够明显降低NO、TNF-α、IL-1β和IL-6 的含量,并呈浓度依赖性(P<0.05)。

表3 Hyp和LPS共同作用对RAW264.7细胞活力的影响

表4 Hyp对 LPS 诱导RAW264.7细胞炎症因子NO、TNF-α、IL-1β、IL-6和iNOS的影响
2.3 Hyp对LPS诱导的RAW264.7细胞炎症因子mRNA水平的影响
表5示,研究结果表明,LPS(1 μg/ml)刺激RAW264.7细胞后,TNF-α、IL-1β、IL-6和 iNOS的mRNA水平较正常对照组明显升高。Hyp(25、50、100 μmol/L)和阳性药地塞米松组能够显著降低TNF-α、IL-1β、IL-6和 iNOS的mRNA水平,并呈浓度依赖性(P<0.05)。

表5 Hyp对LPS 诱导RAW264.7细胞炎症因子TNF-α、IL-1β、IL-6和iNOS mRNA水平的影响
2.4 Hyp对LPS诱导的RAW264.7细胞Sirt 6表达和NF-κB p65磷酸化水平的影响
图3表6示,LPS明显增加p-NF-κB p65水平,降低Sirt6的蛋白表达。而Hyp显著降低p-NF-κB p65水平,增加Sirt6的蛋白表达(P<0.05)。

表6 Hyp对LPS诱导RAW264.7细胞Sirt 6表达与NF-κB p65磷酸化水平的影响量化比较

注:1:正常对照组;2. LPS组;3. Hyp (25 μmol/L);4. Hyp (50 μmol/L);5. Hyp (100 μmol/L);6. 地塞米松
2.5 Hyp结合并抑制p38蛋白
图4示,采用模拟分子对接方法评价Hyp与p38蛋白结合情况的对接结果显示,Hyp能够与p38结合,两者的结合能为-6.05 kcal/mol。Hyp与p38蛋白对接具有丰富的氨基酸残基,主要包括Asp168、Lys53、His107、Tyr35、Leu167等,提示Hyp可能直接作用于p38发挥抗炎作用。
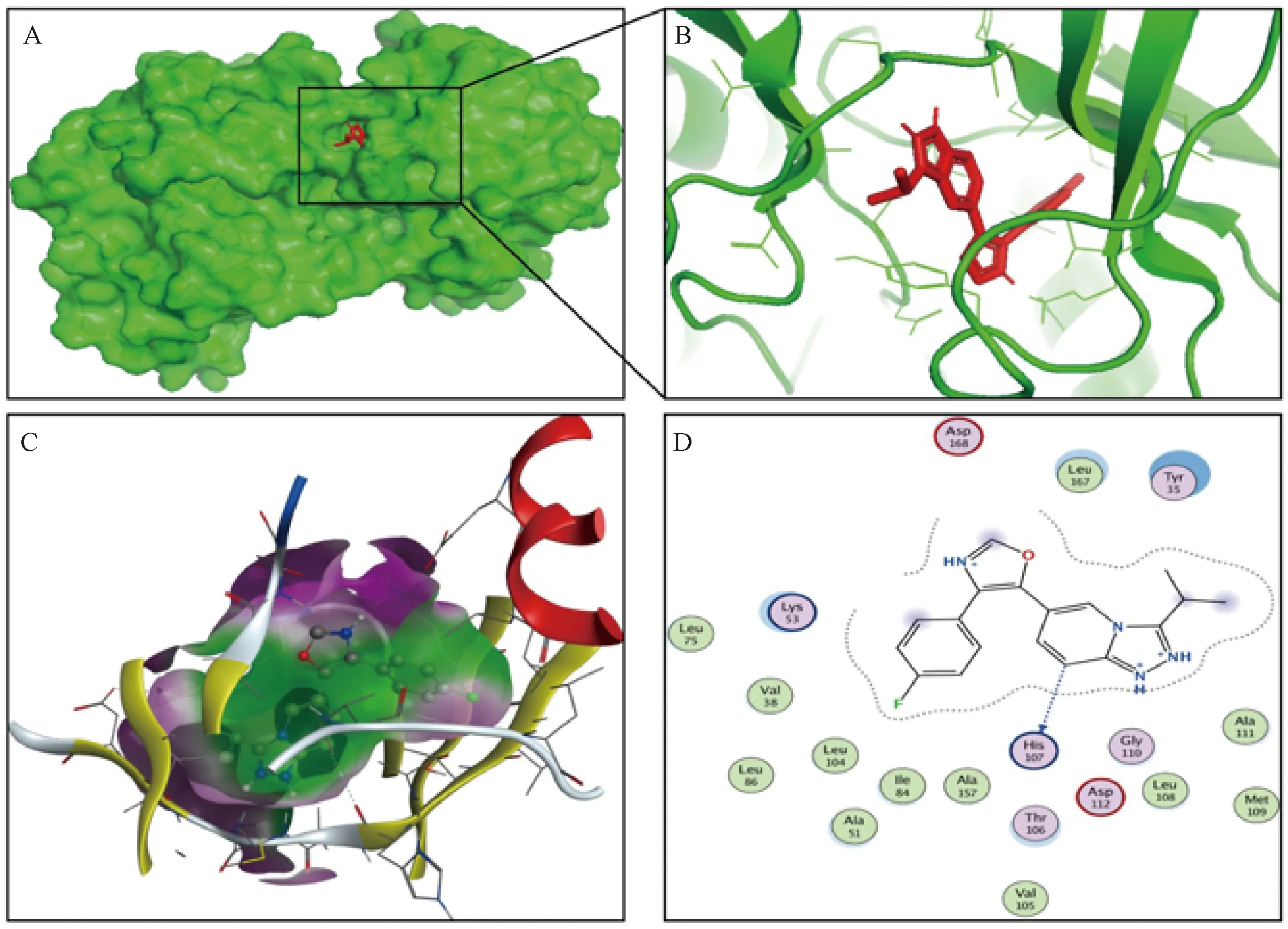
注:A.Hyp与p38结合表面的可视化结果;B-C.Hyp与p38结合位点的可视化结果;D.Hyp与p38对接的氨基酸残基位点可视化结果
2.6 Hyp对LPS诱导的RAW264.7细胞周期和凋亡的影响
图5示,与空白组比较,LPS明显诱导RAW264.7细胞凋亡,且S期细胞显著增加;与模型组比较,Hyp可显著抑制LPS诱导RAW264.7细胞凋亡,且S期细胞明显减少,提示Hyp能够明显抑制LPS诱导RAW264.7细胞凋亡。

注:A.正常对照组;B. LPS组;C. Hyp (25 μmol/L);D. Hyp(50 μmol/L);E. Hyp (100 μmol/L);F. 地塞米松
3 讨论
巨噬细胞是参与炎症反应的重要免疫细胞,在外界因素(如LPS)刺激的情况下可产生炎症因子[10-11]。LPS为革兰阴性细菌细胞壁的主要成分,能够刺激巨噬细胞释放炎症因子(如NO、TNF-α等)[12-13]。其中,NO广泛存在于生物体内,过度的炎症反应可产生iNOS,进而合成大量NO而导致细胞损伤。TNF-α、IL-1β、IL-6为炎症反应中的主要炎症因子,是反应炎症水平的重要指标。本研究结果表明,LPS明显增加RAW264.7细胞NO、TNF-α、IL-1β、IL-6释放量,与文献报道一致[14]。而山楂叶提取物Hyp能够明显减少RAW264.7细胞NO、TNF-α、IL-1β、IL-6释放量,表明山楂叶提取物Hyp具有明显的抗炎作用,但其作用机制有待于进一步探讨。
丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)家族在炎症反应过程中发挥着重要作用,p38 MAPK是其家族重要成员之一。据文献报道,p38 MAPK在炎症刺激下被磷酸化后激活其下游基因NF-κB发挥作用[15]。NF-κB是炎症反应过程中重要的基因转录调控因子,其家族成员主要包括p65和p50。正常生理情况下,NF-κB(p50/p65)以异二聚体形式存在于细胞质中;在炎症(如LPS)刺激条件下,NF-κB信号通路被激活后NF-κB-p65由细胞质移位至细胞核,进而促进TNF-α、IL-6 、IL-1β、iNOS等炎性因子的释放。本研究结果显示,LPS能够通过磷酸化使磷酸化p38 MAPK,继而激活其下游的NF-κB p65,进而上调TNF-α、IL-1β、IL-6、iNOS的mRNA水平,与文献报道一致[16]。而山楂叶提取物Hyp能够明显抑制p38 MAPK和NF-κB p65的磷酸化水平,并显著下调TNF-α、IL-1β、IL-6、iNOS的mRNA水平。沉默信息调节因子6(silent information regulator 6,Sirt 6)是SIR2家族的重要成员之一。最近文献报道,Sirt 6不仅具有抗氧化作用,还可调控NF-信号转录,进而抑制炎症因子的释放[17]。本研究结果显示,LPS能够明显降低Sirt6的蛋白表达,与文献报道一致[18]。而山楂叶提取物Hyp可明显增加Sirt6的蛋白表达,提示山楂叶提取物Hyp可以通过抑制p38 MAPK磷酸化,激活Sirt6进而调控NF-κB炎症通路发挥作用。值得注意的是,分子对接结果表明,山楂叶提取物Hyp能够与p38 MAPK结合并通过氨基酸残基Asp168、Lys53、His107等发生相互作用,提示p38 MAPK可能为山楂叶提取物Hyp作用的潜在靶点。值得注意的是,Hyp能够显著抑制LPS诱导的细胞凋亡,并使其阻滞在S期,但其抗凋亡的作用机制有待于进一步探索。此外,本研究只是初步探讨了在体外实验中Hyp的抗炎作用可能与抑制p38 MAPK磷酸化和激活Sirt6进而抑制NF-κB p65的磷酸化,从而抑制炎症因子的释放有关,其具体的作用机制还有待于在体内动物实验中进一步验证。
综上,在本实验条件下,Hyp具有抗LPS诱导RAW264.7细胞炎症反应的作用,其作用可能与调控p38 MAPK/Sirt6/NF-κB信号通路相关。本研究旨在为将Hyp研发为抗炎药物应用于临床治疗炎症相关疾病提供重要参考。
