大鼠感染泡球蚴后外周血及脾脏中滤泡辅助T淋巴细胞的变化
2021-07-26张耀刚李建华田美媛黄登亮马艳艳樊海宁
张耀刚,李建华,侯 静,孙 莉,田美媛,江 源,黄登亮,张 涛,3,马艳艳,樊海宁
1 青海大学附属医院 中心实验室,西宁 810000;2 青海省包虫病研究重点实验室,西宁 810000;3 青海大学 临床医学院,西宁 810000
多房棘球绦虫的幼虫期是泡型包虫病(aveolar echinococcosis,AE)的病原体,是一种分布在北半球的寄生性人畜共患疾病,估计每年有17 400例新感染[1-2]。在全球每年AE新发病例中,91%发生在中国,某些地区的人类流行率超过3%[3]。在泡球蚴慢性感染过程中,最初的急性炎症Th1反应逐渐转化为混合Th1/Th2反应[4]。但这种相对简单的Th1-Th2转变模式已经被新的研究不断修改,并且已经发现其他T淋巴细胞的亚群也参与到泡球蚴慢性感染过程,如CD4+CD25+Foxp3+调节性T淋巴(Treg)细胞和Th17细胞作为Th1和Th2细胞的两个不同亚群,它们似乎在AE的发病过程中起着重要的作用[4-5]。新近的报道发现T淋巴细胞还有一个独特的亚群,就是滤泡辅助T淋巴细胞(Tfh),在调节T淋巴细胞依赖性B淋巴细胞反应中起着关键作用。这类特殊的辅助性T淋巴细胞定位于生发中心,其高表达CXCR5、ICOS(inducible T-cell costimulator)、PD-1(programmed death-1)、CD200、BTLA(B-and T-lymphocyte attenuator)等表面受体,以及细胞转录因子Bcl6[6]。生发中心的形成、B淋巴细胞的分化和抗体亲和力成熟过程都离不开Tfh的辅助作用。泡球蚴在宿主内的免疫逃避机制是否与Tfh细胞有关,是很值得探讨的问题,因此,本研究初步观察了多房棘球蚴在AE动物模型中的表达,以了解泡球蚴感染与Tfh细胞的关系。
1 材料与方法
1.1 实验动物 8~10周龄SD雄性大鼠购买于南京市江宁区青龙山动物繁殖场。实验动物生产许可证编号:SCJX(苏)2017-0001;实验动物使用许可证编号SYXK(青)2016-0001:动物合格证号:2019186104。用于泡球蚴保种的蒙古长爪沙鼠来源于青海省包虫病研究重点实验室。
1.2 仪器试剂 BD FACSCelest流式细胞仪,CoraLite®647-Conjugated PD-1(Proteintech,CL647-66220),Anti-CXCR5抗体 (Alexa Fluor®488)(ABcam,ab223980),Mouse Anti-Rat CD4(BD,551397),Lysing Buffer(BD,555899)。
1.3 动物造模 将1只成功感染泡球蚴的长爪沙鼠断颈处死后分离原头节,使用0.04%台盼蓝检查原头节活性。实验大鼠随机分为正常对照组和模型组,每组10只。对照组不做任何处理,模型组用10%水合氯醛0.3 ml/100 g麻醉,碘伏消毒上腹部皮肤,开腹约0.5 cm,直视下7 号针头右肝叶穿刺,注入泡球蚴混悬液(约2000个具有活性的原头节),然后用可吸收手术缝合线缝合腹部肌肉及皮肤。3个月后,用10%水合氯醛0.3 ml/100 g 麻醉SD大鼠后,开腹暴露下腔静脉,用含EDTA-K2的采血管保存血液。断颈处死后分离脾脏。
1.4 脾脏单细胞悬液的制备 称取0.1 g的脾脏组织,在300目的钢网上研磨,钢网下放置35 mm的细胞培养皿收集细胞,边研磨边用HBSS缓冲液冲洗,将细胞培养皿中的液体用300目的钢网在过滤一次后,转移至15 ml离心管中。混匀后静置5 min。将最上层2 ml去掉,吸取1 ml细胞悬液转入1.5 ml离心管中,1000 r/min 离心5 min,小心吸掉上清。加入1 ml红细胞裂解液,混匀后,冰上静置15 min,1000 r/min 离心5 min,小心吸掉上清,加入1 ml HBSS缓冲液悬浮细胞后,450 g/min 离心5 min,吸掉上清,加入1 ml HBSS缓冲液悬浮细胞,并计数。每个流式管分装1×106个细胞。用HBSS缓冲液将体积定容为100 μl。
1.5 PBMC细胞悬液的制备及荧光抗体孵育 依照血常规结果,计算每个检测管WBC的数目为1×106个细胞,将血液分装于流式检测管中,每组设置blank管和三色荧光标记管,以CD4+CXCR5+PD1+为Tfh细胞的标记。每管加入CD4-PE 5 μl,CXCR5-488 2 μl,PD1-Alexa Fluor 647 1 μl,旋涡混匀,室温避光孵育20 min,加入1 ml红细胞裂解液,旋涡混匀冰上静置15 min,1000 rpm/min 离心5 min,小心吸掉上清,加入1 ml HBSS缓冲液悬浮细胞后,450 g/min离心5 min,吸掉上清,重复3次,洗去红细胞,加入300 μl HBSS缓冲液悬浮细胞,上机检测。脾脏细胞荧光抗体孵育步骤与PBMC细胞类似。
1.6 伦理学审查 本研究所用实验动物均按照青海大学附属医院科研伦理委员会的指导原则接受人道护理,动物操作规程经青海大学附属医院科研伦理委员会批准,批号:P-SL-2019033。所有手术均在水合氯醛麻醉下进行,并尽一切努力减少痛苦。
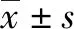
2 结果
2.1 模型建造情况 造模3个月后,大鼠肝脏上长出明显病灶(图1a),病灶中可见较多原头节(图1b)。
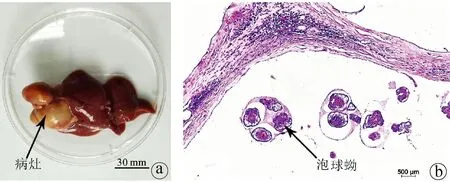
注:a,感染多房棘球蚴3个月后,SD大鼠肝脏病灶情况;b,病灶HE染色结果(×100)。图1 模型建造情况
2.2 Tfh细胞在AE模型鼠外周血中的表达情况 感染泡球蚴3个月后,模型组大鼠外周血中CD4+CXCR5+PD1+Tfh细胞在CD4+细胞中的平均占比相较于正常对照组明显升高(t=10.230,P<0.001),在所有细胞中CD4+CXCR5+PD1+Tfh细胞所占的比例低于正常对照组(t=5.520,P<0.001)(表1,图2)。
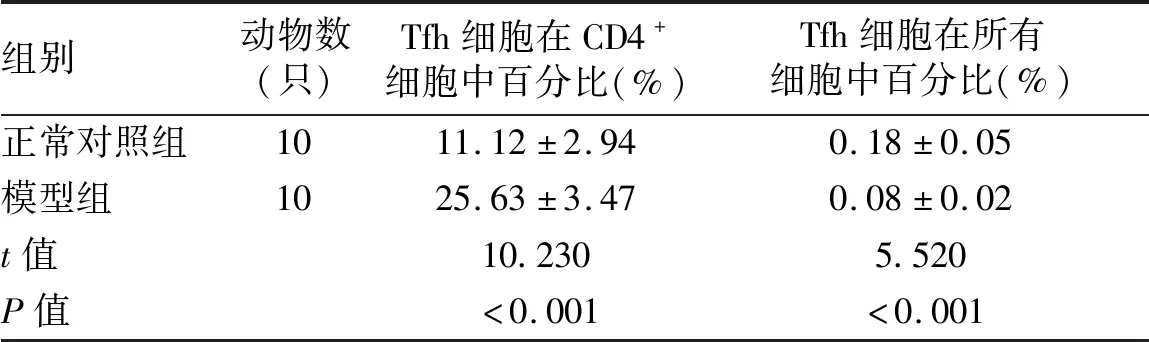
表1 AE模型鼠外周血中Tfh细胞表达情况

注:空白组,未标记荧光抗体用于流式细胞术圈门设定界限的组;a、d、g,外周血中淋巴细胞;b、e、h,CD4+细胞;c、f、i,CD4+中CXCR5和PD1阳性细胞,其中Q2门表示CD4+CXCR5+PD1+Tfh细胞。图2 AE模型鼠外周血中Tfh细胞的流式细胞检测结果
2.3 Tfh细胞在AE大鼠模型脾脏中的表达情况 感染泡球蚴3个月后,模型鼠脾脏中Tfh细胞在所有细胞中百分比高于正常对照组(t=4.769,P<0.001)(表2,图3 )。

表2 AE模型鼠脾脏中Tfh细胞表达情况

注:a、d、g,目的细胞群;b、e、h,CD4+细胞;c、f、i,CD4+中CXCR5和PD1阳性细胞,其中Q2门表示CD4+CXCR5+PD1+Tfh细胞。图3 AE模型鼠脾脏中Tfh细胞的流式细胞检测结果
3 讨论
尽管Tfh的功能早在1980年就已众所周知,但直到2009年人们才认识到其属于CD4+T淋巴细胞亚群,最早在人的扁桃体中被发现。它们在保护性免疫中起关键作用,协助B淋巴细胞产生针对外源病原体的抗体。Tfh细胞位于次级淋巴器官,包括扁桃体、脾脏和淋巴结,与B淋巴细胞紧密互动[7-9]。除此之外,在循环系统中也可以发现Tfh细胞。Tfh细胞对免疫系统的建立以及功能的完善非常重要,特别是针对感染疾病的体液免疫起决定性调节作用,同时在自身免疫和肿瘤发生等相关疾病中也扮演重要角色。其特殊之处在于,它没有溶解细胞或吞噬细胞的作用,但却可以激活并指导其他免疫细胞[10]。
在许多抗体产生过多或不足的疾病中,Tfh功能已显示出功能失调。血液循环中的Tfh细胞数已表明自身免疫性疾病(包括系统性红斑狼疮和类风湿性关节炎)患者血液中Tfh数量的增加。由ICOS缺乏引起的常见免疫缺陷患者已出现循环Tfh严重降低和抗体生成方面的缺陷[11-13]。如目前发现在HIV感染中Tfh细胞功能可能存在缺陷。研究[14-15]发现,HIV患者Tfh细胞明显增多,体内广谱中和性抗体量却极少,并且从HIV感染患者体内分离的Tfh细胞,其IL-21的分泌明显减少,无法给予B淋巴细胞所需信号,说明 HIV患者的Tfh存有极大缺陷[16-17]。
最近的证据[18]表明,疟原虫感染能够使CD4+T淋巴细胞偏向于向主要产生IFNγ的Th1细胞转变,从而影响Tfh细胞的分化,导致B淋巴细胞对疟原虫反应降低。泡球蚴进入宿主机体后会引起复杂的免疫反应,最终引起免疫逃避。首先参与抗虫免疫的是固有免疫系统的细胞,但树突状细胞和巨噬细胞不是泡球蚴实现免疫逃避调节期功能的唯一目标。内皮细胞(在皮肤、肺、肠和肝中)也可以被诱导表达和分泌抗炎介质,如IL-10和前列腺素[19]。这样,寄生虫不仅减少了被消灭的可能性,还能最大限度地减少局部宿主组织的损伤。通过诱导树突状细胞和巨噬细胞的功能变化,进而引起T淋巴细胞功能的转变[4]。
泡球蚴与棘球蚴具有较高的同源性,但感染机体后引起机体的反应却存在较大差异,棘球蚴感染人体后可被宿主产生的纤维外囊包裹,而泡球蚴感染宿主后呈侵润性生长[20-21]。泡球蚴感染早期引起的宿主免疫应答以Th1类为主,3个月后则转为以Th2类为主[5]。丁剑兵教授团队[22]研究细粒棘球蚴患者术前术后外周血Tfh细胞发现,囊型包虫病患者术前外周血中Tfh细胞比例明显高于对照组,且术后Tfh细胞明显下降,提示Tfh细胞参与了棘球蚴的感染。本研究也发现泡球蚴感染SD大鼠3个月之后,外周血Tfh细胞较正常组明显升高。但Tfh细胞在脾脏CD4+T淋巴细胞中所占比例并没有升高,并且无论是外周血还是脾脏中,泡球蚴感染后Tfh细胞在单个核细胞或脾脏细胞中的百分比是降低的,提示泡球蚴感染3个月后,宿主免疫细胞可能减少。
本研究初步研究了Tfh细胞在泡球蚴感染后的变化,今后将进一步深入动态的分析Tfh细胞在泡球蚴感染引起宿主免疫功能调节,以适应自身生存中的作用,为揭示泡球蚴在宿主体内的免疫逃避机制提供参考。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:马艳艳、樊海宁负责课题设计,拟定写作思路;张耀刚、李建华负责资料分析,撰写论文;侯静、孙莉、田美媛、江源、张涛、黄登亮参与收集数据,修改论文;马艳艳、樊海宁指导撰写文章并最后定稿。
