高密度脂蛋白胆固醇对HBV相关慢加急性肝衰竭严重程度及预后的预测价值
2021-07-26黄小平李文婷甘建和
徐 英,黄小平,陈 丽,孙 蔚,李文婷,王 艳,甘建和
苏州大学附属第一医院 感染科,江苏 苏州 215000
HBV相关慢加急性肝衰竭(HBV-ACLF)是由HBV引起的严重肝损伤,导致肝脏的合成、解毒、代谢和生物转化功能严重障碍,从而出现一系列表现的严重临床症候群。肝脏是血脂代谢的重要场所[1],肝衰竭患者常出现血脂水平异常,并与疾病的严重程度相关[2]。高密度脂蛋白胆固醇(HDL-C)从肝外组织将胆固醇转运到肝脏进行代谢,再分泌到胆汁中排出体外,已知其是动脉粥样硬化性心脏病的危险因素[2],但其还与机体的炎症反应有关[3]。HDL-C是生化检查的常规化验指标,获取方便,本研究旨在探讨HDL-C对HBV-ACLF预后的预测价值。
1 资料与方法
1.1 研究对象 选取苏州大学附属第一医院感染科2015年1月—2019年1月收治的肝病患者,根据病情发展的不同阶段,收集了HBV-ACLF患者42例(HBV-ACLF组),HBV相关肝硬化患者30例(肝硬化组),HBV活动性肝炎25例(慢性肝炎组),并选取同期健康者24例(健康组)。排除与纳入标准:HBV-ACLF组按照《肝衰竭诊治指南(2018年版)》[4]标准纳入,并排除入院时即存在感染,合并其他自身免疫性肝炎、药物性肝炎、遗传代谢性肝病、代谢相关脂肪性肝病、高脂血症、高胆固醇血症、冠心病、动脉粥样硬化血管病、高血压病、糖尿病、结缔组织病、恶性肿瘤,服用他汀类、贝特类及胆酸螯合剂等药物者。肝硬化组按照《肝硬化诊治指南》[5]标准纳入,慢性肝炎组按照《慢性乙型肝炎防治指南(2019年版)》[6]标准纳入。
1.2 观察指标 收集患者的一般临床指标,回顾性分析患者的临床资料,包括性别、年龄、PT、Alb、TBil、Cr、尿素氮(BUN)、TC、TG、HDL-C、LDL-C、MELD评分。随访时间3个月,好转组为出院3个月内存活者;住院期间死亡、自动出院及行肝移植手术均划归为未好转组。
1.3 伦理学审查 本研究方案经由苏州大学附属第一医院伦理委员会审批,批号:(2021)伦研批第002号。
1.4 统计学方法 采用SPSS 21.0软件对数据进行分析。不符合正态分布的连续性变量采用M(P25~P75)表示,两组间比较采用Mann-WhitneyU检验,多组间比较采用Kruskal-WallisH检验,进一步组内比较采用Wilcoxon秩和检验,采用Bonferroni校正法。计数资料两组间比较采用χ2检验。影响患者预后的独立危险因素用二元logistic回归分析,受试者工作特征曲线(ROC曲线)用于分析预测变量的准确性。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 肝硬化组、HBV-ACLF组、慢性肝炎组、健康组在PT、Alb、BUN、TBil、TC、TG、HDL-C、LDL-C、MELD评分上差异均有统计学意义(P值均<0.001)(表1)。进一步将各组间HDL-C水平进行两两比较分析发现,HDL-C水平在HBV-ACLF组显著低于肝硬化组(Z=3.821,P<0.001,Bonferroni校正P=0.001)、慢性肝炎组(Z=5.921,P<0.001,Bonferroni校正P<0.001)及健康组(Z=7.228,P<0.001,Bonferroni校正P<0.001)。
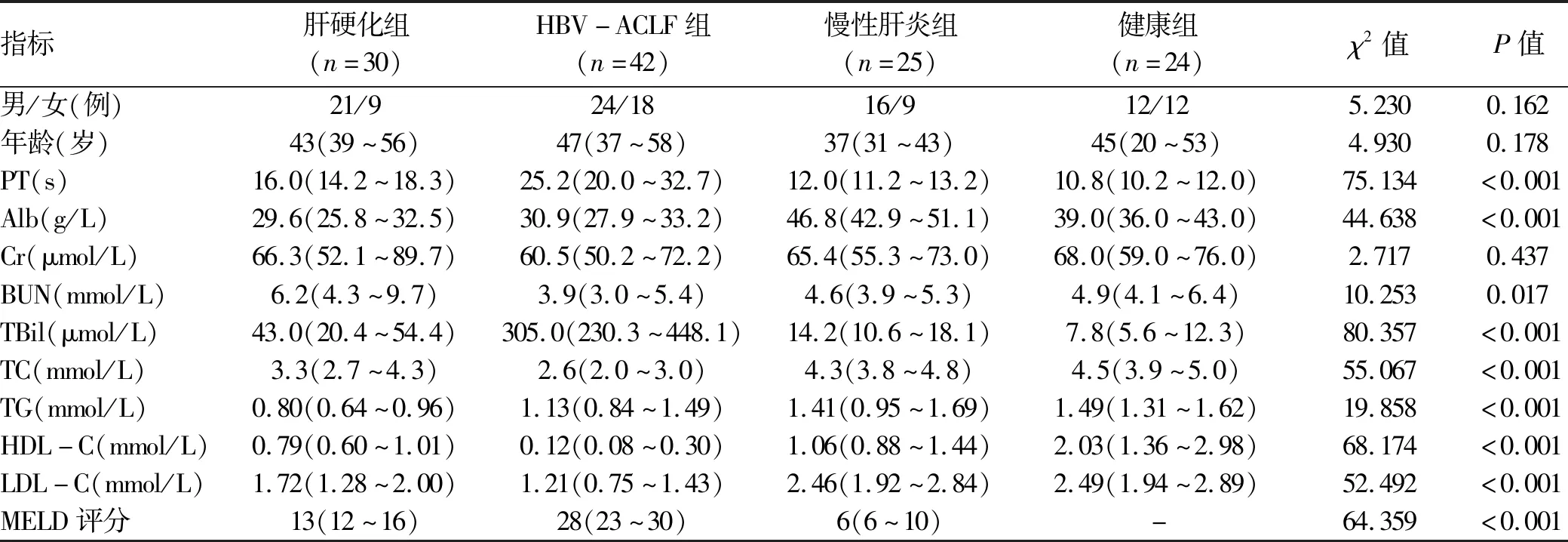
表1 一般临床资料
2.2 HBV-ACLF组不同预后患者临床资料比较 将HBV-ACLF组分为好转组与未好转组进行两两比较,结果发现年龄、PT、HDL-C、MELD评分在两组间差异均有统计学意义(P值均<0.05)(表2)。
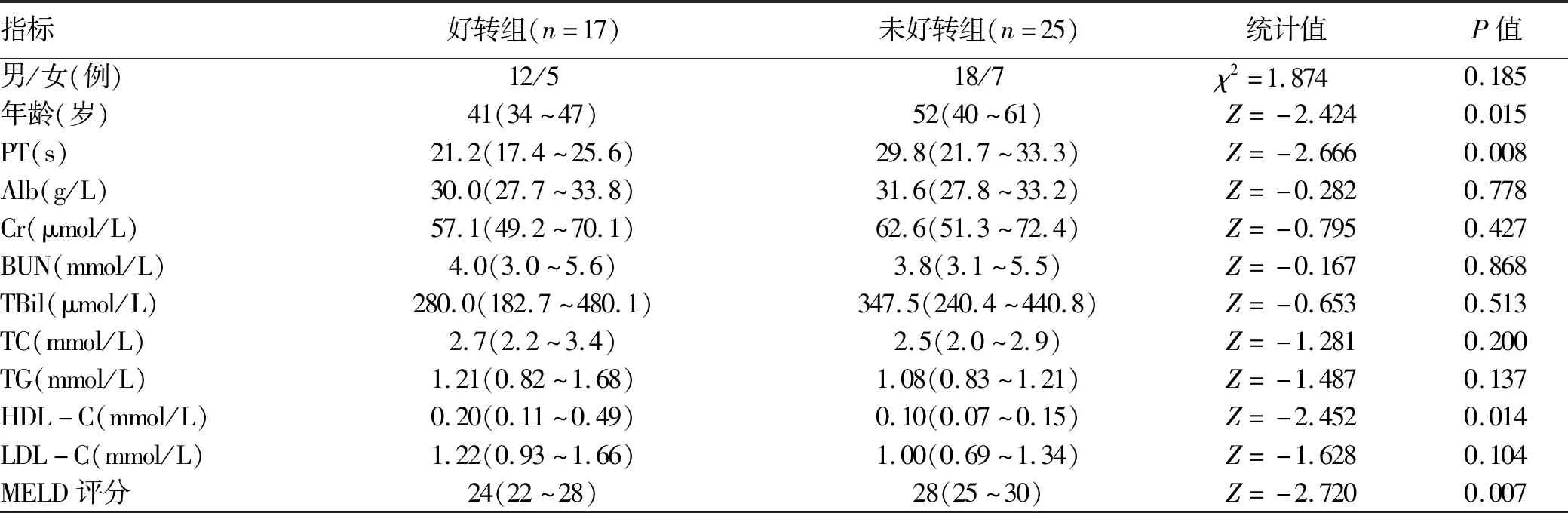
表2 HBV-ACLF组不同预后患者临床资料比较
2.3 HBV-ACLF预后的影响因素 将上述有统计学差异的指标,进一步采用二元logistic回归分析,结果发现HDL-C(OR=0.003,95%CI:0~0.548,P=0.029)和MELD评分(OR=1.588,95%CI:1.032~2.443,P=0.035)是影响HBV-ACLF预后的独立危险因素(表3)。
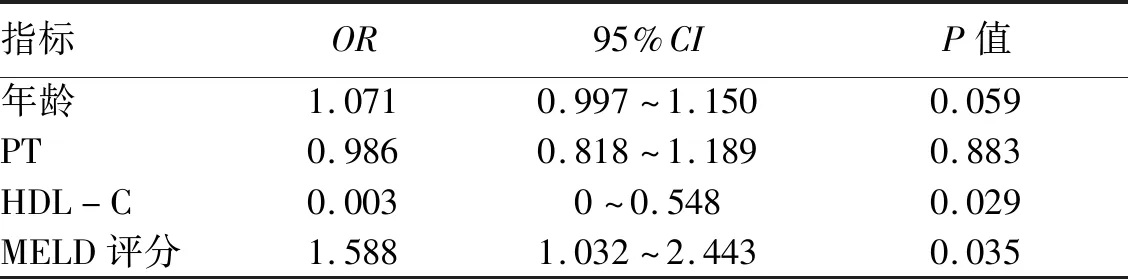
表3 HBV-ACLF预后影响因素分析
2.4 HDL-C对HBV-ACLF预后的预测价值 HDL-C的ROC曲线下面积(AUC)为0.807,截断值为0.175 mmol/L,敏感度0.706,特异度0.800,95%CI:0.677~0.937,P=0.001,MELD评分的AUC为0.822,截断值为26.500,敏感度0.760,特异度0.765,95%CI:0.696~0.928,P<0.001(图1)。

图1 HDL-C、MELD评分对HBV-ACLF预后预测的ROC曲线
3 讨论
HBV-ACLF是由HBV感染引起的严重肝损伤而出现的临床严重症候群,对其病情做出准确及时的评估对指导治疗方案及抢救时机有重要意义[4]。在HBV-ACLF中,肝脏合成胆固醇能力下降,胆固醇浓度的下降主要是由HDL-C水平引起[7];HDL-C是肝细胞膜的主要成分,并且给肝细胞提供能量[8]。因此肝衰竭患者中HDL-C降低,而HDL-C降低又加重了肝损伤[9]。
细菌感染是慢性肝病发展成ACLF的最常见诱因[10]。HBV-ACLF患者易发生感染并发症[11],导致其器官衰竭,住院时间延长以及病死率增加[12]。而除了感染以外,肝衰竭患者本身肠道屏障容易被破坏[13],肠道菌群易位[14],肠道细菌产生内毒素增加[15],同时由于肝衰竭患者内毒素清除能力下降,导致患者易发生内毒素血症。内毒素血症可以使细胞因子过度生成,一氧化氮酶过表达以及血流动力学变化障碍[3]。细胞因子的过度产生与系统性炎症有密切关系,在肝衰竭患者中细胞因子水平以及系统性炎症发生较无肝衰竭患者明显升高[16]。而HDL-C能中和细菌脂多糖等内毒素,并促进这些产物排泄[17]。Levine等[18]通过转基因小鼠将血浆HDL-C水平提高了2倍,发现HDL-C能与更多内毒素结合,降低血浆细胞因子水平,相对较低水平的HDL-C有更高的存活率。Fessler等[19]发现HDL-C能够动员胆固醇,通过Toll样受体信号通路作用来减轻炎症反应。故而笔者推断ACLF患者的HDL-C水平降低,导致其对抗炎症、内毒素的能力下降,从而导致其更差的预后。Tsai等[3]研究表明在终末期肝病严重脓毒症患者中血清HDL-C以及Apo A-Ⅰ与肝脏的储备功能以及疾病的严重程度呈明显负相关。
在本研究中4组患者的HDL-C在HBV-ACLF组最低,其次是肝硬化组。进一步比较HBV-ACLF组中预后好转组及未好转组,发现未好转组的HDL-C水平与好转组比较差异有统计学意义(P<0.05),这也证实了肝衰竭患者未好转组相对好转组胆固醇合成能力更低,内毒素清除能力更差。这与Trieb等[17]的研究结果一致。Logistic回归发现HDL-C是肝衰竭患者预后的独立危险因素。通过ROC曲线分析发现,HDL-C为0.175 mmol/L时可以作为预测肝衰竭预后的截断值,若HDL-C<0.175 mmol/L,则提示患者预后不佳,需要采取最积极的治疗方式去抢救患者,比如器官支持、血浆置换、甚至肝移植等,从而提高抢救成功率,减少经济损失。
本研究为回顾性研究,所选取病例数有限,即使典型但不能代表所有病例的特征;本研究仅为单中心的病例回顾,未来可以扩大样本量,多中心收集HBV-ACLF患者的资料进行回顾性分析,从而总结规律指导临床。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:徐英、甘建和负责课题设计,资料分析,撰写论文;徐英、黄小平、陈丽、孙蔚、李文婷、王艳参与收集数据,修改论文;徐英、黄小平、甘建和负责拟定写作思路,指导撰写文章并最后定稿。
