超声引导下局部消融治疗危险区域原发性肝癌的效果及安全性分析
2021-07-26王春妍刘建勇周永和
王 婷,王春妍,刘建勇,周永和,陆 伟,李 嘉,周 莉
1 天津医科大学 研究生院,天津 300070;2 天津市第二人民医院 a.肝病科,b.超声科,天津 300192;3 天津医科大学肿瘤医院 肝癌中心,天津 300060
原发性肝癌是我国第4位常见恶性肿瘤及第2位肿瘤致死病因[1]。尽管外科手术是首选治疗方法,但因患者大多合并肝硬化,或确诊时已达中晚期,仅20%~30%的肝癌患者有手术切除机会。局部消融治疗因其创伤小、疗效确切,使一些不适合或不愿手术切除的患者亦获得根治机会[2]。根据我国最新指南[3],Ⅰa~Ⅱa期肝癌患者均可行消融治疗。对于位置毗邻大血管、重要脏器或肝包膜等危险区域的肝癌,被列为消融治疗的相对禁忌证。本研究开展了回顾性对照试验,探讨超声引导下局部消融治疗危险区域肝癌的可行性、安全性和有效性;探讨更规范、安全和个体化的危险区域肝癌消融术方案,以改善患者预后。
1 资料和方法
1.1 研究对象 选取2014年1月—2017年9月天津市第二人民医院收治的原发性肝癌患者,肝癌的诊断标准参照2019年版原发性肝癌诊疗规范[1]。
1.2 纳入与排除标准 纳入标准:(1)符合原发性肝癌Ⅰa~Ⅱa期诊断标准;(2)不能或不愿行手术切除及肝移植治疗;(3)肝储备功能量化分级(Child-Pugh)A、B 级;(4)初次接受消融治疗。排除标准:(1)严重肝性脑病患者;(2)合并顽固性腹水;(3)合并其他严重脏器疾病,不适合消融治疗;(4)曾行包括手术切除、消融、经动脉化疗栓塞术、肝动脉置管持续化疗灌注或抗肿瘤药物等任何针对肿瘤的治疗。按照肿瘤位置将患者分成2组,即危险区域组和非危险区域组。危险区域定义为:病灶邻近肝内大血管、肝外重要脏器,包括靠近门静脉一二级分支5 mm以内;肝静脉、下腔静脉主干旁;重要脏器(心脏、胆囊、肺、膈肌、右肾或胃肠道等)5 mm以内,邻近或突出肝包膜等。非危险区域定义为:危险区域以外的其他病灶[4-5]。
1.3 研究方法
1.3.1 消融设备 RF2000型射频消融治疗仪,最大输出功率 100 W。ECO-100C型智能微波治疗仪,微波频率为(2450±10)MHz,输出功率为10~100 W。SIEMENS ACUSON OXANA3 型超声仪,4V1探头,频率为4 Hz,一次性医用塑料薄膜包裹超声探头。
1.3.2 消融方法 完善影像学检查以了解病灶的位置、形态、大小和肿瘤内部及周边血供情况,确定最佳进针部位和途径。根据病灶位置选择适当体位,常规采用静脉麻醉,必要时予以气管插管呼吸器辅助通气,充分显示近肝顶的病灶。在二维超声或超声造影的引导下将冷循环射频或智能微波消融电极针插入目标病灶的预定部位。根据肿瘤大小、位置和患者一般情况选择消融方式和作用时间,必要时予以多点消融治疗。对于危险区域肝癌,视其所邻近的危险部位,酌情采用保护措施。毗邻膈肌、胃肠道、右肾的病灶采用人工胸腹水,形成保护性隔热带。治疗以覆盖肿瘤以外5 mm为完全毁损[6-7]。治疗结束后退针过程中实施针道消融,以防术后针道出血或肿瘤细胞种植转移。
1.3.3 术后随访 术后24 h监测生命体征,同时进行保肝、水化、预防感染、营养支持及镇痛治疗,积极预防并处理术后并发症。术后1个月复查肝肾功能、血常规、AFP及增强CT/MRI。以后每3个月复查1次肝肾功能、血常规、AFP及腹部超声,每6个月复查1次增强CT/MRI,必要时行超声造影协助诊断。随访记录肿瘤复发或进展情况,如出现进展或复发,则按照指南[3]进行评估及后续治疗,包括手术切除、再次消融、经动脉化疗栓塞术、肝动脉置管持续化疗灌注或抗肿瘤药物等。本研究随访时间截至2019年9月。
1.3.4 安全性评价 根据2011年《肝癌局部消融治疗规范的专家共识》[8]将术后并发症分为轻度、重度并发症:轻度并发症主要有非感染性发热、疼痛、皮肤浅Ⅱ度烧伤、少量胸腔积液、少量气胸等;重度并发症主要有感染、消化道出血、腹腔内出血、肿瘤种植、肝衰竭、肠穿孔等。分析2组患者术后轻度、重度并发症发生情况。
1.3.5 有效性评价 评价患者近、远期疗效,包括AFP水平变化及影像学肿瘤活性区域的变化,采用改良实体瘤疗效评价标准进行评价[9]。近期疗效根据消融术后肿瘤坏死情况进行分析,完全缓解定义为肿瘤完全坏死,增强CT/MRI动脉期未见病灶强化。远期疗效根据消融术后肿瘤是否进展进行分析,肿瘤进展定义为增强CT/MRI显示肿瘤直径增大≥20%或出现新发病灶。统计2组患者术后1个月AFP水平下降率及复常率(术后AFP下降:指术前AFP水平升高或正常的患者术后1个月AFP水平较术前下降;术后AFP复常:指术前AFP水平升高,术后1个月恢复至正常水平),术后完全缓解率及术后1、2年肿瘤无进展生存率、中位肿瘤无进展生存时间及累积生存率。接受消融治疗至患者死亡或随访终止为生存时间。
1.4 伦理学审查 本研究经由天津市第二人民医院伦理委员会审核批准,批号:[2014]11号。
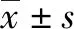
2 结果
2.1 一般资料 共纳入危险区域组患者134例,其中男95例,女39例,平均(58.3±10.0)岁,肿瘤最大直径(2.3±0.9)cm;非危险区域组患者45例,其中男37例,女8例,平均(58.3±8.7)岁,肿瘤最大直径(2.5±1.0)cm。2组共计187个病灶,危险区域140个,非危险区域47个。危险区域组病灶中有46个邻近重要血管,8个邻近第一肝门,24个邻近胆囊,14个邻近心脏,16个邻近膈肌,10个邻近右肾,82个邻近肝包膜,5个邻近肝下极,6个邻近肝顶,其中119例患者病灶同时邻近2个及以上危险区域。2组患者在性别、年龄、肿瘤直径、肝癌分期及肝功能等方面差异均无统计学意义(P值均>0.05)(表1)。

表1 2组患者一般资料
2.2 安全性评估 危险区域组和非危险区域组分别有17例(12.7%)和12例(26.7%)发生肝区疼痛;19例(14.2%)和5例(11.1%)发生术后非感染性发热;21例(15.7%)和6例(13.3%)发生恶心、呕吐。上述并发症经对症治疗后均恢复正常。2组患者术后轻度并发症总发生率分别为 42.5%(57/134)和 51.1%(23/45),差异无统计学意义(P=0.317);术后重度总并发症发生率分别为6.0%(9/134)和2.2%(1/45)差异无统计学意义(P=0.290)。危险区域组有3例(2.2%)发生上消化道出血,非危险区域组有1例(2.22%)发生上消化道出血,经抑酸、止血等治疗好转后再未出血;危险区域组有5例(3.7%)发生术后感染,经积极抗感染治疗后好转,非危险区域组无患者发生术后感染。2组患者均未出现胃肠道穿孔、腹腔内出血、肿瘤种植、肝衰竭等严重并发症,无手术相关死亡病例(表2)。

表2 2组患者术后并发症情况比较
2.3 有效性评估 术后随访3~68个月,中位随访时间为31个月。危险区域组与非危险区域组术后1个月肿瘤完全缓解率分别为91.8%(123/134)和93.3%(42/45),差异无统计学意义(P=0.990);术后 1个月AFP下降率分别为75.0%(99/132)和80.0%(36/45),AFP复常率分别为33.9%(21/62)和26.3%(5/19),差异均无统计学意义(χ2值分别为0.464、0.381,P值均>0.05)(表3)。2组术后1年肿瘤无进展生存率分别为60.7%和63.5%,术后2年肿瘤无进展生存率分别37.1%和55.0%,中位无进展生存时间分别为18个月和27个月,差异无统计学意义(χ2=0.573,P=0.449)(图1)。术后1年累积生存率分别为96.8%和93.3%,2年累积生存率90.3%和87.8%,差异无统计学意义(χ2=0.110,P=0.731)(图2)。

图1 2组患者无进展生存率比较

图2 2组患者累积生存率比较
3 讨论
局部消融治疗是肝癌的根治性治疗手段之一,具有对肝功能影响少、微创、疗效确切的特点。局部消融最常用超声引导,多数的小肝癌可经皮穿刺消融。但危险区域的肝癌因消融难度大、易损伤邻近重要脏器或组织被列为消融治疗的相对禁忌证[8]。对危险区域的肝癌病灶,在采用人工胸水或人工腹水等热隔离保护措施后仍可进行热消融治疗,以实现足够的消融“安全边缘”,同时减少邻近脏器的损伤。美国国立癌症综合网络肝胆肿瘤临床实践指南[10-11]指出“所有肿瘤都可进行消融”,但病灶直径>3 cm 或邻近危险区域时操作应格外谨慎。延长患者生存期,提高患者生活质量是肝癌治疗的主要目的,而非单纯地消灭肿瘤。
本研究结果显示,经皮超声引导下的 RFA 或 WMA 治疗危险区域组和非危险区域组肝癌的重度、轻度并发症发生率差异无统计学意义,与其他学者[12-14]的研究结果一致。本研究中,轻度并发症发生率非危险区域组较高,可能与样本量相对较小有关。危险区域组的重度并发症发生率较高,考虑与肿瘤位置或消融范围更大有关,但组间差异无统计学意义。在9例发生重度并发症的患者中,4例为上消化道出血,症状均为少量咖啡样呕吐物及柏油样便,经积极止血对症治疗后均好转,未发生上消化道大出血。此4例患者胃镜检查均存在重度食管胃底静脉曲张及中、重度的门静脉高压性胃病,故其上消化道出血考虑与肝硬化门静脉高压,胃肠黏膜病损,侵袭性治疗后短期内出现应激有关。5例患者出现术后感染,均合并糖尿病,其中1例为胆系感染,其病灶靠近门静脉支及胆囊,可能与消融过程中刺激胆囊,造成胆血返流有关,余4例血培养阳性,考虑存在脓毒血症,均经积极抗感染治疗后恢复。
肝癌局部消融虽然是微创治疗,但患者仍可能出现应激反应,尤其是术前评估存在显著门静脉高压的患者,术后积极的保护胃肠黏膜及降低门静脉压力等内科治疗有利于预防上消化道出血的发生。对毗邻膈肌、胃肠、右肾的危险区域肝癌,消融术中采取相应的保护措施,如以人工胸水、人工腹水等辅助治疗,有利于减少邻近脏器的损伤[15-17]。如预判术中或术后有胆囊损伤或胃肠道穿孔风险的患者,术后可予以禁食并逐渐过渡到流质、半流质饮食,并积极抑酸、预防感染等治疗,密切监测患者腹部症状及体征变化,必要时及时予以影像学检查及外科干预治疗。
本研究中,危险区域组及非危险区域组术后1 年、2年肿瘤无进展生存率、中位无进展生存时间的差异均无统计学意义,与既往研究[18]结果相似。本研究团队前期研究[19]指出,肿瘤病灶邻近危险区域是大功率微波消融术后复发的独立危险因素。因此,对于危险区域的肝癌,进行消融操作应格外谨慎,个体化的治疗策略有助于改善肝癌消融治疗的预后,扩大消融治疗的应用范围,在保证手术安全性的同时,应尽可能实现完全消融,以降低术后复发率,延长无进展生存时间。
综上所述,超声引导下经皮局部消融术治疗危险区域肝癌可行、安全、有效。可望获得与非危险区域组相当的近期与远期治疗效果。本研究尚存在以下不足:因回顾性研究的局限性,可能存在选择偏倚和失访偏倚;样本量较小,未能进行更长时间的随访,且为单中心研究,并发症情况及远期疗效评价有待更大样本量的多中心研究进一步验证。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:王婷负责资料收集,数据分析及文章撰写;陆伟、李嘉、周莉负责课题设计,研究指导,审校并最终定稿;王春妍、刘建勇、周永和负责分析数据,指导文章撰写。
