肥胖儿童血清25-羟基维生素D和骨密度水平的变化及临床价值
2021-07-26罗邱付小平
罗邱 付小平
作者单位:410007 湖南长沙,湖南省儿童医院体检中心
充足的维生素D对儿童正常生长发育是必不可少的,而缺乏维生素D会损害儿童长期健康并增加患慢性病的风险。严重缺乏维生素D可导致佝偻病、骨质疏松症、骨软化症、骨折风险增加和牙齿脱落[1]。最近研究表明,维生素D缺乏与多种疾病有关,包括1型糖尿病、高血压、多发性硬化症以及多种癌症(如乳腺癌、结肠癌和前列腺癌)[2]。肥胖与体内较低水平的25-羟基维生素D〔25-hydroxyvitamin D,25(OH)D〕和较高水平的甲状旁腺激素(parathyroid hormone,PTH)有关[3]。相关研究显示,基于体质量指数(body mass index,BMI),有17.1%的儿童和青少年可被诊断为肥胖。骨密度值影响青春期人群的骨骼发育,且与此时期25(OH)D缺乏风险增加有关。在对肥胖青少年的研究中,25(OH)D缺乏与体质量增加和BMI值升高相关。然而,此年龄段人群25(OH)D与BMI的关系尚缺乏具体数据支持。身体成分和骨骼生长特别依赖于青春期生长激素(growth hormone,GH)轴和性类固醇激素之间的相互作用。GH通过增加肝脏谷氨酸产量影响氮和酸碱平衡,并与青春期胰岛素抵抗有关[4]。然而有证据表明,肥胖可能由激素和营养代谢紊乱、内脏脂肪与胰岛素抵抗增加以及进行性胰岛素不足导致,并与GH轴异常〔GH减少,胰岛素样生长因子Ⅰ(insulin like growth factor Ⅰ,IGF-Ⅰ)和胰岛素样生长因子结合蛋白-3(insulin like growth factor binding protein-3,IGFBP-3)正常但IGFBP-1降低〕和甲状腺激素轴改变〔促甲状腺素(thyrotropin,TSH)升高和甲状腺素(thyroxine,T4)转化为三碘甲状腺激素(triiodothyronine,T3)〕 有关[5]。本研究分析了100名儿童的临床数据,旨在探讨与肥胖儿童25(OH)D缺乏相关的因素,并进一步评估其与骨密度的关系。
1 资料与方法
1.1研究对象及分组 分析2019年12月—2020年8月在本院体检中心体检的100名学龄期儿童检测结果,以其中51名超重和肥胖儿童作为肥胖组,其余49名正常儿童作为对照组。纳入标准:① 年龄6~19岁;② 符合超重及肥胖诊断标准。排除标准:① 因其他疾病或长期服用药物引起的继发性肥胖;② 患有肾病、代谢性骨病、佝偻病等;③ 服用营养补充剂或营养强化食品。
1.2研究方法
1.2.1临床资料收集 记录所有研究对象的年龄、性别、病史、家族史及其他一般资料。受试者穿着轻薄衣服,脱鞋,测量体质量、身高,取两次测量平均值。计算BMI=平均体质量(kg)/平均身高2(m2)。
1.2.2实验室检查 抽取所有研究对象空腹静脉血,测定胰岛素、25(OH)D以及PTH。采用酶联免疫吸附试验(ELISA)检测儿童血清25(OH)D,使用超声骨密度仪测定肱骨骨密度。
1.3伦理学 本研究符合医学伦理学标准,并通过本院伦理审批(审批号:20210507),所有检测均获得过儿童监护人的知情同意。
1.4统计学方法 使用SPSS 22.0软件处理数据。符合正态分布的计量资料以均数±标准差()表示,两组间比较采用独立样本t检验;计数资料以例(%)表示,组间比较采用χ2检验。采用Pearson相关分析法分析血清25(OH)D与体质量指数标准差得分(body mass index standard deviation score,BMISDS)、腰围、腰臀比、胰岛素、骨密度值以及PTH的相关性。P<0.05为差异有统计学意义。
2 结果
2.1肥胖组与对照组的临床资料比较 肥胖组儿童身高、体质量、BMI、BMISDS、腰围和腰臀比均明显高于对照组(均P<0.05)。见表1。
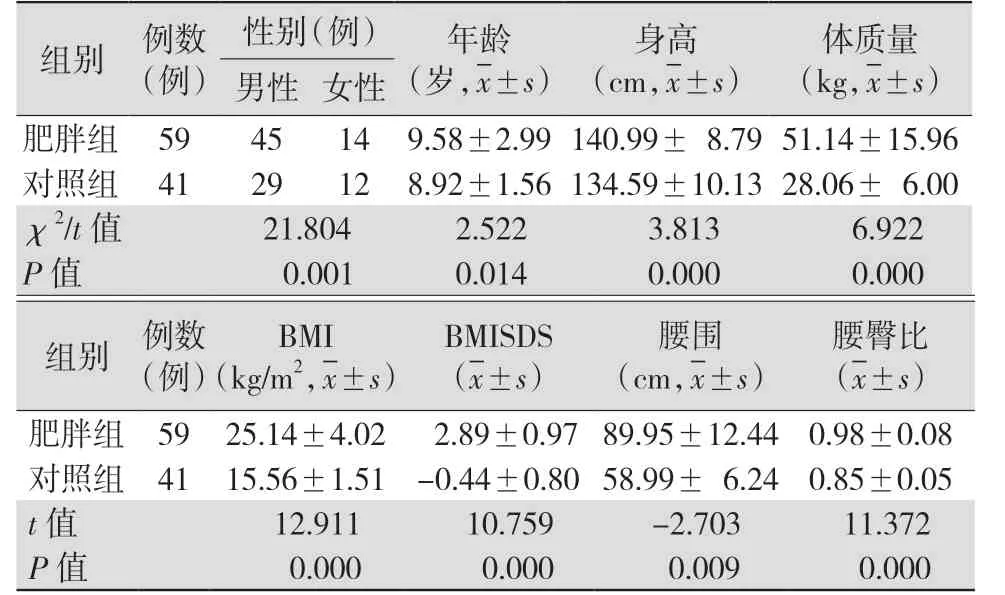
表1 肥胖组与对照组临床资料比较
2.2肥胖组与对照组的实验室检查指标比较 肥胖组血清25(OH)D和骨密度水平均明显低于对照组,胰岛素水平明显高于对照组(均P<0.05);两组PTH水平比较差异无统计学意义(P>0.05)。见表2。
表2 肥胖组与对照组实验室检查指标比较()

表2 肥胖组与对照组实验室检查指标比较()
注:25(OH)D为25-羟基维生素D,PTH为甲状旁腺激素
骨密度(g/m2)肥胖组 59 45.40±11.86 42.72±22.55 25.57±7.98 2.91±1.68对照组 41 59.56±16.08 40.94±17.11 14.03±3.00 3.75±1.15 t值 -3.900 1.043 -5.680 -4.250 P值 0.000 0.695 0.000 0.014组别 例数(例)25(OH)D(nmol/L)PTH(ng/L)胰岛素(μg/L)
2.3 25(OH)D水平与临床指标的相关性分析 血清25(OH)D水平与BMISDS、腰围、腰臀比均呈负相关(均P<0.05),而与胰岛素、骨密度值、PTH均无明显相关性(均P>0.05)。见表3。

表3 25(OH)D与临床指标的相关性分析
3 讨论
目前维生素D缺乏症(vitamin D deficiency,VDD)是全球重大公共卫生问题,对儿童风险更大,儿童期的骨量积累可能是终生骨骼健康最重要的调节因素。据报道,肥胖增加了学龄儿童患VDD的风险[6]。本研究提示,肥胖儿童的25(OH)D水平明显低于正常儿童,并与BMISDS、腰围、腰臀比呈负相关。有研究表明,超重或肥胖与VDD和25(OH)D水平降低独立相关,超重、肥胖或严重肥胖(BMI≥28 kg/m2)的儿童患血管性发育迟缓的可能性大约为正常儿童的2倍,BMI每增加1 kg/m2,血清25(OH)D水平会下降1.15%[7],表明肥胖与血清25(OH)D降低有关。
严重的VDD会导致成人的骨软化和儿童的佝偻病[8]。骨功能不全会导致骨转换增加,造成骨折风险增大。VDD的进展主要分为3个阶段。在第1阶段,低钙血症和手足痉挛是由于血清25(OH)D降低所致,骨化三醇保持不变或升高;在第2阶段,PTH被释放,通过骨骼脱矿来维持血清钙水平,导致佝偻病、低磷血症和碱性磷酸酶(alkaline phosphatase,ALP)水平轻度升高;在第3阶段,血清25(OH)D水平严重下降,导致低钙血症、低磷血症、ALP升高,并有骨脱矿现象。
PTH通常被用作反映25(OH)D水平的指标之一。有研究表明,PTH在肥胖儿童中有升高趋势,但升高不明显,且与肥胖相关性不大[9]。虽然肥胖儿童的PTH水平较高,但仍在正常参考值范围内。先前有研究人员提出了可能的补偿机制来解释维生素D缺乏时PTH水平正常[6]。一项关于肥胖青少年的研究显示,增加25(OH)D的摄入量与较高的PTH水平无关[8]。
肥胖组血清25(OH)D水平低于对照组,且与体质量、BMISDS、脂肪量呈负相关。肥胖组25(OH)D水平比对照组低约20%,且VDD的发病率更高,其他反映25(OH)D水平的指标在肥胖者中也较低。低血清25(OH)D很可能是肥胖的结果,而不是肥胖的原因。高BMI和肥胖会降低血清25(OH)D水平,补充维生素D对体质量或脂肪量没有影响[10]。肥胖者25(OH)D水平偏低的原因有多种可能,由于饮食摄入量和日光照射减少,导致皮肤维生素D合成受损,从而造成25(OH)D水平偏低。肥胖时25(OH)D与蛋白质结合能力改变或代谢清除加快均可能导致其水平降低,而较低的25(OH)D水平也可能是因为其分布在较大体积的全身组织中,特别是滞留在其他组织中。当暴露在紫外线中时,正常人群和肥胖者的皮肤合成维生素D的能力相似[11]。饮食习惯和阳光暴露时间在不同群体间有所不同,这可能是维生素D水平有所差异的影响因素。
血清维生素D结合蛋白(vitamin D binding protein,VDBP)和白蛋白水平会影响25(OH)D总量的测定,VDBP存在遗传变异,导致VDBP与25(OH)D结合亲和力的差异。然而VDBP和白蛋白在肥胖者和正常人群中没有差异,VDBP基因型在肥胖者和正常人群中的分布相似[12]。肥胖人群的25(OH)D代谢清除率较高,半衰期较短,循环水平较低。使用稳定同位素25(OH)D示踪剂的测量结果显示,肥胖者和正常成年人的代谢清除率相似,因此这不太可能是血清25(OH)D降低的原因。最重要的机制可能是肥胖者更大的组织体积将25(OH)D稀释。25(OH)D主要分布于血清、脂肪、肌肉、肝脏,少量进入其他组织,而这些组织体积在肥胖者中均增加[13]。有研究表明,肥胖组和正常组血清25(OH)D差异在夏季比冬季更大,可能因为在夏季肥胖者血清25(OH)D上升幅度较小[14]。肥胖者得到的阳光暴露与正常人群相似,并产生相似水平的维生素D,但分布在更大的脂肪组织中,因此分配到血清中的量更少。肥胖者和正常人群对口服维生素D剂量的反应也有类似的差异,肥胖者血清25(OH)D上升幅度较小。
这种体积稀释效应的临床意义是肥胖者需要比正常人群摄入更多的维生素D才能达到相同的血清25(OH)D水平,但停止补充后,由于其他组织储存的重新分配,血清25(OH)D的下降可能会较慢,而体质量较低者服用25(OH)D后其水平会有很大上升(因为分布体积较小),但如果停止补充,因为组织储存较少,就会很快再次缺乏维生素D。有学者提出,25(OH)D在脂肪中被保留,补充25(OH)D会提高腹部皮下脂肪中的25(OH)D水平,胰岛素抵抗肥胖者的脂肪细胞可能会抑制25(OH)D的释放[15]。脂肪细胞表达激活25(OH)D的1-羟化酶,也表达失活25(OH)D的24-羟化酶。肥胖时这些酶的活性可能会改变,从而影响25(OH)D释放到血清中的量。然而,肥胖者和正常人群皮下脂肪和网膜脂肪中25(OH)D的分布和水平没有显著差别,肥胖人群皮下脂肪中和血清中25(OH)D的相关性与正常人群相似。
通常,低水平的25(OH)D、游离25(OH)D以及1,25(OH)2D会导致膳食钙吸收率降低,骨转换增加,骨密度降低,且儿童期肥胖对骨骼强度有不利影响。然而,肥胖成年人的骨转换比正常人群更低,骨密度更高,皮质更厚,骨小梁数量更多。维生素D缺乏对骨骼的不良影响表明肥胖者可能并不是真的缺乏25(OH)D,而是因为体积稀释导致血清25(OH)D水平降低,但其全身25(OH)D储存量更大,因为脂肪组织中储存了25(OH)D,保证了血清25(OH)D维持平衡并有足够的供应。另一种解释是,肥胖者缺乏25(OH)D,但肥胖的其他影响抵消了25(OH)D缺乏的影响,如更大的骨骼负荷或瘦素、脂联素、雌激素等激素作用已知对骨量有积极影响。如果肥胖者确实缺乏25(OH)D,则可能会影响骨骼以外的其他系统。VDD与多种疾病有关,如自身免疫性疾病、癌症、神经退行性疾病和代谢综合征等,但目前其具体的致病机制尚不明确[16]。肥胖确实会增加患其中几种疾病的风险,但除了低25(OH)D水平之外,还有其他可能的25(OH)D和肥胖之间的相互作用,在病因上尚无明确的证据[17]。
建议1~18岁人群每日摄入600 U维生素D。4~8岁儿童的日摄入量上限为3 000 U,9~18岁儿童的日摄入量上限为4 000 U。建议肥胖儿童和服用某些药物(如抗癫痫药、抗真菌药、糖皮质激素、抗逆转录病毒药物)的儿童每日至少多摄入2~3倍的维生素D以满足身体需要。鼓励超重和肥胖儿童改变生活方式,从食物中摄入足够的维生素D,以预防VDD[18]。高脂鱼类和牛奶是维生素D的绝佳天然来源。应鼓励儿童增加户外活动,同时限制屏幕使用时间和苏打水或果汁摄入量。补充25(OH)D对肥胖者不良代谢状态的益处尚未得到明确证明,但可能有助于防止此类患者的骨质流失。肥胖者需要比正常人群更高的负荷剂量才能达到相同的血清25(OH)D水平,但由于代谢清除率不受肥胖的影响,维持剂量应是相似的[19]。
利益冲突所有作者均声明不存在利益冲突
