化学概念教学中的教材处理及教法改进
——以初中化学“溶液”单元为例
2021-07-25■缪徐
■ 缪 徐
化学概念是化学课程内容的重要组成部分,是化学知识的“骨架”。化学概念教学,不仅要关注学生化学知识的获取,更要关注他们化学观念的形成、学科思维的培养以及学科素养的提升。然而,在初中化学概念教学中,依然有一些教师不能站在上述高度去审视自身的教学,教材处理保守拘谨,教学方式陈旧单一,有些学校甚至还存在教师抱着教材“讲”概念、学生对着教材“背”概念的现象。为此,笔者在概念教学的教材处理及教法改进上做了一些探索,现以初中化学“溶液”单元中几个概念的教学为例谈一谈个人体会。
一、从宏观走向微观
“宏观辨识与微观探析”体现了化学学科最具特征的认识视角和思维方式,是化学学科五大核心素养之一。因此,虽然“溶液”单元的教学为这一核心素养的落地提供了较多的素材,但是,不同版本的教材编写思路不一,因此教师在教学过程中要注意各种版本教材的融合和教学方式的出新。
对于“溶液”,人教版教材是从宏观角度去定义的:一种或几种物质分散到另一种物质中所形成的均一、稳定的混合物。使用人教版的教师在教学中可以借鉴沪教版等教材中的定义视角及分析思路,结合蔗糖、氯化钠等物质的构成情况,引领学生分析溶液形成的微观过程,启发他们从微观的视角再建溶液概念:一种或几种物质以分子或离子的形式分散到另一种物质中所形成的均一、稳定的混合物。
在此基础上,教师还可以进一步引领学生从宏观、微观两个角度去认识溶解的内涵和溶液的组成等问题。
从宏观的角度认识溶解:①一种或几种物质分散到另一种物质中形成溶液的过程;②如果A 放入B 中能得到均一、稳定的混合物,则A能溶解于B,否则,A 不溶解于B。从微观的角度认识溶解:①一种或几种物质以分子或离子的形式向另一种物质中分散的过程;②将A 放入B中,若A 能以分子或离子的形式向B 中分散,则A溶解于B,否则,A不溶解于B。
从宏观的角度认识溶液的组成:溶液由溶质和溶剂组成。从微观的角度认识溶液的组成:溶液中含有溶质的分子(离子)、溶剂的分子以及水合分子(离子)。沪教版教材里没有涉及物质溶解中的水合过程,使用该版本教材的教师可以根据教学实际加以处理。
显然,从宏观走向微观,实现两种认识视角的对接和打通,有助于学生加深对溶液、溶液组成、溶解等核心概念的认识,有助于提升学生的多重表征能力,促进学生微粒观的形成,为酸、碱、盐知识的学习奠定良好的基础。
二、从定性走向定量
从定性走向定量既是视角的转换,也是认识的进阶。对于溶液的宏观组成从定性(溶质、溶剂)走向定量(溶质质量分数)、溶质溶解能力的描述从定性(易溶、可溶、微溶、难溶)走向定量(溶解度)等教学素材,教师的认识是清晰的,教材处理起来较为得心应手。不过,对于下列教学素材,许多教师关注不够、挖掘不够。
如,从微观的角度可以对酒精溶液的组成做定性描述:酒精分子,水分子,水合酒精分子。也可以做定量描述并设问:酒精的化学式为C2H5OH,已知酒精溶液中酒精分子和水分子的个数比为1:3,求该溶液中溶质的质量分数。通过微观层面的酒精和水的分子个数比1:3,学生能推出宏观层面的酒精和水的质量比为46:54,进而得出酒精溶液中溶质的质量分数为46%。
又如,对结晶的概念,几种版本的教材中都是从定性的角度去建立的,那能不能在定性的基础上引导学生做一番定量分析呢?对此,笔者做了探索性尝试:
20℃时氯化钠的溶解度是36g。现从20℃的氯化钠溶液A(含水110g、氯化钠36g)中恒温蒸发10g水得到溶液B,再从溶液B中恒温蒸发10g水得到溶液C,试分析A→B以及B→C的变化中溶质质量、溶剂质量、溶液质量、溶质质量分数的变化情况(见图1,其中,“-”表示不变,“↑”表示增大,“↓”表示减小,下同)。
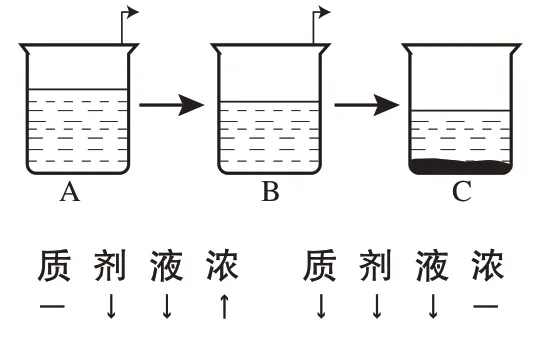
图1 蒸发结晶示意图
60℃时硝酸钾的溶解度是110g,20℃时硝酸钾的溶解度是31.6g。现将70℃的硝酸钾溶液A(含水100g、硝酸钾110g)降温至60℃得到溶液B,再将溶液B 从60℃降温至20℃得到溶液C,试分析A→B 以及B→C 的变化中溶质质量、溶剂质量、溶液质量、溶质质量分数的变化情况(见图2)。

图2 降温结晶示意图
教学实践表明,从定量的角度去建立蒸发结晶、降温结晶的概念,一方面能加深学生对固体溶解度内涵的理解,真正厘清溶液变化过程中多个数据的变化情况;另一方面能让学生真正明白溶质从溶液中析出的原因,厘清结晶方式与溶解度受温度影响程度两者之间的内在联系。
三、从经验走向实证
从探究问题方式多样性的角度看,经验和实证并没有高低之分;从化学学科的特点看,实证更能引发学生的关注;从学科素养的角度看,实证事关学生证据推理能力的培养。因此,在概念教学中很有必要通过一些小实验的增设来培养学生的实证意识以及实证实验的设计能力。
溶液“均一性”的认识是溶液概念教学的重点和难点。十多年前,笔者在省级赛课中采用的是经验法:打开可乐饮料的封口,美美地喝上一口、两口、三口,你会觉得每一口都一样的爽、一样的甜……如今的教学,如果还是采用这种“经验法”就显得有些过时了,因而可以考虑在实证方面做点小文章。如,用密度计放在溶液中的不同部位测定溶液的密度;用电导率传感仪在溶液中的不同部位测定溶液的电导率等。实证的方式帮助学生理解溶液的均一性:溶液各处性质相同,溶质微粒分散均匀。
溶质概念建立之后,教师通常会抛出一个深化认识的问题:将镁条放入一定量的稀盐酸中,恰好完全反应后得到一种无色溶液,该溶液中的溶质是镁、溶剂是稀盐酸,对吗?为什么?解决这个问题,大多数教师运用的是“经验法”,也就是用学过的金属与酸发生反应的知识去解释:镁和稀盐酸反应后的产物是氯化镁和氢气,氢气从溶液中逸出,所得溶液中的溶质是氯化镁。有一位年轻教师跳出了“经验法”的束缚,在解决这一问题时加了一个小小的对比实验:用玻璃棒分别蘸取盐酸试样和所得溶液试样在酒精灯火焰上灼烧,前者没有固体物质留下,后者有白色固体出现。这样的实证小实验,平实之中出神奇,让人耳目一新。
饱和溶液概念中的“对应性”是指:不能溶解某一种溶质,该溶液就称之为这一种溶质的饱和溶液。上述“对应性”的认识也可以通过实证的方式去实现:在硝酸钾饱和溶液中加入1~2 小粒高锰酸钾,发现溶液的颜色变成淡淡的紫红。
四、从单一走向综合
也许是概念理解难度不大、教学素材不够丰富的缘故,在溶质质量分数的教学中,教师教授过程简略、方法单一的现象较为普遍。其实,溶质质量分数的学习,是学生联系生活实际、打通章节壁垒、感悟知识生长的载体,教师要利用这一载体丰富教学方式。
利用概念建立之初的情境创设,加强溶质质量分数与日常生活的联系,如生理盐水瓶的标签上有0.9%的字样,泳池中的硫酸铜含量不能超过0.0001%,这些百分数表示什么意义?通过问题的解决,学生也就明白了溶质质量分数的学习意义。
利用概念的理解内化,从以下两个方面打通章节壁垒,构建知识网络,让学生体会到知识的生长。
一是把溶质质量分数与以前学过的几种分数进行对比。溶质质量分数与空气中氧气的体积分数、水中氧元素的质量分数、海水中氧元素的质量分数、赤铁矿中氧化铁的质量分数等四种分数中的哪个分数最为类似?空气中氧气的体积分数是气态单质在气态混合物中的体积占比,水中氧元素的质量分数是元素在化合物中的质量占比,海水中氧元素的质量分数是元素在混合物中的质量占比,而赤铁矿中氧化铁的质量分数是化合物在混合物中的质量占比。学生通过甄别,很快发现:溶质质量分数和赤铁矿中氧化铁的质量分数最类似。
二是把溶质质量分数与以前学过的比值进行对比。溶质质量分数的实质也是个比值,这一比值和原先学过的溶液中溶质与溶剂的质量比、化合物中各元素的质量比、化合物分子中各原子的个数比有什么不同?一是比向不同,溶质质量分数是“竖向”的比,另外三种比都是“横向”的比;二是溶质质量分数是局部与整体的比,另外三种比都是局部与局部的比;三是溶质质量分数是用百分比表示,另外三种比都是用最简整数比表示。
此外,还可以利用概念的拓展运用,将宏观、微观打通,让定性、定量对接。具体做法见上文第二部分有关酒精溶液的组成认识。
通过“溶液”单元中几个核心概念教学情况的分析,我们看到了概念教学中教材处理以及教法改进的紧迫性、必要性以及可行性。只有不断实践、不断反思、不断改进,概念教学才能寻得突破,化学课堂才能真正成为学生核心素养提升的摇篮。
