溶藻弧菌gr 基因缺失株构建及其生物学特性
2021-07-25冯建儒范晨龙
冯建儒,范晨龙,丁 燏
(广东海洋大学水产学院//广东省水产经济动物病原生物学及流行病学重点实验室//水产经济动物病害防控广东普通高校重点实验室,广东 湛江 524088)
溶藻弧菌(Vibrio alginolyticus)隶属于弧菌科(Vibrionaceae)弧菌属(Vibrio),为嗜盐嗜温性、兼性厌氧的革兰阴性菌[1-2],广泛分布于海洋环境和海洋生物中,可感染鱼、虾、贝等海水养殖动物[3-5]。近年来,随着养殖环境的不断恶化,由溶藻弧菌引起的暴发性弧菌病呈不断上升趋势[6-7],给海水养殖业造成重大的经济损失[8]。
在生物系统中,干旱、低温、高温、盐胁迫、抗生素、重金属和紫外辐射等各种环境胁迫可诱发活性氧(Reactive oxygen species,ROS)的过量产生,对细胞造成严重损伤。生物细胞内的重要氧化剂谷胱甘肽(GSH),可有效抵抗ROS 对细胞的伤害,维持细胞内较稳定的氧化还原平衡状态[9-10]。谷胱甘肽还原酶(Glutathione reductase,GR)是谷胱甘肽抗氧化系统中主要抗氧化酶之一,广泛分布于原核生物和真核生物中[11]。在还原型辅酶NADPH 作用下,GR 催化氧化型谷胱甘肽(GSSG)转化为还原型谷胱甘肽,为有效清除细菌细胞内ROS 提供还原力,从而保护细胞免受伤害,是在氧化应激期间维持细胞氧化还原状态的关键酶[12-13]。因此,GR 在氧化应激[14-15]、冷应激[16]、盐胁迫[17]和金属离子耐受性[12]等应激反应中有重要作用。吕洁婷等[18]研究发现,单核细胞增多性李斯特菌(Listeria monocytogenes)gr 基因缺失后,其运动能力、感染宿主能力及抗氧化应激等增强。庞欢瑛等[19]将与GR 同属于黄素蛋白氧化还原酶家族的二氢硫辛酰胺脱氢酶(DLDH)的dldh 基因敲除后,溶藻弧菌的泳动能力、生物膜形成能力、生长和胞外蛋白酶活性等均减弱。有关溶藻弧菌gr 基因缺失株的生物学特性未见报道。本研究通过同源重组技术和Overlap PCR 等分子生物学手段构建溶藻弧菌gr 基因缺失株,比较其与野生株HY9901 的生物学差异,为防治溶藻弧菌病提供理论依据。
1 材料与方法
1.1 材料
1.1.1菌株 溶藻弧菌HY9901(V.alginolyticus)、大肠杆菌DH5α(Escherichia coli DH5α)、大肠杆菌β2163(E.coli β2163)均保存于广东省水产经济动物病原生物学及流行病学重点实验室(下称“本实验室”)。
1.1.2质粒 自杀质粒pLP12(含氯霉素Cm)取自本实验室。
1.1.3主要试剂和引物 LB 液体培养基,酵母提取物5 g/L、胰蛋白胨10 g/L 及NaCl 30 g/L;LB 固体培养基,酵母提取物5 g/L、胰蛋白胨10 g/L、NaCl 30 g/L 及琼脂粉15 g/L;氯霉素(Cm),生工生物工程(上海)股份有限公司;切胶回收纯化和质粒提取试剂盒,赛默飞世尔科技(中国)有限公司;细菌总DNA 提取试剂盒,北京天根生化科技有限公司;pMD-18T 克隆载体,Takara 公司;药敏纸片,杭州微生物试剂有限公司;PrimerSTAR Max,Takara 公司;引物(表1)由生工生物工程(上海)股份有限公司合成。

表1 溶藻弧菌gr 基因的缺失株构建的引物Table 1 Construction of primers for deletion of gr gene of V.alginolyticus
1.2 方法
1.2.1缺失株△gr 的构建 以gr-MF1/gr-MR1 扩增得 GR 上游同源臂 A 片段 612bp;以gr-MF2/gr-MR2 扩增得GR 下游同源臂B 片段577 bp,纯化A、B 片段,经Overlap PCR 扩增后,获得1 189 bp 融合AB 片段。将纯化的AB 片段与自杀质粒pLP12(Cm+)连接,得重组质粒,然后转化至大肠杆菌DH5α 感受态细胞,涂布于LB 平板(含Cm 20 μg/mL,D-葡萄糖3 g/L)。用pLP-UF/pLP-UR 筛选AB 插入的重组克隆,阳性克隆经纯化、扩大培养后,提取质粒pLP12(Cm+)-gr,转化至大肠杆菌β2163,培养3 h,涂布于LB 平板(含Cm 20 μg/mL,二氨基庚二酸 (Diaminopimelic acid,DAP) 0.3 mmol/L,D-葡萄糖3 g/L),挑取阳性克隆,划线纯化培养。分别将大肠杆菌β2163[pLP12(Cm+)-gr] 与溶藻弧菌培养24 h,分别取400 μL 供体菌和800 μL 受体菌,混匀,离心,去上清,以LB 培养基重悬,重复1 次,滴入LB平板 (含DAP 0.3 mmol/L,D-葡萄糖3 g/L),于37 ℃下倒置培养6 h。以1 mL LB 重悬,稀释后取100 μL 涂布于LB 平板(含Cm 20 μg/mL,D-葡萄糖 3 g/L),挑取单克隆,液体培养,以gr-TF/PLP-UTR 对克隆进行检测。挑取阳性克隆,稀释,涂布于LB 平板(含L-阿拉伯糖4 g/L),于30 ℃下培养24 h,挑取平板上的克隆,以引物gr-TF/gr-TR 进行检测,并递交PCR 产物测序验证,获得△gr 缺失株,稳定遗传 30 代后,置于-80 ℃下保存。以上实验步骤根据表1 设计的对应引物进行菌落PCR 鉴定并测序,反应体系:DNA 模板1 μL,PrimerSTAR Max 10 μL,上下游引物各1 μL,ddH2O 7 μL。扩增程序:98 ℃ 3 min;98 ℃ 10 s,X ℃ 20 s,72 ℃ Y s,72 ℃ 7 min,30 个循环。
1.2.2缺失株△gr 的验证 采用RNA 试剂盒分别提取溶藻弧菌HY9901 野生株和缺失株△gr 的RNA,并反转录为cDNA。以cDNA 作为模板,利用一对特异性引物(gr-F/gr-R)进行PCR 扩增,选取野生株HY9901 作为阳性对照,用10 mg/mL 凝胶电泳检测。
1.2.3缺失株△gr 遗传稳定性的测定 溶藻弧菌缺失株△gr 菌液和新鲜TSB 培养基按体积比1∶100的比例连续传30 代后,用引物gr-TF/gr-TR 对片段进行扩增,检测缺失株△gr 的遗传稳定性。
1.2.4生长曲线绘制 分别将溶藻弧菌野生株HY9901 和缺失株△gr 接种于新鲜TSB 中,培养8 h以上,将光密度D(600 nm) 调至约0.5,以1∶100稀释培养,每2 h 测定波长600 nm 下的光密度值,绘制两株菌的生长曲线。重复3 次。
1.2.5抗生素药敏实验 将200 μL、D(600 nm) 值约为0.5 的菌液涂布于TSB 营养琼脂平板上,放置干燥,以无菌操作将药敏纸片放置于TSB 平板,轻轻按压,贴标签,置于恒温生化培养箱培养24 h 后观察。
1.2.6生物膜的测定 分别用适量新鲜TSB 洗脱在TSA 平板上培养的野生株和缺失株,将菌液D(600 nm) 调至0.5,再分别用新鲜的TSB 稀释20倍,转至96 孔板中,28 ℃下静置24 h;用无菌ddH2O 洗涤3 次,倒置晾干;用甲醇固定20 min,室温晾干,倒置30 min,在室温下加入结晶紫染液染色15 min,用自来水冲洗至澄清后自然晾干;最后加入体积分数95%乙醇,自然放置30 min,用酶标仪测定波长570 nm 下的光密度值。重复3 次。
1.2.7细菌泳动实验 分别挑取野生株和缺失株的单菌落,穿刺接种于3 g/L 的琼脂TSA 平板中,放置于28 ℃恒温培养箱中培养24 h 以上,测量两菌株的泳动圈直径。重复3 次。
1.2.8胞外蛋白酶活性的测定 分别将培养12 h以上的野生株和缺失株涂布于铺有玻璃纸的TSA平板上,放置于28 ℃下培养18 h,加入适量磷酸盐缓冲液(PBS)洗脱,以4 ℃、8 000 g 条件离心30 min,收集上清,用孔径0.22 μm 滤膜过滤,所得野生株和缺失株的胞外蛋白酶产物保存于4 ℃。分别取100 μL 野生株和缺失株的胞外蛋白酶与100 μL 偶氮酪蛋白溶液混合均匀,用Tris-HCl 缓冲液稀释至500 μL,置于37 ℃下孵育30 min。加入适量的100 g/L 三氯乙酸终止反应,以10 000 g 离心10 min,收集上清,加入NaOH 溶液显色,测定在波长442 nm 下的光密度值,以煮沸的灭活样品作为空白对照组。重复3 次。
2 结果
2.1 缺失株△gr 的构建
以引物gr-TF/gr-TR 进行检测,以野生型为对照,突变型经扩增得到1 343 bp 片段,野生型扩增片段长2 648 bp(图1)。经测序,结果证实溶藻弧菌gr 缺失株构建成功。

图1 溶藻弧菌gr 缺失突变检测Fig.1 Detection of gr mutant
2.2 缺失株△gr 的验证
图2(A)表明,已构建的缺失株△gr 经cDNA 验证,提取得到的RNA 完整。以反转录得到的cDNA为模板进行 PCR 扩增验证,结果表明野生株HY9901 在1 400 bp 处左右有特异性条带,其他的不存在条带 [图2(B)],证明已成功构建了溶藻弧菌HY9901 的缺失株△gr。

图2 缺失株△gr 的验证Fig.2 Verification of mutant strain △gr
2.3 缺失株△gr 遗传稳定性
图3 表明,缺失株△gr 经连续传30 代后,仍可准确扩增出gr 基因上下游融合片段,表明所构建缺失株△gr 的遗传信息可在子代中稳定地传递。
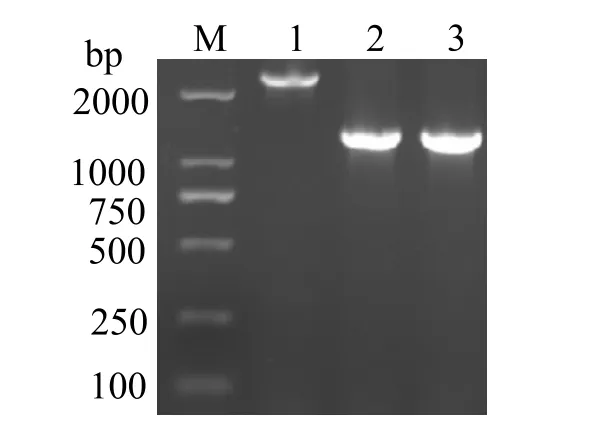
图3 溶藻弧菌缺失株△gr 稳定性检验Fig.3 Hereditary stability of mutant strain △gr
2.4 生长曲线
在 TSB 培养基中培养的溶藻弧菌野生株HY9901 和缺失株△gr 所得到的生长曲线见图4。图4 可见,缺失株△gr 生长情况与HY9901 一致,即敲除gr 基因对溶藻弧菌生长无明显影响。

图4 溶藻弧菌野生株HY9901 和缺失株△gr 的生长曲线Fig.4 Growth curve of strain HY9901and △gr
2.5 药敏实验
溶藻弧菌缺失株△gr 对四环素、克林霉素和呋喃唑酮等药敏实验结果如表2 所示。表2 可见,缺失株△gr 对四环素、克林霉素和呋喃唑酮等耐药性减弱。

表2 药敏实验抑菌圈直径Table 2 Diameters of bacterial inhibition zone in drug sensitive tests
2.6 生物膜
图5 可见,培养24 h 的野生株和缺失株的生物膜形成能力差异显著(P<0.05),与野生株相比,缺失株△gr 的生物膜显著增厚。

图5 溶藻弧菌野生株HY9901和缺失株△gr生物膜形成能力Fig.5 Biofilm formation of strain HY9901and △gr
2.7 泳动能力
培养12 h 后野生株和缺失株的泳动能力如图6所示。结果表明gr 基因的缺失显著减弱了溶藻弧菌的泳动能力(P<0.01)。

图6 溶藻弧菌野生株HY9901 和缺失株△gr 的泳动能力Fig.6 The swarming motility of strain HY9901 and △gr
2.8 胞外蛋白酶活性
胞外蛋白酶作为细菌释放于环境中的代谢物,包含有酪蛋白酶、溶血素、明胶酶、淀粉酶和铁载体等多种活性物质,是致病菌的主要毒力因子之一。与野生株相比,缺失株△gr 的胞外蛋白酶活性显著降低(P<0.01)(图7)。

图7 溶藻弧菌野生株HY9901和缺失株△gr胞外蛋白酶活性Fig.7 ECPase activity of strain HY9901 and △gr
3 讨论
在生物体氧化还原代谢的过程中,GR 为一种极其重要的抗氧化酶,对清除细胞内ROS,维持细胞内稳定的氧化还原状态有重要作用[20]。学界正不断深入研究GR 在生物体发育、疾病防御、抗非生物胁迫及氧化应激等方面的作用。
为更好了解gr 基因在溶藻弧菌抗氧化中的作用,本研究敲除溶藻弧菌gr 基因,缺失株△gr 遗传信息可在子代中稳定地传递。与野生株相比,缺失株△gr 的生长趋势变化不大,这可能是因为gr 基因的缺失对其摄取与消化营养物质几无影响,也可能因为二菌株受环境胁迫较少。
抗生素可抑制细菌生长繁殖或杀死细菌,多由细菌自身合成的化学物质,可杀死周围环境的其他微生物来维持细菌体内平衡[21],通过阻碍细菌细胞壁合成、增强细菌细胞膜通透性、抑制蛋白质合成、阻碍细菌DNA 复制和转录而发挥抗菌作用。目前,使用抗生素仍是控制弧菌病的主要手段,但滥用抗生素会导致耐药菌的出现[22-26]。研究表明,抗生素刺激细菌会产生氧化应激,使细胞内产生大量的活性氧和自由基,破坏细胞内的氧化还原平衡,引起细胞的损伤[27-28]。因此,本研究中,溶藻弧菌在敲除gr 基因后,其对四环素、克林霉素和呋喃唑酮等敏感性提高,可能由缺失株的清除活性氧能力减弱所致。
生物膜的形成是微生物之间通过协同作用形成的一种生存策略[29],也是微生物适应复杂多变的生存环境和抵御不良环境因素的重要手段[30-32]。研究表明,肺炎克雷伯菌(Klebsiella pneumoniae)的生物膜形成与活性氧(ROS)的增加相关[33]。本研究中,缺失株△gr 的生物膜出现增厚现象,推测溶藻弧菌在敲除gr 基因后,细菌内的氧化应激水平提高,使生物膜形成得以进一步增强,从而抵御不良的环境因素。
鞭毛是细菌表面重要的附属结构,对其泳动能力有直接影响[34-35]。本研究中,与野生株相比,缺失株△gr 的泳动能力显著减弱,推测gr 基因的缺失可能对鞭毛的产生或运动造成一定的影响,进而减弱缺失株的泳动能力,但泳动能力变化机制还需进一步研究。
细菌的毒力因子与其致病性有紧密的关系,胞外蛋白酶是细菌主要的毒力因子,不仅通过消化为细菌的生长供应必要的营养物质,还可直接对宿主的免疫防御系统造成破坏[36]。本研究中,gr 基因的缺失使溶藻弧菌的胞外蛋白酶活性显著降低,缺失株△gr 毒力可能减弱,推测gr 基因可能在其胞外蛋白酶的分泌或活性等方面有一定作用。
4 结论
本研究成功构建gr 基因缺失株△gr。与溶藻弧菌野生株HY9901 比较,该缺失株对四环素、克林霉素和呋喃唑酮等耐药性减弱,生物膜形成能力显著增强,胞外蛋白酶活性显著降低,泳动能力显著减弱。因此,GR 在溶藻弧菌的毒力、生物膜形成、药物敏感性、泳动等方面有重要作用。
