PPARγ/UCP2在甲醛致学习记忆障碍中的作用
2021-07-23郑丽芳萧嘉莉袁佩昕陈泊岐池煜瑶
郑丽芳,萧嘉莉,袁佩昕,陈泊岐,梅 琼,池煜瑶,吕 柯,李 睿
PPARγ/UCP2在甲醛致学习记忆障碍中的作用
郑丽芳,萧嘉莉,袁佩昕,陈泊岐,梅 琼,池煜瑶,吕 柯,李 睿*
(华中师范大学生命科学学院,遗传调控与整合生物学湖北省重点实验室,湖北 武汉 430079)
为探究过氧化物酶体增殖物激活受体γ/解偶联蛋白2(PPARγ/UCP2)在甲醛(FA)诱导的学习记忆障碍中的作用,本文将C57BL/6小鼠随机分为:对照组、T0070907组(抑制剂组)、3mg/m³ FA组、3mg/m³ FA+T0070907组,进行连续21d的实验暴露,在第22d取脑组织测定脑组织脏体比并匀浆,检测活性氧(ROS)、谷胱甘肽(GSH)、丙二醛(MDA)、核因子κB()、白细胞介素6(IL-6)、PPARγ、UCP2等生化指标,通过Nissl染色观察脑组织的病理学变化.结果发现,与对照组相比,T0070907组和3mg/m³ FA组小鼠大脑皮层神经元受损,GSH含量下降,ROS、MDA、、IL-6含量有所上升,而3mg/m³ FA+T0070907组小鼠上述现象更严重.此外,与对照组相比,T0070907组小鼠脑组织中的PPARγ和UCP2含量下降,但3mg/m³ FA组小鼠脑组织中的PPARγ和UCP2含量上升;与3mg/m³ FA组相比,加入抑制剂的3mg/m³ FA+T0070907组小鼠脑组织中的PPARγ和UCP2含量下降.研究结果表明,在加入PPARγ抑制剂后,PPARγ/UCP2含量下降,加重了FA所致小鼠的学习记忆障碍,故PPARγ/UCP2在FA致学习记忆障碍中可能起保护作用.
甲醛;记忆功能;氧化损伤;炎症
甲醛(FA)是一种常见的室内空气污染物,作为全球最大的FA生产与消费国,我国所面临的FA污染形势严峻[1].调查显示,在家具木材厂、服装皮革厂以及大部分医院取材室工作的人员可长期暴露在浓度高达1.31~6.25mg/m³的FA中[2-4].研究表明,中枢神经系统是受到FA影响的重要系统之一[5].FA可导致脑部氧化应激反应,甚至会增加诸如阿尔茨海默症、帕金森等神经性疾病的发病几率[6],受到人们的广泛关注.流行病学数据显示,长期接触高水平FA的组织学技术人员和工作人员会出现行为和神经症状[7].动物实验研究发现,FA对小鼠具有神经毒性,能降低小鼠的学习记忆能力,导致脑组织发生病理损伤[8].
解偶联蛋白家族(UCPs)是一类位于线粒体内膜的载体蛋白,可以通过引起质子泄漏来解偶联线粒体呼吸产生的ATP,也可以参与能量平衡的调节,在维持线粒体功能方面具有重要作用.其中,解偶联蛋白2(UCP2)可在大脑、皮肤、肝脏、肾脏等器官和组织中表达[9].有研究表明,氰化物诱导的氧化应激可导致脑中UCP2的激活和上调[9].此外,UCP2可参与神经元活动的调节,并且可通过抑制活性氧(ROS)的生成和参与ROS的清除缓解线粒体功能障碍,预防脑外伤后神经元凋亡,减少脑功能障碍的发生[10].UCP2是过氧化物酶体增殖物激活受体γ(PPARγ)的下游靶基因,PPARγ是调节目标基因表达的核内受体转录因子超家族成员之一,可调节下游UCP2的表达[11]. T0070907为PPARγ有效的特异性抑制剂,其可通过影响PPARγ中配体结合的第12螺旋区域结构来调节PPARγ及其下游基因的表达[12].
目前,对PPARγ/UCP2的研究多集中在肝脏、心血管、胃、肥胖、糖尿病等方面,但对于PPARγ/UCP2在学习记忆障碍发生发展中的作用研究较少.本实验探究PPARγ/UCP2在FA诱导的学习记忆障碍中的作用,旨在为确定相关的药物治疗靶点提供参考,为探究缓解FA所致神经毒性的方法提供参考.同时,由于线粒体相关蛋白是细胞进行正常生命活动的重要成分,本实验研究结果可能为线粒体蛋白的更多相关疾病发生发展提供参考,为其他疾病的研究打下基础.
1 材料与方法
1.1 实验动物
采用SPF级(无特定病原体动物)雄性C57BL/6小鼠(5~6周龄,(19±2) g),购于湖北省疾病预防控制中心.购置的小鼠在华中师范大学生命科学学院SPF级实验动物中心继续饲养1周,饲养环境为标准的屏障环境,温度设定为20~25℃,相对湿度维持在50%~60%,光暗循环周期为12h.
1.2 主要实验试剂与仪器
福尔马林(10%, Sigma);2’,7’-二氯荧光黄双乙酸盐(DCFH-DA荧光染料,纯度³99.9%, Sigma);谷胱甘肽(GSH)试剂盒(南京建成生物工程研究所);小鼠白细胞介素6(IL-6)酶联免疫吸附(ELISA)试剂盒(Bio-Swamp);PPARγ抑制剂T0070907(MCE);小型环境智能气候舱(WH-2, 武汉宇信);甲醛测定仪(MEF50型,思乐智);全波长酶标仪(DNM-9602).
1.3 实验方法
将实验小鼠随机分为4组,分别为:A:(对照组), B:(T0070907组), C:(3mg/m³ FA组), D:(3mg/m³ FA+T0070907组).FA暴露采用动态吸入式染毒(3mg/m3,8h/d).T0070907:先加入DMSO对T0070907粉末进行促溶,然后加入所需体积的生理盐水配置成0.1mg/mL的T0070907溶液,采用腹腔注射处理(1mg/(kg×d)).
Morris水迷宫主要应用于啮齿类动物学习和记忆能力的研究.本实验参照Lu等[13]实验中的方法进行Morris水迷宫实验,由Smart 3.0软件收集数据.染毒第15~19d为定向航行实验;第20d只暴露,作为小鼠遗忘期;第21d进行空间探索实验以检测小鼠的记忆能力.
1.4 检测方法
在各处理第22d颈椎脱臼法处死小鼠,取出脑组织,漂洗干净,脱水,加入磷酸盐缓冲液(PBS)后研磨,制备成10%的组织匀浆液,离心,取上清,分装,冷冻于-80 ℃冰箱中储存备用.
1.4.1 小鼠脑组织病理学检测 取脑组织,漂洗干净后,固定过夜,脱水,透明,包埋,切片,粘片,脱蜡,然后进行Nissl染色,再脱水,透明和封片,最后在显微镜下观察、采集图片.
1.4.2 生物指标测定 采用DCFH-DA法检测活性氧(ROS)含量,具体操作为:脑匀浆稀释25倍后,加入酶标板中与0.2μmol/LDCFH-DA荧光染料避光孵育,放入酶标仪在485nm激发光,525nm发射光的条件下测定荧光强度.采用硫代巴比妥酸(TBA)法检测丙二醛(MDA)含量,具体操作为:脑匀浆加入0.6% TBA溶液后沸水浴,离心,取上清液于酶标板中,放入酶标仪在450,532和600nm波长下测定吸光度.采用谷胱甘肽(GSH)试剂盒检测脑组织中GSH含量.采用ELISA法检测白细胞介素6(IL-6)含量,具体方法参照说明书.
1.4.3 荧光定量PCR 采用TRIzol法提取0.1g脑组织中的RNA,之后用HiScript Ⅱ Q RT SuperMix for qPCR(Vazyme)试剂盒进行逆转录得到cDNA.最后用ChamQ SYBR qPCR Master Mix(Vazyme)试剂盒并按照其程序进行qPCR检测-κB和-(内参)基因的表达,基因的引物设计如表1所示.

表1 引物序列
1.4.4 免疫组化检测 采用免疫组化法检测PPARγ、UCP2的蛋白表达量.将石蜡切片去石蜡并水化,用0.3%过氧化氢孵育并用适当的正常血清封闭.使用抗RRARγ和抗UCP2作为一抗,然后加入二抗和显色剂二氨基联苯胺(DAB),进行复染、脱水、透明、封片,阴性对照不加入一抗.镜下观察、拍照,使用Image-Pro Plus 6.0软件获得平均光密度.
1.5 统计学方法
结果以平均值±标准差(Mean±SD)表示,用Origin 8.5软件分析实验数据并生成统计图.水迷宫定向航行实验数据采用重复测量的方差分析,随后采用T检验做两两比较.其他数据采用单因素方差分析,随后采用T检验多重比较检验组间均值的差异显著性,显著水平定为<0.05.
2 结果分析
2.1 Morris水迷宫实验
如图1(a)和1(b)所示,与对照组相比,T0070907组小鼠和3mg/m3FA组小鼠的平均潜逃时间增加,潜逃时间变化减慢.与3mg/m3FA组相比,3mg/m3FA+T0070907组小鼠平均潜逃时间增加,潜逃时间变化减慢.
图1(c)表示小鼠在第21d空间探索实验中的游泳路径,显示出对照组小鼠游泳路径集中在原平台所在象限(即NW象限),具有方向性和目的性.而T0070907组和3mg/m3FA组小鼠游泳路径没有目的性,且缺乏规律性;与3mg/m3FA组小鼠游泳路径相比,3mg/m3FA+T0070907组小鼠游泳路径更加杂乱.

(c) 第21d游泳轨迹
图1 小鼠水迷宫实验结果
Fig.1 Results of the water maze test of mice
2.2 脑组织病理学检测
如图2所示,FA暴露对小鼠脑组织海马区产生了一定的影响.对照组小鼠脑组织海马CA3区神经元细胞数目多,形态结构清晰,排列整齐.而T0070907组和3mg/m3FA组小鼠脑组织海马CA3区神经元受到不同程度的损伤,其细胞数目减少,形态发生变化且排列杂乱.与3mg/m3FA组相比, 3mg/m3FA+T0070907组小鼠脑组织海马CA3区受损更为严重.

图2 各组小鼠脑组织Nissl染色
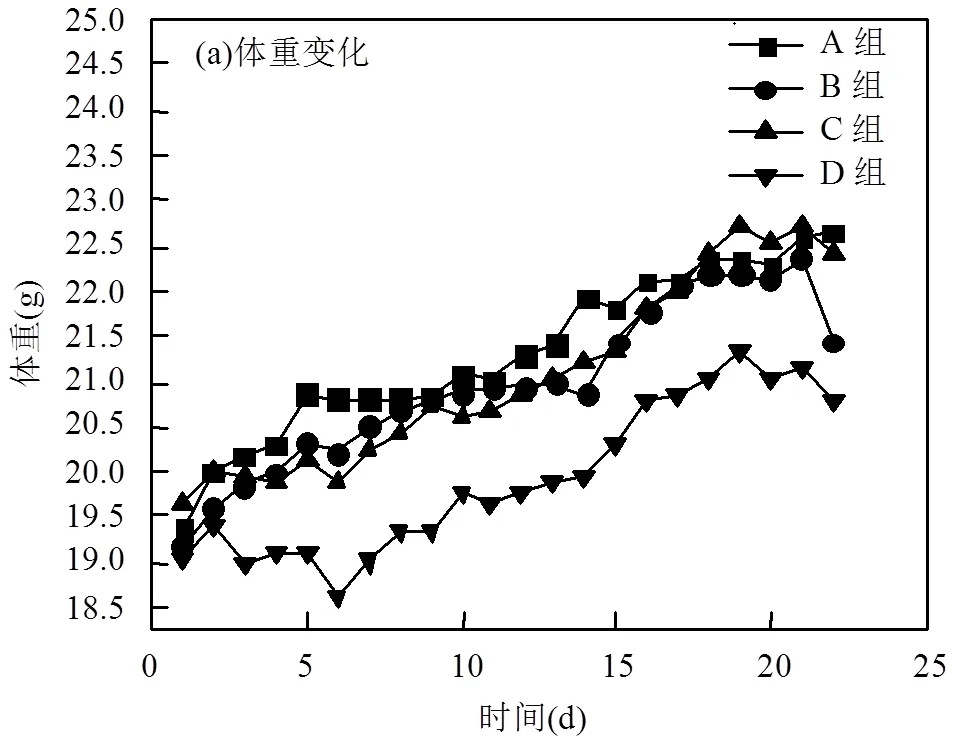
2.3 小鼠体重变化及脑组织脏体比变化
如图3(a)所示,小鼠每天自由进食和饮水,体重逐渐增加.与对照组相比,T0070907组小鼠和3mg/ m3FA组小鼠体重增量较少,3mg/m3FA+ T0070907组小鼠体重增量更少.与3mg/m³ FA组小鼠相比, 3mg/m3FA+T0070907组小鼠体重增量减少.
脏体比又称脏器系数,是动物某脏器的质量与其体重的比值.如图3(b)所示,与对照组相比, T0070907组和3mg/m3FA组小鼠脑组织脏体比增加,无统计学意义;3mg/m3FA+T0070907组小鼠脑组织脏体比增加,具有极显著统计学意义(<0.01).与3mg/m³ FA组相比,3mg/m3FA+T0070907组小鼠脑组织脏体比增加,具有显著统计学意义(< 0.05).
2.4 脑部氧化损伤指标检测结果
2.4.1 ROS水平 ROS为活性氧自由基,过量的自由基将会对机体造成损伤.如图4(a)所示,与对照组相比,T0070907组和3mg/m3FA组小鼠ROS含量升高,差异极其显著(<0.0001).与3mg/m3FA组相比, 3mg/m3FA+T0070907组ROS含量升高,具有显著统计学意义(<0.05).
2.4.2 MDA含量 生物体内,自由基作用于脂质发生过氧化反应,氧化终产物为MDA,会引起蛋白质、核酸等生物大分子的交联聚合造成损伤.如图4(b)所示,与对照组相比,T0070907组和3mg/m3FA组小鼠MDA含量上升,无统计学意义;3mg/m3FA+ T0070907组MDA含量升高,具有显著统计学意义(<0.05).与3mg/m3FA组相比,3mg/m3FA+ T0070907组MDA含量升高,无统计学意义.
2.4.3 GSH含量 GSH能帮助保持正常的免疫系统功能,并具有抗氧化、整合解毒等作用.如图4(c)所示,与对照组相比,3mg/m3FA组GSH含量降低,无统计学意义;3mg/m3FA+T0070907组GSH含量降低,具有极显著统计学意义(<0.01).与3mg/m3FA组相比,3mg/m3FA+T0070907组GSH含量降低,具有极显著差异(<0.01).
** :<0. 01,与A组相比;&:<0.05,与C组相比
2.5 脑部炎症相关因子
2.5.1基因表达水平参与细胞对外界刺激的响应,在细胞的炎症反应、免疫应答等过程中起到关键性作用.的错误调节会引发自身免疫病、慢性炎症以及很多癌症.如图5(a)所示,与对照组相比,T0070907组小鼠脑组织中水平下降,3mg/m3FA组小鼠脑组织中水平上升,无统计学意义.与3mg/m3FA组相比,3mg/ m3FA+T0070907组小鼠脑组织含量上升,无统计学意义.

* :<0.05,**:<0.01,****:<0.0001,与A组相比;&:<0.05, &&:<0.01,与C组相比

*<0.05,**<0.01,与A组相比
2.5.2 IL-6含量 IL-6是一种生物学活性非常广泛的细胞因子,机体有炎症时,IL-6升高.如图5(b)所示,与对照组相比,T0070907组和3mg/m3FA组IL-6含量上升,具有显著统计学意义(<0.05或<0.01),与3mg/m3FA组相比,3mg/m3FA+T0070907组IL-6含量上升,无统计学意义.
2.6 PPARγ和UCP2含量
2.6.1和基因表达量 如图6(a)所示,与对照组相比,T0070907组小鼠脑组织中基因表达量有所下降,而3mg/m3FA组小鼠脑组织中基因表达量有所上升,无统计学意义.与3mg/m3FA组相比,3mg/m3FA+ T0070907组小鼠脑组织中的基因表达量下降,无统计学意义.如图6(b)所示,与对照组相比,T0070907组小鼠脑组织中基因表达量下降,3mg/m3FA组小鼠脑组织中基因表达量上升,具有显著统计学意义(<0.05).与3mg/m3FA组相比,3mg/m3FA+ T0070907组小鼠脑组织中的基因表达量下降,具有显著统计学意义(<0.05).
2.6.2 PPARγ和UCP2蛋白表达量 如图7所示,与对照组相比,T0070907组小鼠脑组织海马区PPARγ(图7(a)和7(b))和UCP2(图7(c)和7(d))蛋白水平下降,具有极显著统计学差异(< 0.0001).而3mg/m3FA组小鼠脑组织海马区中PPARγ(图7(a)和7(b))和UCP2(图7(c)和7(d))蛋白水平上升,具有极显著统计学差异(<0.0001).与3mg/m3FA组相比,3mg/m3FA+T0070907组小鼠脑组织海马区PPARγ(图7(a)和7(b))和UCP2(图7(c)和7(d))蛋白水平明显下降,差异性极其显著(<0.0001).

图6 各组小鼠脑组织PPARγ和UCP2qPCR结果
*<0.05,与A组相比; &:<0.05,与C组相比

图7 各组小鼠海马区PPARγ和UCP2 免疫组化结果
****<0.0001,与A组相比; &&&&:<0.0001,与C组相比
3 讨论
对于FA职业暴露人员,其所接触的FA大部分以吸入方式为主[14],故本实验使用WH-2小型智能环境气候舱以气态暴露吸入式对小鼠进行浓度为3mg/m3FA暴露,此浓度较符合职业场所现实暴露情况[15-16].有研究表明,1周的老鼠寿命大约相当于人1年的生命[17],故本实验模拟职业人员暴露于高水平FA长达3年时间.
3.1 FA对小鼠学习记忆能力的影响
Morris水迷宫实验可以通过定向航行和空间探索实验观察实验动物的学习情况,客观地反映其学习记忆能力.海马在脑内担当着关于记忆以及空间定位的作用.Huang等[18]研究发现FA可导致小鼠海马组织受损,学习记忆能力下降.本研究表明,与对照组相比,3mg/m3FA组小鼠在前5d的定向航行实验中,平均逃逸时间增加,游泳路径大多无目的性且不规则,表明其学习记忆能力下降.病理学检测结果表明,3mg/m3FA组小鼠脑组织海马CA3区神经元受到损伤,其细胞数目减少,排列杂乱,尼氏体数目减少.因此,3mg/m3FA暴露导致的小鼠学习记忆能力下降可能与其引起的海马组织受损有关.
3.2 FA对小鼠脑组织的氧化损伤和炎症反应
有研究表明神经功能缺失后,脑组织脏体比和脑含水量明显上升[19],说明脑组织脏体比可以在一定程度上反映脑部损伤程度.本实验中的3mg/m3FA组小鼠脑部发生水肿,从而导致脑组织脏体比上升,说明FA染毒使小鼠脑部受到了一定的损伤.
FA可以通过增加机体内自由基和脂质过氧化,导致脂质过氧化产物MDA含量的增加,从而降低机体不同器官中的超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶及GSH的含量[20].鲁娴娴等[21]研究表明,使用FA单独染毒哮喘小鼠,可致小鼠肺部MDA水平显著升高(<0.001).安洁然等[22]的研究表明,对Balb/c小鼠进行FA的染毒,可以使小鼠肝脏和肾脏的ROS、MDA含量上升、GSH含量下降,出现显著性差异(<0.05或<0.01).本研究数据表明, 3mg/m3FA暴露可以使小鼠脑组织中的ROS含量增加,可见高浓度、长时间的FA暴露可以加重小鼠脑组织的氧化应激水平,促进ROS代谢反应的进行,从而对细胞内的大分子物质进行破坏.3mg/m3FA暴露的小鼠MDA的含量也有所增加,可见FA的暴露使机体脂质过氧化产物增多,机体的抗氧化能力降低,从而造成细胞的氧化性损伤.而GSH检测结果呈现出3mg/m3FA暴露的小鼠GSH含量下降的趋势,因此GSH在小鼠机体中消耗巨大,细胞的抗氧化能力降低.以上结果与陆林洁等[23]研究发现结果一致,FA可以导致小鼠脑部产生氧化损伤.
此外,FA可以引起中枢神经系统(CNS)的严重损伤,导致脑部炎症.Sorg等[24]研究发现,经FA连续暴露的大鼠脑部出现炎症,且最终导致了中枢神经系统的电路敏感.本实验表明,3mg/m3FA暴露可以使小鼠脑组织中的和IL-6含量增加,表明小鼠的脑组织出现了炎症反应.这同样与陆林洁等[23]研究发现结果一致.由此可见,FA的暴露可以介导炎症反应,从而对小鼠的脑组织产生损伤.
3.3 PPARγ/UCP2的作用
目前,关于PPARγ/UCP2的研究多集中在其参与调节脂肪细胞增殖分化、脂质代谢等多种生理过程,但其在中枢神经系统中也有表达,可参与神经系统疾病的发生发展过程[25-26].本研究发现,PPARγ/ UCP2在小鼠脑组织中有所表达,参与FA致小鼠学习记忆障碍的过程.
当细胞或生物体受到外界刺激后,可上调PPARγ/UCP2的表达[27],如全氟辛烷磺酸可上调大鼠胚胎神经干细胞中PPARγ/UCP2的表达,同样发现在产前暴露于全氟辛烷磺酸后的小鼠新生儿大脑中也检测到PPARγ和UCPs基因的表达明显升高[28].本研究发现,经FA暴露后的3mg/m³ FA组小鼠脑中PPARγ和UCP2的表达均上调.此外,PPARγ途径是一条氧化应激—敏感通路,ROS可通过激活MCF-7细胞的PPARγ信号途径,引起细胞增殖调控相关基因的蛋白表达水平发生明显变化[29];谷氨酸损伤也可引起神经元PPARγ的表达增加,该作用可能是与氧化应激有关的一种神经元自我保护性反应[30].同样,氟化钠、纳米ZnO也可通过氧化应激上调UCP2的表达,产生应激反应[31-32].在本研究中,与对照组相比,3mg/m³ FA组小鼠脑中ROS含量和PPARγ/UCP2含量均上升,推测可能的机制是小鼠脑组织在受到FA刺激后氧化应激水平上升,进而激活了PPARγ/UCP2的表达,以保护FA所致脑损伤和学习记忆功能障碍(图8).

图8 PPARγ/UCP2保护FA致学习记忆障碍的潜在机制
T0070907为PPARγ的特异性抑制剂,可通过抑制PPARγ的表达从而抑制其对下游靶基因的调节[33],造成脑组织损伤的加重[34].Li等[35]研究表明,当PPARγ的表达被抑制后可加重HgCl2造成的肾毒性.本研究结果显示,相较于3mg/m³ FA组,3mg/m³ FA+T0070907组小鼠脑组织中PPARγ/UCP2表达量下降,小鼠脑组织氧化应激水平升高,脑部炎症加重,学习记忆障碍更加严重.因此,使用PPARγ抑制剂T0070907后可加重FA致小鼠学习记忆功能障碍和脑部损伤反应,这符合Huang等[10]的研究结果.即PPARg/UCP2在FA致学习记忆功能障碍中可能被上调,起应激保护作用.
4 结语
综上所述,本研究表明浓度为3mg/m3的FA会造成小鼠学习记忆功能障碍,且小鼠脑部产生的氧化应激可能会上调PPARγ/UCP2的表达;抑制PPARγ/UCP2可加重FA致小鼠学习记忆功能障碍,故PPARγ/UCP2在FA致学习记忆障碍中可能起应激保护作用,其可作为线粒体功能障碍的治疗靶点缓解神经毒性,但相关作用机制仍需进一步探索.
[1] Tang X, Bai Y, Duong A, et al. Formaldehyde in China: Production, consumption, exposure levels, and health effects [J]. Environment International, 2009,35(8):1210-1224.
[2] Zhang L, Steinmaus C, Eastmond A, et al. Formaldehyde exposure and leukemia: A new meta-analysis and potential mechanisms [J]. Mutation Research/reviews in Mutation Research, 2009,681(2/3): 150-168.
[3] 韩华忠.甲醛暴露对职业工人外周血淋巴细胞微核率影响的研究 [D]. 上海:复旦大学, 2012.
Han H Z.Study on the effect of Formaldehyde exposure on the micronucleus formation in peripheral blood lymphocytes in professional workers [D]. Shanghai:Fudan University, 2012.
[4] 史利克,刘 燕,王世博,等.病理科室内甲醛浓度的实时监测分析 [J]. 化学工程与技术, 2018,8(1): 37-40.
Shi L K, Liu Y, Wang S B, et al.The analysis of Formaldehyde real-Time monitoring results in the Pathology Department [J]. Hans Journal of Chemical Engineering and Technology, 2018,8(1):37-40.
[5] Takigawa T, Horike T, Ohashi Y, et al.. Were volatile organic compounds the inducing factors for subjective symptoms of employees working in newly constructed hospitals? [J]. Environmental Toxicology, 2010,19(4):280-290.
[6] Liu X , Zhang Y , Wu R, et al. Acute formaldehyde exposure induced early Alzheimer-like changes in mouse brain [J]. Toxicol Mech Methods, 2018,28(2):95-104.
[7] Kilburn, Kaye H. Neurobehavioral Impairment and Seizures from Formaldehyde [J]. Archives of Environmental Health: An International Journal, 1994,49(1):37-44.
[8] 王小玲.甲醛对小鼠中枢神经系统毒性的研究[D]. 山西:山西医科大学, 2008.
Wang X L. Study on the toxicity of formaldehyde to the central nervous system of mice [D]. Shanxi: Shanxi Medical University, 2008.
[9] Bhatt R, Singh P, John J, et al. Oxidative damage mediated iNOS and UCP-2upregulation in rat brain after sub-acute cyanide exposure: dose and time-dependent effects [J]. Drug & Chemical Toxicology, 2019,42(6):577-584.
[10] Huang J, Liu W, Doycheva D, et al. Ghrelin attenuates oxidative stress and neuronal apoptosis via GHSR-1α/AMPK/Sirt1/PGC-1α/UCP- 2pathway in a rat model of neonatal HIE [J]. Free Radical Biology and Medicine, 2019,141:322-337.
[11] Almanza J, Alarcon F, Blancas G, et al. Glycine regulates inflammatory markers modifying the energetic balance through PPAR and UCP-2 [J]. Biomedicine and Pharmacotherapy, 2010,64(8):534- 540.
[12] 孙月丽,吴明玮,曾昭蕾,等.PPAR-γ抑制剂T0070907对人鼻咽癌细胞的生长抑制作用[J]. 中山大学学报(医学科学版), 2010,31(3): 343-349.
Sun Y L, Wu M W, Zeng Z L, et al. Growth inhibition of a selective PPAR-γ inhibitor, T0070907, in Nasopharyngeal Carcinoma Cells [J]. Journal of Sun Yat-sen University (Medical Science Edition), 2010, 31(3):343-349.
[13] 路 雨,李 瑶,胡赢丹,等.邻苯二甲酸二异癸酯对小鼠学习记忆的影响[J]. 中国环境科学, 2018,38(1):361-368.
Lu Y, Li Y, Hu Y D, et al.Effects of Di-iso-decyl phthalate on the learning-memory ability in mice [J]. China Environmental Science, 2018,38(1):361-368.
[14] Mahboubi A, Koushik A, Siemiatycki J, et al. Assessment of the effect of occupational exposure to formaldehyde on the risk of lung cancer in two Canadian population-based case-control studies [J]. Scandinavian journal of workEnvironment & Health, 2013,39(4):401-410.
[15] Zhang L, Freeman L, Nakamura J, et al. Formaldehyde and leukemia: epidemiology, potential mechanisms, and implications for risk assessment [J]. Environmental & Molecular Mutagenesis, 2010,51(3): 181-191.
[16] Ye X, Ji Z, Wei C, et al. Inhaled formaldehyde induces DNA-protein crosslinks and oxidative stress in bone marrow and other distant organs of exposed mice [J]. Environmental and Molecular Mutagenesis, 2013,54(9):705-718.
[17] Diaz R. Minireview: translational animal models of human menopause: challenges and emerging opportunities [J]. Endocrinology, 2012, 153(8):3571-3578.
[18] Huang J, Lu Y, Zhang B, et al. Antagonistic effect of epigallocatechin- 3-gallate on neurotoxicity induced by formaldehyde [J]. Toxicology, 2019,412:29-36.
[19] 李小琼,詹 剑,冯赞杰,等.金钗石斛多糖减轻大鼠脑缺血再灌注损伤[J]. 中成药, 2017,39(4):677-683.
Li X Q, Zhan J, Feng Z J, et al. Dendrobium nobile polysaccharides reduce cerebral ischemia reperfusion injury in rats [J]. Chinese Traditional Patent Medicine, 2017,39(4):677-683.
[20] 乔晓婷. 乳化剂吐温80对C57BL/6J小鼠毒性损伤作用[D]. 湖北:武汉轻工大学, 2016.
Qiao X T. Toxic damage of emulsifier Tween 80 on C57BL/6J mice [D]. Hubei: Wuhan Polytechnic University, 2016.
[21] 鲁娴娴,黄佳伟,崔海燕,等.低浓度甲醛和PM2.5联合暴露对哮喘小鼠的影响[J]. 中国环境科学, 2020,40(3):1335-1344.
Lu X X, Huang J W, Cui H Y, et al. The effect of combined exposure of low concentration formaldehyde and PM2.5on asthma model mice [J]. China Environmental Science, 2020,40(3):1335-1344.
[22] 安洁然,江清英,李福宏,等.诱导型Hsp70在外源性甲醛对小鼠肝肾氧化损伤中的保护作用[J]. 生态毒理学报, 2019,14(2):222-230.
An J R, Jiang Q Y, Li F H, et al. Inducible Hsp70 Protected liver and kidney of mice from the oxidation damage induced by exogenous formaldehyde [J]. Asian Journal of Ecotoxicolog, 2019,14(2):222-230.
[23] 陆林洁,蔡 洁,安洁然,等.甲醛与DEHP联合染毒对小鼠学习记忆能力的影响 [J]. 中国环境科学, 2017,37(12):4751-4762.
Lu L J, Cai J, An J R, et al.Joint toxic effect of formaldehyde and DEHP on learning and memory of mice [J]. China Environmental Science, 2017,37(12):4751-4762.
[24] Sorg B, Tschirgi M, Swindell S, et al. Repeated Formaldehyde Effects in an Animal Model for Multiple Chemical Sensitivity [J]. Annals of the New York Academy of Sciences, 2010,933:57-67.
[25] 曹杉杉.PPARγ在缺血预处理及其减轻后续缺血性脑损伤中作用机制的初步探讨[D]. 天津:天津医科大学, 2018.
Cao S S. A preliminary study on the mechanism of PPARγ in ischemic preconditioning and its alleviation of subsequent ischemic brain injury [D]. Tianjin: Tianjin Medical University, 2018.
[26] 宋 楠,秦 川. PPARγ在阿尔茨海默病中的作用及影响因素研究进展[J]. 医学研究生学报, 2015,(9):989-994.
Song N, Qin C. The role of PPARγin Alzheimer′s disease and its impact factors [J].Journal of Medical Postgraduates, 2015,(9):989- 994.
[27] abůRek M, JežEk J, JežEk P. Cytoprotective activity of mitochondrial uncoupling protein-2 in lung and spleen [J]. Febs Open Bio, 2018,8(4): 692-701.
[28] Ibrahim W, Tofighi R, Onishchenko N, et al. Perfluorooctane sulfonate induces neuronal and oligodendrocytic differentiation in neural stem cells and alters the expression of PPARγ in vitro and in vivo [J]. Toxicology & Applied Pharmacology, 2013,269(1):51-60.
[29] 戎 嵘.大豆异黄酮通过激活PPARγ抑制人乳腺癌MCF-7细胞增殖的作用研究[D]. 重庆:第三军医大学, 2011.
Rong R. Study on the effect of soybean isoflavones on inhibiting the proliferation of human breast cancer MCF-7 cells by activating PPARγ [D]. Chongqin:Third Military Medical University, 2011.
[30] 赵精咪.谷氨酸兴奋毒性损伤对PPARγ表达及活性调节的体内研究[D]. 天津:天津医科大学, 2020.
Zhao J M. Study on the regulation of PPARγ expression and activity by excitotoxic injury of glutamate in vivo [D]. Tianjin: Tianjin Medical University, 2020.
[31] Mukhopadhyay D, Chattopadhyay A. Induction of oxidative stress and related transcriptional effects of sodium fluoride in female zebrafish liver [J]. Bulletin of Environmental Contamination and Toxicology, 2014,93(1):64-70.
[32] Zhao X, Wang S, Wu Y, et al. Acute ZnO nanoparticles exposure induces developmental toxicity, oxidative stress and DNA damage in embryo-larval zebrafish [J]. Aquatic Toxicology, 2013,136:49-59.
[33] Kawahara A, Haraguchi N, Tsuchiya H, et al. Peroxisome Proliferator- Activated Receptor γ (PPARγ)-Independent Specific Cytotoxicity against Immature Adipocytes Induced by PPARγ Antagonist T0070907 [J]. Biological and Pharmaceutical Bulletin, 2013,36(9):1428-1434.
[34] 种 莉,唐 鹏,刘 鹏,等.激活PPAR-γ对缺氧诱导的N9小胶质细胞迁移和炎症因子释放能力的影响[J]. 中华神经医学杂志, 2017, 16(1):40-45.
Zhong L, Tang P, Liu P, et al. Role of peroxisome proliferator- activated receptor-γ in secretion of inflammatory cytokine and migration of N9 microglia cells induced by hypoxia [J].Chinese Journal of Neuromedicine, 2017, 16(1):40-45.
[35] Li S, Shi M, Wan Y, et al. Inflammasome/NF-κB translocation inhibition via PPARγ agonist mitigates inorganic mercury induced nephrotoxicity [J]. Ecotoxicology and Environmental Safety, 2020, 201:110801.
Role of the PPARγ/UCP2 in learning and memory impairment induced by formaldehyde.
ZHENG Li-fang, XIAO Jia-li, YUAN Pei-xin, CHEN Bo-qi, MEI Qiong, CHI Yu-yao, LV Ke, LI Rui*
(Key Laboratory of Genetic Regulation and Integrated Biology of Hubei Province, School of Life Sciences, Central China Normal University, Wuhan 430079, China)., 2021,41(6):2923~2931
To investigate the possible role of peroxisome proliferators-activated receptor γ/uncoupling protein 2(PPARγ/UCP2) in learning and memory impairment induced by formaldehyde(FA), C57BL/6 mice were randomly divided into different groups including control group, T0070907group(inhibitor group), 3mg/m³ FA group, 3mg/m³ FA+T0070907 group. After 21 days of continuous exposure to FA or other treatments in the experiment, mouse brain tissue was taken to determine brain index and before being homogenized for the detection of a series of physiological indices such as reactive oxygen species(ROS), glutathione(GSH), malondialdehyde(MDA), nuclear factor κB(-), interleukin-6(IL-6), PPARγ, UCP-2, as well as the determination of pathological changes by observing the Nissl stained brain tissue. The results showed that compared with those of mice in the control group, the cerebral cortex neurons of the mice were damaged in the T0070907group and the 3mg/m3FA group, the content of GSH decreased, and the levels of ROS, MDA,-, and IL-6 increased, with even more severe results were found in mice from the 3mg/m3FA+T0070907 group. In addition, compared with the control group, the contents of PPARγ and UCP2 decreased in the brain tissue of mice in the T0070907 group, while increased in those from the 3mg/m3FA group; compared with those of mice from the 3mg/m3FA group, the contents of PPARγ and UCP2 decreased in the brain tissue of mice from the 3mg/m3FA+T0070907 group after the inhibitor was administered. The content of PPARγ/UCP2 decreased after addition of T0070907, the inhibitor of PPARγ, which aggravated the learning and memory impairment in mice induced by FA exposure, therefore PPARγ/UCP2 may be protective to mice from the learning and memory impairment induced by FA.
formaldehyde;learning and memory;oxidative damage;inflammation
X18
A
1000-6923(2021)06-2923-09
郑丽芳(1996-),女,山西应县人,华中师范大学硕士研究生,研究方向为环境分子生物医学.发表论文1篇.
2020-11-19
国家自然科学基因项目(21103059);科技部十三五国家重点研发计划项目(2017YFC0702700)
* 责任作者, 教授, ruli@mail.ccnu.edu.cn
