Fe3O4/FeS2活化H2O2降解典型苯胂酸类污染物
2021-07-23林舒婷江彦亭林春香吕源财刘明华
华 洁,王 敏,林舒婷,江彦亭,林春香,吕源财,刘明华
Fe3O4/FeS2活化H2O2降解典型苯胂酸类污染物
华 洁,王 敏,林舒婷,江彦亭,林春香,吕源财*,刘明华
(福州大学环境与资源学院,福建 福州 350108)
利用水热法成功制备了Fe3O4/FeS2催化剂,并将其用于构建非均相芬顿体系降解典型的苯胂酸类污染物(洛克沙胂,ROX).XRD、SEM、XPS和磁学测量系统(VSM)等表征结果表明,Fe3O4/FeS2呈明显的颗粒状且具有良好的磁性.降解实验结果显示,在最优条件下(初始pH值为4.5、ROX起始浓度为20mg/L、Fe3O4/FeS2投加量为0.15g/L和H2O2浓度为0.034g/L,Fe3O4/FeS2介导的非均相芬顿体系可以超快速降解ROX,1min后的降解效率达到96.74%,明显优于单独的Fe3O4或FeS2体系.此外,Fe3O4/FeS2可以通过磁铁进行快速回收利用,同时也具有良好的重复利用性能,使用3次后,ROX的降解效率仍超过80%.机理分析表明,Fe3O4/FeS2能够快速地催化H2O2产生具有强氧化性的羟基自由基(×OH).在×OH的作-用下,ROX分子结构中C-As、C-N和C-C等化学键发生断裂,发生脱砷、脱硝和开环等反应,进而生成一系列的有机产物(如酚类、醌类、小分子有机酸等)和无机产物(As(V)和NO3-).之后,无机砷能够被吸附在催化剂表面,而有机产物则进一步被矿化.
Fe3O4/FeS2;过氧化氢(H2O2);苯胂酸;非均相催化;砷吸附
作为最常用的饲料添加剂,洛克沙胂(3-硝基-4-羟基苯胂酸,ROX)被广泛应用于畜禽养殖业[1-3].进入动物体的ROX会以原始形态随粪便排放到自然环境中,并在自然环境中发生降解同时释放高毒性的无机砷[4-6],将严重威胁水环境安全.目前,高级氧化技术被认为是实现快速降解有机砷最有效技术[7-10].常见的高级氧化技术有Fenton氧化法[11-12]、电化学氧化法[13-14]、臭氧氧化法[15-16]、催化湿式氧化法[17-18]等.其中Fenton反应以产生羟基自由基(×OH)为基础,该反应具有很高的电负性或亲电子性,电子亲和能力强、氧化能力强、选择性小,反应速度快、反应条件温和等优点[19].由于铁与砷存在强烈的配位作用[20],由铁基材料介导的高级氧化技术可以快速降解有机砷,避免无机砷的释放.研究表明,传统的均相Fenton技术不仅可以快速降解阿散酸(30min),还可以有效吸附释放的无砷[21], FeS2/H2O2通过氧化、吸附、混凝等方式去除对氨基苯胂酸[9].由纳米零价铁自身介导的非均相Fenton也同样可以实现阿散酸的快速矿化以及无机砷的捕集[22].然而,该体系存在对pH值有强烈的依赖性(pH值需控制在3左右)、催化剂难以回收等缺点,限制了其应用[23-24].虽然铁基催化剂介导的Fenton技术可以有效去除水体中有机污染物,但目前的铁基催化剂仍存在一定的缺陷.比如,有磁性的铁基催化剂(Fe3O4、铁钴和铁镍)对活化H2O2的效率有待提高,而且对pH值的要求较为严格[25-27];铁的硫化物(FeS、FeS2和FeSx)虽然有较高的H2O2活化效率,但其往往难以回收利用,容易引起二次污染[28-29].
基于此,本文采用水热法制备新型铁基催化剂(Fe3O4/FeS2),以ROX为目标污染物研究其对H2O2的催化活性,采用XRD、SEM-Mapping、XPS、VSM等方法对催化剂进行表征,考察不同pH值、污染物初始浓度、催化剂投加量、H2O2浓度对其活化H2O2降解ROX的影响,探讨基于铁基催化剂非均相芬顿体系对ROX的降解路径及机理,以期为非均相催化降解新型有机污染物方面提供参考.
1 材料与方法
1.1 实验试剂及仪器
主要原料与试剂:洛克沙胂(ROX)、醋酸亚铁、纳米四氧化三铁、升华硫、无水乙醇、油胺、丙酮、过氧化氢、盐酸羟胺、六水合硫酸亚铁铵、邻菲罗啉、乙酸钠、盐酸、氢氧化钠、甲醇、磷酸,实验用水均为超纯水.
主要仪器: Miniflex 600型X射线粉末衍射仪(XRD,日本Rigaku公司)、Hitachi S4800型冷场发射扫描电镜显微镜(SEM,日本日立公司)、ESCALAB 250XI型X射线光电子能谱仪(XPS,美国ThermoFisher公司)、MPMS (SQUID) XL型磁学测量系统(VSM,美国Quantum Design公司)、LC-20AT型高效液相色谱仪(HPLC,日本岛津公司)、GC×GC HRT 4D+型气质联用仪(GC-MS,美国力可公司)、JES FA200型电子顺磁共振波谱仪(ESR,日本电子株式会社)、Metrohm 881型离子色谱(IC,瑞士万通中国有限公司)、XSERIES型电感耦合等离子体质谱仪(ICP–MS,美国ThermoFisher公司)、TOC-L型总有机碳分析仪(TOC,日本岛津公司)、UV- 1780型紫外分光光度计(UV,日本岛津公司)、H1850型离心机(湖南湘仪开发有限公司)、DHG-9053A型烘箱(上海精宏实验设备有限公司)、PHSJ-4F型pH计(上海仪电科学仪器股份有限公司).
1.2 Fe3O4/FeS2的制备与表征
1.2.1 Fe3O4/FeS2的制备 Fe3O4/FeS2的制备参考FeS2合成方法[30],具体过程如下:分别称取0.87g醋酸亚铁(Fe(CH3COO)2)、0.45g纳米四氧化三铁(Fe3O4)和0.96g升华硫(S)置于装有乙醇和油胺的烧杯中,经超声20min后转移至带有聚四氟乙烯内衬的水热反应釜中,在220℃条件下反应10h,冷却至室温后在10000r/min条件下离心5min,得到黑色固体,经丙酮和乙醇清洗后于60℃条件下真空干燥12h,即得到黑色的Fe3O4/FeS2样品,设2组平行实验.不投加Fe3O4时得到样品FeS2.
1.2.2 Fe3O4/FeS2的表征 样品晶型用X射线粉末衍射仪进行分析,样品表面形貌用冷场发射扫描电镜显微镜观察并结合Mapping进行分析,选用X射线光电子能谱仪对样品表面成分、元素价态及半定量进行分析,材料磁强度用磁学测量系统进行分析.
1.3 实验方法
在室温条件下,将10mg Fe3O4/FeS2加入装有50mL ROX溶液(20mg/L)的烧杯中,在磁力搅拌(500r/min)下加入一定质量的H2O2溶液(0.034g/L)进行ROX的降解实验,每间隔一定时间用注射器取样2mL,置于预装有一定量自由基猝灭剂(甲醇)的离心管中.经离心(8000r/min)5min后将固体分离,并用2mL甲醇对分离的固体进行萃取,上清液和萃取液用0.22μm玻璃纤维滤膜过滤后采用高效液相色谱仪(HPLC)进行ROX残留浓度分析.
1.4 分析方法
1.4.1 ROX的定量分析实验 ROX浓度采用高效液相色谱仪进行测试,色谱柱选用C18柱(Agilent5HC- C18,250mm´4.6mm).检测方法:流动相设为甲醇:40%和磷酸溶液(含磷酸0.2%,质量浓度):60%,进样量:20μL,流速:1mL/min,紫外检测波长:264nm.
1.4.2 ROX的降解产物分析 GC-MS测定中间产物:将萃取液氮吹浓缩后采用气质联用系统进行测定,GC分析柱为TG-5MS(15m×0.25mm×0.1μm)毛细管柱,流速为1mL/min,离子源为EI源,荷质比扫描范围为35~500,不分流进样,进样体积1μL,进样口及传输线温度均设为300℃,初始柱温为50℃,保持1min,以10℃/min升温至310℃,保持4min.
1.4.3 ROX的无机产物分析 As的测定:采用电感耦合等离子体质谱仪测定降解过程中产生的As含量,ICP源:固体晶体稳频RF发生器,频率27.12MHz;纯Mo质四级杆;随机背景<0.5cps (220amu);标准模式下信噪比>200M;短期稳定性(RSD)<2%,长期稳定性(RSD)<3%.
NO3-的测定:采用配有阴离子分析柱(Metrosep A Supp 5-250(6.1006.530))的离子色谱仪测定NO3-离子.检测方法:流动相为碳酸钠(3.2mmol/L)和碳酸氢钠(1.0mmol/L)的混合溶液,流速为1.0mL/min.进样量为25μL,抑制电流设置为50mA.在测定之前,所有样品均使用0.22μm玻璃纤维滤膜过滤.
1.4.4 铁离子浓度分析 Fe2+和Fe3+的测定:采用邻菲罗啉分光光度法测定溶液中Fe2+含量变化[31].总溶解性Fe在测定前加入过量盐酸羟胺使溶液中Fe3+全部转化成Fe2+.Fe3+浓度=总Fe-Fe2+浓度.
1.4.5 电子自旋共振分析 采用电子顺磁共振波谱仪测定催化剂反应时产生的自由基,仪器参数设定:中心场250mT,扫场宽度250mT,测量时长1min,微波频率9054MHz,调制频率100kHz,微波功率0.998mW.
1.4.6 ROX的TOC分析 TOC检测采用总有机碳分析仪进行测试,测定原理为680℃铂金催化燃烧/NDIR,样品经过0.22μm玻璃纤维滤膜过滤后测试.按下式计算TOC去除率:
TOC去除率(%)=[(TOC0TOC)/TOC0]×100%
式中:TOC0为ROX溶液初始TOC值(mg/L),TOC为ROX溶液反应时刻TOC值(mg/L).
2 结果与讨论
2.1 Fe3O4/FeS2的表征
2.1.1 表面形貌及能谱分析 由图1(a)~(c)可以看出,本文制备的Fe3O4/FeS2呈现明显的颗粒状且尺寸不一,但颗粒间发生了较为严重的团聚现象.这主要是由于磁性颗粒间的强相互作用引起的.由Mapping图(d)~(f)可知,本制备的催化剂主要由Fe、O和S3种元素组成,并且3种元素均匀分布在样品表面,表明Fe3O4与FeS2成功复合.
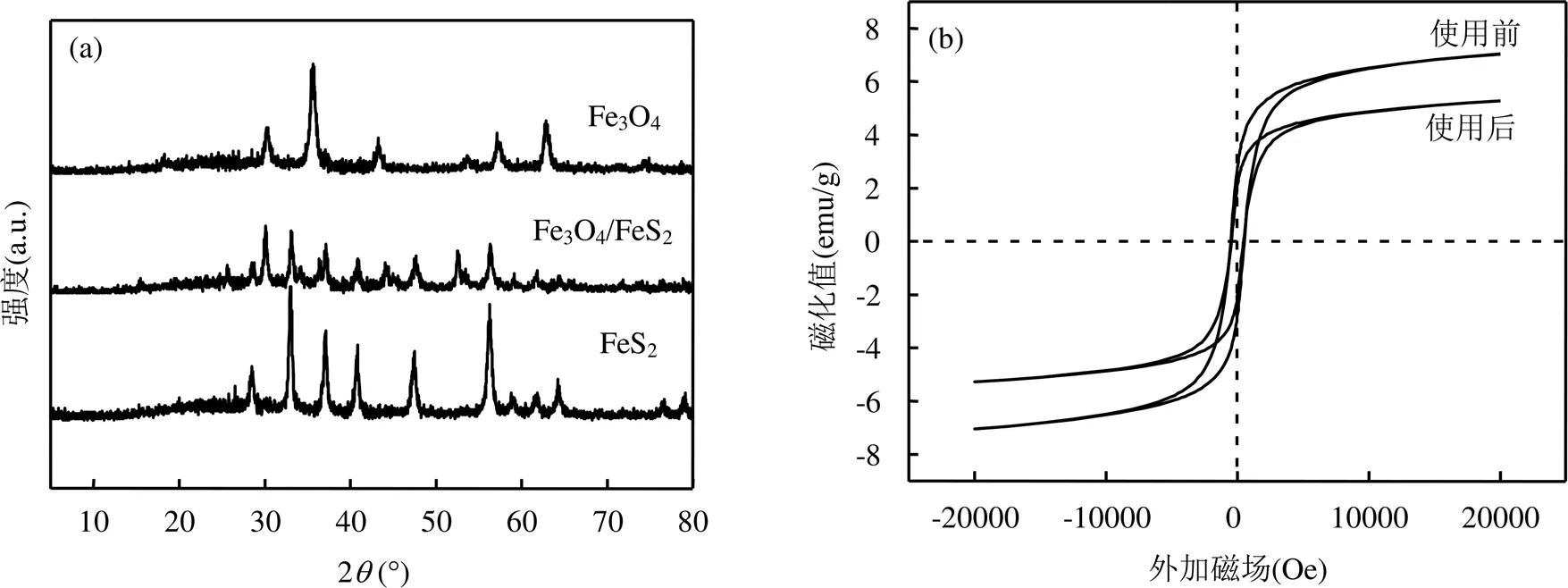
图2 Fe3O4、FeS2、Fe3O4/FeS2材料的XRD及Fe3O4/FeS2的振动样品磁强计分析
2.1.2 XRD和VSM分析 如图2(a)所示,Fe3O4的XRD图谱分别在2为30.14°、35.83°、43.47°、53.93°、57.56°、63.31°和74.69°出现了明显的衍射峰,分别对应Fe3O4(PDF#65-3170)的(220)、(311)、(400)、(422)、(511)、(400)、(533)晶面.FeS2的XRD图谱分别在2为28.51°、33.01°、37.13°、40.76°、47.48°、56.31°、58.97°、61.79°、64.28°、76.53°和78.97°有明显的衍射峰,分别对应FeS2(PDF#65- 3321)的(111)、(200)、(210)、(211)、(220)、(311)、(222)、(023)、(321)、(331)、(420)晶面.Fe3O4/FeS2在2为28.62°、30.09°、33.12°、37.18°、40.87°、47.70°、52.63°、56.31°、59.13°、61.73°和65.63°出现了Fe3O4和FeS2特征衍射峰,表明材料中含有Fe3O4和FeS2.
如图2(b)所示,磁滞回曲线中,制备的Fe3O4/ FeS2磁滞回线呈明显的S型,磁滞回线窄,剩磁和矫顽力小,其饱和磁化(Ms)值为7.2emu/g.
2.1.3 XPS分析 为分析制备的Fe3O4/FeS2催化剂表面元素组成及价态,采用XPS对使用前后的催化剂进行表征,结果图3所示.图3(a)为Fe3O4/ FeS2的高分辨全谱图,制备的Fe3O4/FeS2主要由Fe、S、O 3种元素组成,C峰的出现主要是因为测试过程中使用C作为结合能基准校正而引入.由O1s的XPS高分辨图谱[图3(b)],在结合能为529.73和531.46eV处的峰为O2-、OH-[32],这说明材料中含有铁的氧化物和氢氧化物,铁的氢氧化物可能是由于催化剂表面吸水形成.由S2p的XPS高分辨图谱[图3(c)]可以看出,在结合能161.77, 162.68,163.78,166.06,168.64eV处的峰分别为S2-、S22-、Sn2-、SO32-和SO42-[9,33],其中,S22-峰的出现表明材料中含有FeS2.由Fe2p的XPS高分辨图谱(图3d),在结合能为707.14eV处出现了FeS2的特征峰[8],结合能为709.30eV及712.09eV处出现的峰分别可能为Fe(Ⅱ)-O和Fe(Ⅲ)-O,说明材料中可能含有FeO、Fe2O3[34],结合能为710.81和724.71eV处出现了Fe2p3/2和Fe2p1/2的特征峰,这两个特征峰的出现表明了Fe3O4/FeS2复合材料表面含有Fe3O4,与文献报道一致[35].由Fe3p的XPS高分辨图谱(图3e)可以得知,在结合能为53.72和55.64eV处的峰为Fe(Ⅱ)和Fe(Ⅲ)[36].从XPS高分辨图谱可以表明材料中含有Fe3O4和FeS2,表明催化剂成功制备.
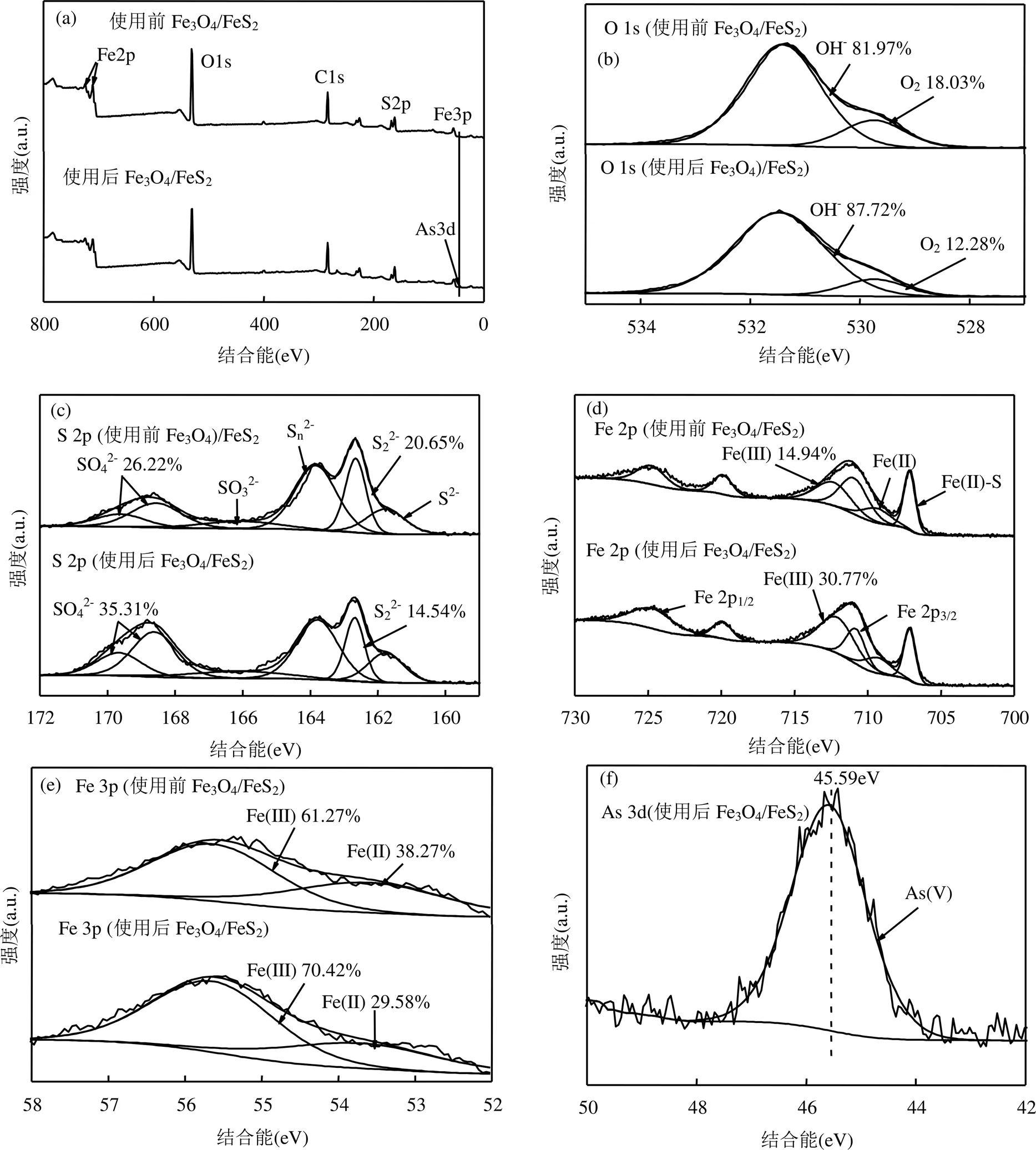
图3 Fe3O4/FeS2使用前后的XPS图谱
2.2 非均相Fenton降解ROX
2.2.1 不同体系对ROX的降解分析及复合材料体系TOC变化情况 本文考察了不同催化剂(FeS210mg、Fe3O410mg和Fe3O4/FeS210mg)体系在初始pH4.5条件下对ROX(20mg/L)的降解情况.由图4(a)可知,Fe3O4/FeS2介导的非均相Fenton体系可实现ROX的超快速降解,处理1min后,ROX的降解效率(97.00%)明显高于单独的FeS2(59.69%)和Fe3O4(16.91%)体系.此外,Fe3O4/FeS2可5min内完全降解ROX,也明显快于对照体系,这表明复合催化剂对H2O2具有更高的催化活性.这是因为在溶液中复合催化剂可以快速释放出Fe2+,促进H2O2的分解,从而加快污染物的降解效率.与此同时,从图4(b)可知,反应30min后,Fe3O4/FeS2体系中TOC的去除率达到90%,表明体系可以实现ROX的矿化.
2.2.2 自由基分析 DMPO能够与羟基自由基反应生成衍生产物DMPO-×OH,通过电子顺磁共振波谱仪记录DMPO-×OH的自旋信号,可以测得羟基自由基.Fe3O4/FeS2/H2O2体系中产生×OH自由基的ESR图谱如图4(c)所示.在无催化剂的对照体系中,没有出现×OH的信号,表明对照体系无法产生羟基自由基.相反,加入Fe3O4/FeS2后,在图中可以明显地观察到DMPO-×OH加合衍生物强度比为1:2:2:1的特征信号峰[37],表明Fe3O4/FeS2可以有效催化H2O2分解产生羟基自由基,是Fe3O4/FeS2/H2O2体系最主要的活性物质.
2.2.3 不同因素对ROX的降解分析 以ROX的降解效率为评价指标,考察了主要因素(如初始pH值、ROX初始浓度、催化剂投加量和H2O2投加量)对Fe3O4/FeS2/H2O2体系降解ROX的影响.本文在催化剂投加量为0.2g/L,H2O2投加量为0.034g/L,ROX初始浓度为20mg/L的条件下,考察不同溶液初始pH值(1,3,4,5,7,9,11)对ROX降解的影响,结果如图4d所示.FeS2/H2O2体系当pH值小于5时,ROX的降解率随着pH值的升高而升高,并在pH值为4时,ROX的降解效率最高,1min内可达到97.00%,之后ROX的降解效率随pH值的升高逐渐降低,初始pH值为4时较pH值为1和11 时ROX的降解率分别提高了52.98%和72.84%,由此可知在强酸强碱条件下均不利于ROX的降解,这可能是因为当pH值浓度过低时会影响其催化活性.在过酸条件下H+浓度过高,Fe3+不能顺利被还原为Fe2+,催化反应会受阻[38],而在强碱条件下抑制了自由基的产生.此外,在原始的体系中(滴加H2O2前的pH值约为4.5),反应1min后,ROX的降解效率也高达97.00%.因此,本文在后续实验中不对初始pH值进行调节.由图4d可知,Fe3O4/H2O2体系(=30min)仅在pH值为3~4时对ROX有较好的降解效果(>75%),而FeS2/H2O2体系(=15min)在pH值为3~5时对ROX有较好的降解效果(>80%).Fe3O4/FeS2/H2O2体系(=1min)在pH为3~5时对ROX的降解率均高于90%,明显的高于单独体系.值得注意的是,复合体系在中性条件下仍然能有80%的降解效率,表明本文制备的Fe3O4/FeS2催化剂具有较宽的pH值适用性.
其次,污染物初始浓度也是影响污染物降解效率的重要因素之一[39].本实验在初始pH 4.5,催化剂投加量为0.2g/L,H2O2投加量为0.034g/L的条件下,研究了不同浓度ROX(10,20,30,40,50,60,70mg/L)对降解效率的影响,结果如图4(e)所示.由图4(e)可知,不同初始浓度对ROX的降解有明显的影响,在浓度小于20mg/L时,1min内降解率可以达到97.00%以上,随着ROX浓度的提高,降解率逐渐下降,这是由于在相同条件下,反应产生的自由基数量是一定的,所以污染物浓度越大,降解率越低.

催化剂(Fe3O4/FeS2)投加量会影响污染物的降解效率[40].本文在反应体系初始pH值为4.5,ROX起始浓度为20mg/L,H2O2浓度0.034g/L条件下,考察不同浓度Fe3O4/FeS2(0.10,0.15,0.20,0.25,0.30g/L)对降解ROX降解效率的影响,结果如图4(f)所示,ROX的降解率会随着催化剂浓度的提高而增大,当催化剂投加量大于0.15g/L时ROX的降解率提升速度减缓,ROX的降解率都可以达到96.62%以上.
Fenton体系中羟基自由基是由H2O2分解产生的,因此H2O2投加量会影响ROX的降解效率[41].本文在初始pH值为4.5,ROX起始浓度20mg/L, Fe3O4/FeS20.15g/L的条件下,考察不同H2O2(0.017,0.034,0.051,0.068,0.085g/L)浓度对降解ROX的影响,由图4(g)可知在H2O2浓度为0.034g/ L时,ROX的降解率达到最高(96.74%),继续增加H2O2浓度,ROX的降解率无明显提升,且呈下降趋势,这可能因为过量的H2O2会捕获反应体系中生成的活性自由基[42].
综上可知,本文体系的最佳条件为初始pH值为4.5,ROX起始浓度20mg/L,Fe3O4/FeS2投加量为0.15g/L,H2O2浓度0.034g/L.在此条件下,体系在20s时ROX降解率可以达到91.69%,5min可以实现ROX的完全降解.此外,制备的催化剂可以进行重复利用.由图4(h)可知,Fe3O4/FeS2在重复利用3次后对ROX的降解效率仍保持在80%以上,之后效率迅速降低,使用5次后降解效率仅有43%.这表明Fe3O4/ FeS2具有一定的重复利用性能.磁滞回曲线结果显示(图2b),经重复利用后,虽然催化剂的饱和磁化(Ms)值由7.2降至5.3emu/g,但其仍具有磁性,可实现快速分离.
2.3 ROX在非均相Fenton体系中的降解机理
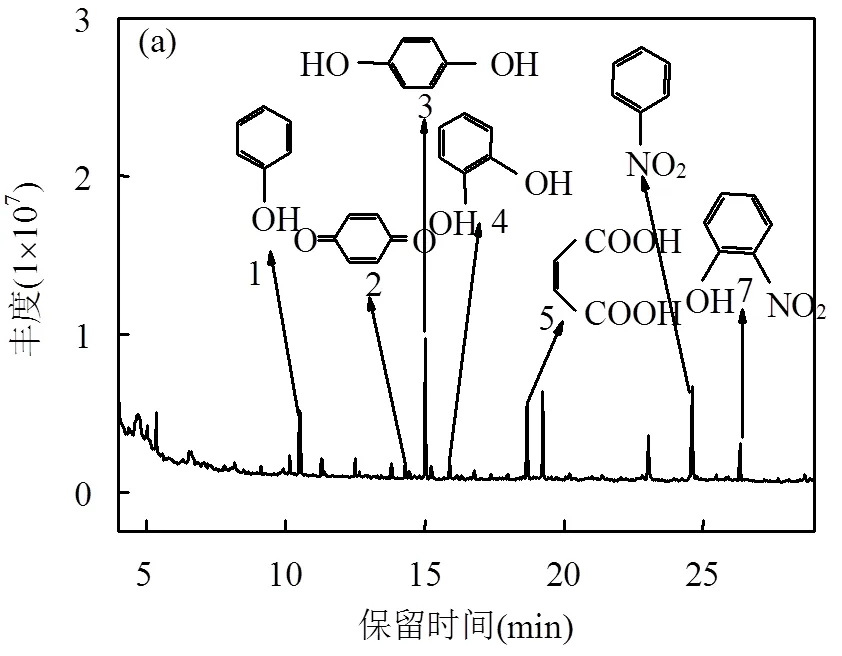
2.3.1 ROX降解产物分析 如图5(a)和表1所示, 7号峰为邻硝基苯酚(保留时间为26.32min,分子离子为139,主要碎片离子为109,81,65,39),是ROX脱砷化合物后的产物.6号峰、4号峰、1号峰分别为硝基苯(保留时间为24.62min,分子离子为123,主要碎片离子为93,77,65,51)、邻苯二酚(保留时间为15.92min,分子离子为110,主要碎片离子为92,81, 64)、苯酚(保留时间为10.51min,分子离子为94,主要碎片离子为66和65),这三种物质是由邻硝基苯酚转化得到,保留时间为15.03min的3号峰为对苯二酚(分子离子为110,碎片离子为81,64, 55).2号峰为对苯醌(保留时间为14.32、分子离子为108,主要碎片离子为82,80,54)可以与对苯二酚相互转化.保留时间为18.69min的5号峰马来酸(分子离子为116,主要碎片离子为99,98,72,54)则是对苯二酚在羟基自由基作用下开环后的降解产物.
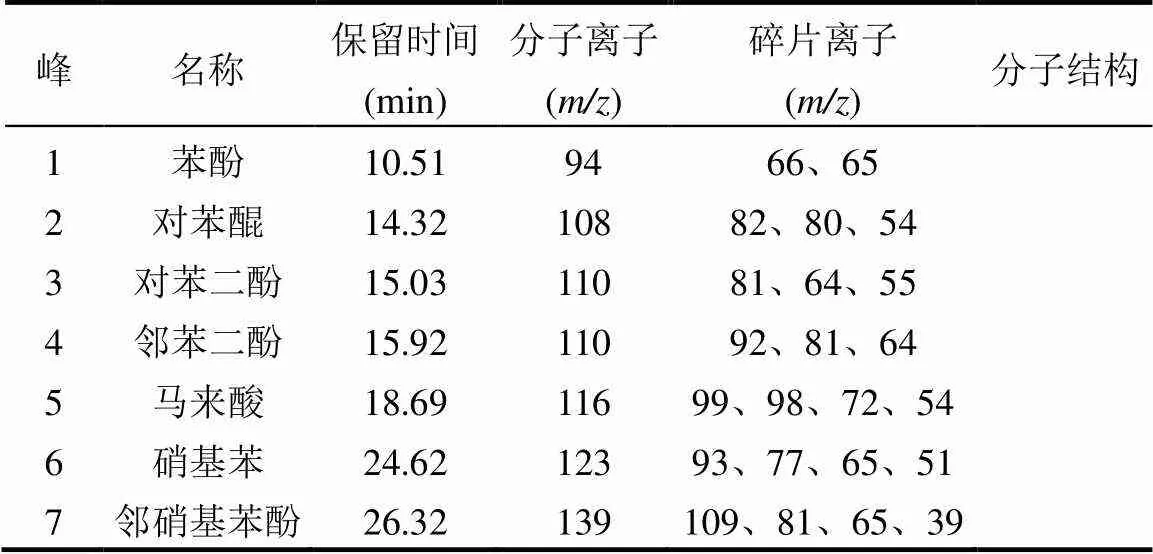
表1 ROX降解过程中的中间产物
如图5(b)所示,在ROX降解过程中伴着随无机砷和NO3-的生成,但两者呈现不同的变化趋势.在ROX降解过程中,溶液中的As浓度远低于理论值,且在30s时达到峰值,之后随着反应时间不断下降,表明释放的As能够被催化剂吸附.前期相关的研究也证实[9,22],由于Fe与As的强配位作用,Fe基材料能够快速的吸附水体中的As.在15min后达到最低值(0.047mg/L),低于地表水环境质量标准[43].然而,NO3-却随着ROX的降解呈现不断上升的趋势,在15min后达到最大值(3.19mg/L).此外,反应5min后,NO3-的浓度仍在逐渐增大,表明ROX的降解产物中存在含硝基产物,并发生了进一步的脱硝基作用.在整个过程中,NO3-的浓度也明显低于理论值,主要是由两方面原因造成的.一方面,生成的NO3-有可能被吸附在催化剂表面;另一方面,硝基在反应过程中有可能参与了其他的氧化还原反应.
如图5(c)所示,加入H2O2之前,体系中Fe2+瞬间升高至4.98mg/L,之后随着反应的进行,Fe2+的浓度迅速降低.Fe2+的快速下降主要归因于其迅速与过氧化氢发生反应生成Fe3+.然而,Fe3+的浓度并未随着反应的进行明显升高,这主要是由于生成的Fe3+会被催化剂吸附.结合Fe2p和Fe3p谱图[图3(d)和(e)]可以看出,反应后催化剂表面的Fe(III)含量明显上升.
2.3.2 洛克沙胂降解途径 基于降解产物分析结果、ESR测试实验和XPS高分辨图谱分析,推断洛克沙胂的降解路径,如图6所示.首先,洛克沙胂在羟基自由基作用下发生脱砷作用,生成邻硝基苯酚和砷酸.之后,邻硝基苯酚通过两条路径进行降解.一方面,邻硝基苯酚发生脱硝基作用,生成邻苯二酚,而脱除的硝基则转化成硝酸根,另一方面,此时,邻硝基苯酚发生脱羟基作用,生成硝基苯,之后硝基苯进一步发生脱硝基作用,生成苯酚和硝酸根.随后,邻苯二酚和苯酚进一步转化成对苯二酚,并由对苯二酚转化成对苯醌.最后,在羟基自由基的进一步攻击下,对苯二酚和对苯醌发生开环,生成小分子羧酸如马来酸,最后矿化为二氧化碳和水.
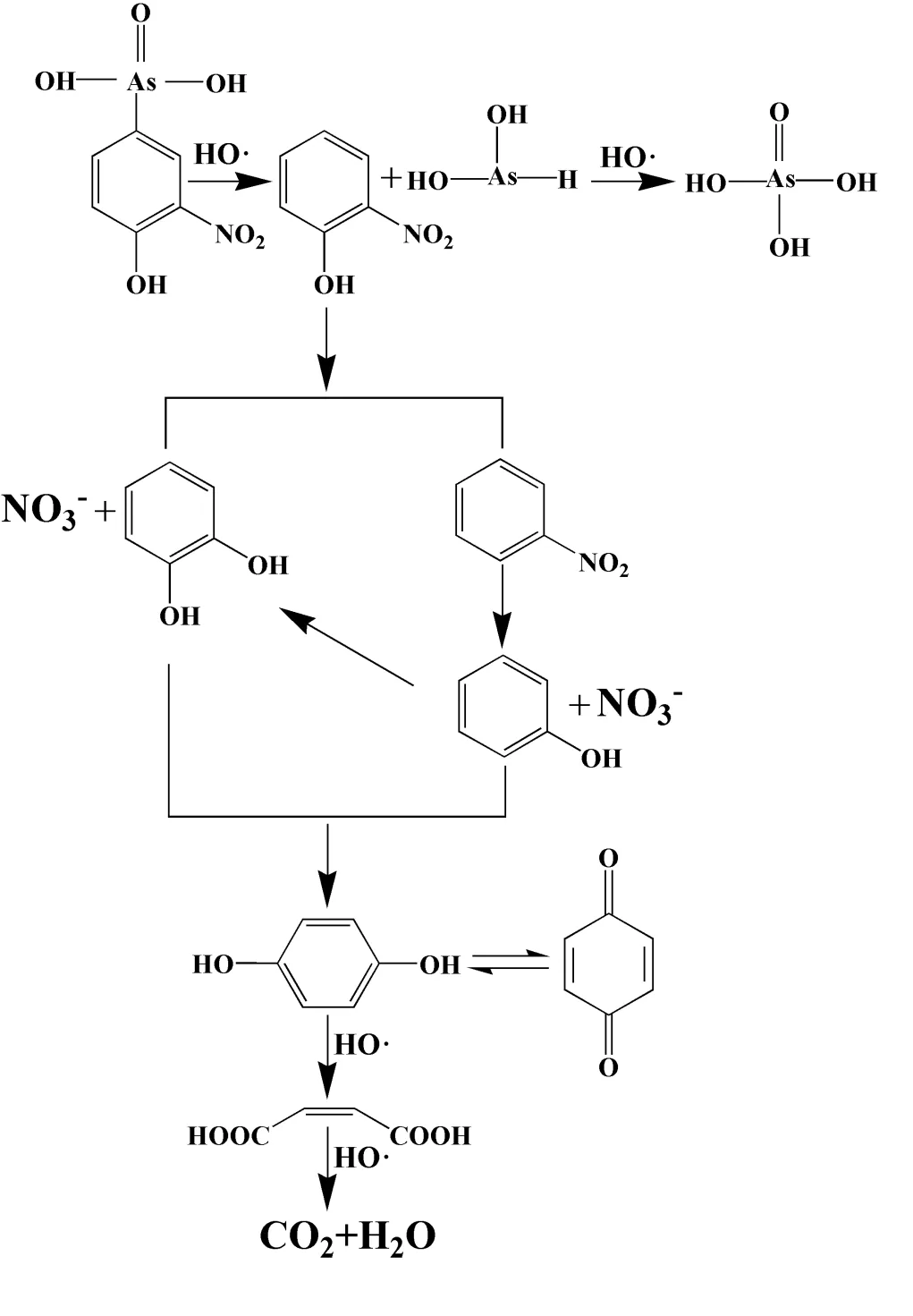
图6 ROX在Fe3O4/FeS2/H2O2体系中的降解路径
2.3.3 降解机理 从图3(a)可知,降解后的Fe3O4/ FeS2含有Fe、S、O、As4种元素,表明砷被吸附到催化剂表面.由O1s的XPS高分辨图谱[图3(b)]可以得知,O2-的比例从18.03%降低到12.28%,OH-的比例从81.97%上升到87.72%,说明反应过程中有氧化物的消耗和氢氧化物的生成.由S2p的XPS高分辨图谱[图3(c)]可以得知,反应后材料中S22-由20.65%降为了14.54%,SO42-由26.22%上升到35.31%,由此可推断S22-参与了反应.由Fe2p的XPS高分辨图谱[图3(d)]可以得知,Fe(Ⅱ)-S和Fe(Ⅱ)的峰面积有略微的下降,Fe(Ⅲ)的峰面积由14.94%上升到30.77%,说明了Fe(Ⅱ)参与反应可能部分转化为了Fe(Ⅲ),结合Fe3p的XPS高分辨图谱[图3(e)]中Fe(Ⅱ)由38.27%下降为29.58,Fe(Ⅲ)由61.27%上升到70.42%,进一步验证了Fe(Ⅱ)参与了反应.结合图5(c)可知,反应前溶液中存在Fe2+,加入H2O2后Fe2+浓度迅速降低,Fe3+浓度增加,说明了Fe2+与H2O2反应会发生在溶液中,也再一步证实了Fe2+参与了反应.根据文献可知[44],As(V)的结合能在45.6eV附近.由As3d的XPS高分辨图谱(图3f)可以得知,吸附后As3d在结合能45.59eV处出现了AS(Ⅴ)的峰,表明吸附在催化剂表面的砷为AS(Ⅴ).
基于催化剂表面元素分析并结合产物分析, Fe3O4/FeS2催化降解ROX的机理如图7所示.
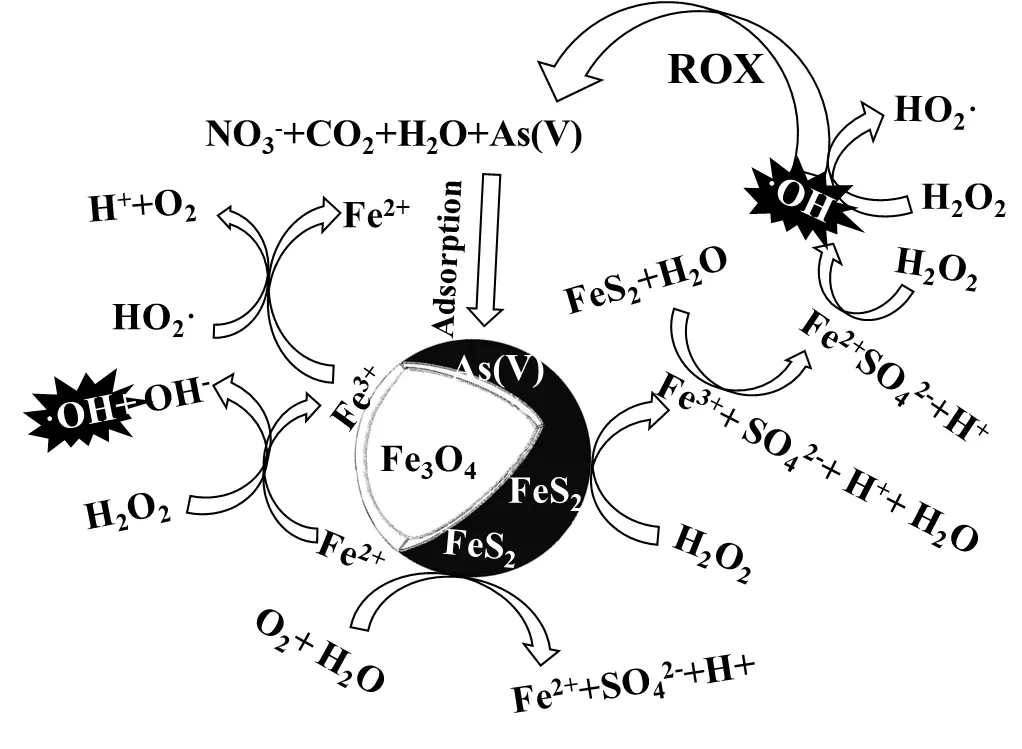
图7 Fe3O4/FeS2/H2O2体系降解ROX的作用机理
结合相关文献[45-49],Fe3O4/FeS2介导的非均相体系中相关反应如下所示:
7FeS2+7O2+2H2O®2Fe2++4SO42-+4H+(1)
2FeS2+15H2O2®2Fe3++4SO42-+2H++14H2O (2)
FeS2+14Fe3++8H2O®15Fe2++2SO42-+16H+(3)
Fe2++H2O2®Fe3++HO·+2OH-(4)
≡FeⅡ+H2O2+H+®≡FeⅢ+·OH+H2O (5)
≡FeⅢ+H2O2®≡FeⅡ+HO2·+H+(6)
ROX+HO·®小分子有机物+NO3-+AS(V) (7)
相关研究证实[45],在酸性条件下,FeS2可通过两种途径产生Fe2+(式(1)和式(2)~(3)).第一种途径为FeS2在水溶液中被O2氧化(式(1))生成Fe2+、SO42-及H+.第二种途径由两个连续反应步骤完成(式(2)和式(3)),FeS2与H2O2反应生成Fe3+、SO42-、H+和H2O,接着Fe3+与FeS2继续反应生成Fe2+,第二种途径是产生Fe2+最主要的反应,Fe2+通过电子转移催化H2O2分解产生·OH(式(4)).与此同时,H2O2将Fe3O4表面的≡FeⅡ氧化成≡FeⅢ,并将羟基自由基释放到水中(式(5)),Fe3O4表面被氧化生成的≡FeⅢ会被H2O2还原≡FeⅡ(式(6))[46-47].而式(1)~(3)中产生的H+则有助于Fe3O4表面向溶液中释放Fe2+,进而促进H2O2的活化.此外,研究表明,Fe3+与FeS2存在协同作用,可提高FeS2分解H2O2的催化活性[48].Fe3+可以通过电子转移被FeS2中的S22-还原成Fe2+,进而强化芬顿反应[49].作为一种氧化性极强的自由基,·OH能够快速氧化ROX,造成C-As和C-N的断裂,生成小分子有机物、As(V)和NO3-(式(7)).其中,As(V)能够通过与催化剂表面的Fe结合,进而吸附在催化剂表面.
3 结论
3.1 利用水热法制备出高效且具有磁性的Fe3O4/ FeS2催化剂.
3.2 ROX的去除效果取决于pH值、ROX起始浓度、Fe3O4/FeS2投加量及H2O2投加量等因素.通过单因素实验,在最优条件下,Fe3O4/FeS2可以快速活化H2O2产生×OH, 1min后ROX的降解效率达到96.74%,实现ROX的快速降解.
3.3 基于ESR测试和中间产物分析,提出ROX的降解机理,在×OH的作用下,ROX发生脱砷、脱硝和开环等反应. ROX降解过程中释放的无机砷可吸附在Fe3O4/FeS2催化剂表面,避免降解产物的二次污染.
[1] 孟计忠.洛克沙胂的光化学降解及其强化的研究 [D]. 合肥:合肥工业大学, 2019.
Meng J Z. Study on photochemical degradation and Enhancement of Roxarsone [D]. HeFei: HeFei University of Technology, 2019.
[2] Carpenter L E. The effect of 3-nitro-4-hydroxy phenyl arsonic acid on the growth of swine [J]. Archives of Biochemistry & Biophysics, 1951,32(1):181-186.
[3] Chen N, Wan Y, Ai Z, et al. Fast transformation of roxarsone into toxic arsenic species with ferrous iron and tetrapolyphosphate [J]. Environmental Chemistry Letters, 2019,17(2):1077-1084.
[4] Garbarino J R, Bednar A J, Rutherford D W, et al. Environmental fate of roxarsone in poultry litter. I. Degradation of roxarsone during composting [J]. Environmental Science & Technology, 2003,37(8): 1509-1514.
[5] Li P Y, Wu Y Z, Wang Y L, et al. Soil Behaviour of the veterinary drugs lincomycin, monensin, and roxarsone and their toxicity on environmental organisms [J]. Molecules, 2019,24(24):4465.
[6] Abdo K M, Elwell M R, Montgomery C A, et al. Toxic responses in F344rats and B6C3F1mice given roxarsone in their diets for up to 13weeks [J]. Toxicology Letters, 1989,45(1):55-66.
[7] Chen S, Deng J, Ye C, et al. Simultaneous removal of p ara-arsanilic acid and the released inorganic arsenic species by CuFe2O4activated peroxymonosulfate process [J]. Science of the Total Environment, 2020,742.DOI:10.1016/j.scitotenv.2020.140587.
[8] Zheng S, Jiang W, Cai Y, et al. Adsorption and photocatalytic degradation of aromatic organoarsenic compounds in TiO2suspension [J]. Catalysis Today, 2014,224:83-88.DOI:10.1016/j.cattod.2013. 09.040.
[9] Zhao Z, Pan S, Ye Y, et al. FeS2/H2O2mediated water decontamination from p-arsanilic acid via coupling oxidation, adsorption and coagulation: Performance and mechanism [J]. Chemical Engineering Journal, 2020,381.DOI:10.1016/j.cej.2019.122667.
[10] Xie X, Zhao W, Hu Y, et al. Permanganate oxidation and ferric ion precipitation (KMnO4-Fe(III)) process for treating phenylarsenic compounds [J]. Chemical Engineering Journal, 2019,357:600-610. DOI:10.1016/j.cej.2018.09.194.
[11] Fenton H. Oxidation of tartaric acid in presence of iron [J]. Journal of the Chemical Society Transactions, 1894,65:899-910.DOI:10.1039/ CT8946500899.
[12] 杨远秀,姚 创,刘 晖,等.磁性Fe^n+@GO非均相Fenton催化氧化亚甲基蓝 [J]. 中国环境科学, 2018,38(5):121-128.
Yang Y X, Yao C, Liu H, et al. Catalytic oxidation of methylene blue by magnetic Fe^n+@GO heterogeneous Fenton [J].China Environmental Sciences, 2018,38(5):121-128.
[13] Simond O, Schaller V, Comninellis C. Theoretical model for the anodic oxidation of organics on metal oxide electrodes [J]. 1997,42 (13/14):2009-2012.
[14] 周玉莲,于永波,黄 湾,等.氧化石墨烯电催化高效降解有机染料RBk5 [J]. 中国环境科学, 2019,39(11):4653-4659.
Zhou Y L, Yu Y B, Huang W, et al. Electrocatalytic degradation of organic dye RBK5by graphene oxide [J]. China Environmental Sciences, 2019,39(11):4653-4659.
[15] Snyder S A, Wert E C, Rexing D J, et al. Ozone Oxidation of Endocrine Disruptors and Pharmaceuticals in Surface Water and Wastewater [J]. Ozone Science & Engineering, 2006,28(6):445-460.
[16] 马富军,李新洋,宗博洋,等.电-多相臭氧催化技术处理金刚烷胺制药废水 [J]. 中国环境科学, 2018,38(10):115-121.
Ma F J, Li X Y, Zong B Y, et al. Treatment of Amantadine Pharmaceutical Wastewater by Electro-heterogeneous Ozone Catalytic Technology [J]. China Environmental Science, 2018,38(10):115-121.
[17] Mishra V S, Mahajani V V, Joshi J B. Wet Air Oxidation [J]. Industrial Engineering Chemistry Research, 1995,34(1):2-48.
[18] 张宣娇,孙 羽,刘 明,等.CeO2形貌结构对催化湿式空气氧化苯酚性能的影响 [J]. 中国环境科学, 2020,40(10):157-161.
Zhang X J, Sun Y, Liu M, et al. The effect of CeO2morphology and structure on catalytic wet air oxidation of phenol [J]. China Environmental Science. 2020,40(10):157-161.
[19] Babuponnusami A, Muthukumar K. A review on Fenton and improvements to the Fenton process for wastewater treatment [J]. Journal of Environmental Chemical Engineering, 2014,2(1):557-572.
[20] Tian C, Zhao J, Zhang J, et al. Enhanced removal of roxarsone by Fe3O4@3D graphene nanocomposites: synergistic adsorption and mechanism [J]. Environmental Science Nano, 2017,4(11):2134-2143.
[21] Xie X, Hu Y, Cheng H. Rapid degradation of p-arsanilic acid with simultaneous arsenic removal from aqueous solution using Fenton process [J]. Water Research, 2016,89:59-67.
[22] Lv Y, Huang S, Huang G, et al. Remediation of organic arsenic contaminants with heterogeneous Fenton process mediated by SiO2-coated nano zero-valent iron [J]. EnvironmentaL Science and Pollution Research, 2020,27(11):12017-12029.
[23] Satishkumar G, Landau M V, Buzaglo T, et al. Fe/SiO2heterogeneous Fenton catalyst for continuous catalytic wet peroxide oxidation prepared in situ by grafting of iron released from LaFeO3[J]. Applied Catalysis B: Environmental, 2013,138:276-284.DOI:10.1016/ j.apcatb.2013.02.040.
[24] Zhang Y, Zhang K, Dai C, et al. An enhanced Fenton reaction catalyzed by natural heterogeneous pyrite for nitrobenzene degradation in an aqueous solution [J]. Chemical Engineering Journal, 2014, 244:438-445.DOI:10.1016/j.cej.2014.01.088.
[25] Wan Z, Wang J. Degradation of sulfamethazine using Fe3O4-Mn3O4/ reduced graphene oxide hybrid as Fenton-like catalyst [J]. Journal of Hazardous Materials, 2017,324(B):653-664.
[26] Li J, Li X, Han J, et al. Mesoporous bimetallic Fe/Co as highly active heterogeneous Fenton catalyst for the degradation of tetracycline hydrochlorides [J]. Scientific Reports, 2019,9(1).DOI:10.1038/ s41598-019-52013-y.
[27] Liu J, Du Y, Sun W, et al. Preparation of new adsorbent-supported Fe/Ni particles for the removal of crystal violet and methylene blue by a heterogeneous Fenton-like reaction [J]. Rsc Advances, 2019,9(39): 22513-22522.
[28] Wu D, Feng Y, Ma L. Oxidation of Azo Dyes by H2O2in Presence of Natural Pyrite [J]. Water air and soil pollution, 2013,224(2):1-11.
[29] Chen H, Zhang Z, Yang Z, et al. Heterogeneous Fenton-like catalytic degradation of 2,4-dichlorophenoxyacetic acid in water with FeS [J]. Chemical Engineering Journal, 2015,273:481-489.DOI:10.1016/ j.cej.2015.03.079.
[30] Guo C, Tong X, Guo X Y. Solvothermal synthesis of FeS2nanoparticles for photoelectrochemical hydrogen generation in neutral water [J]. Materials Letters, 2015,161:220-223.DOI:10.1016/j.matlet. 2015.08.112.
[31] Stucki J W. The Quantitative Assay of Minerals for Fe2+and Fe3+Using 1,10-Phenanthroline: II. A Photochemical Method1 [J]. Soil Science Society of America Journal, 1981,45(3):633-637.
[32] Li D, Zhu X, Zhong Y, et al. Abiotic transformation of hexabromocyclododecane by sulfidated nanoscale zerovalent iron: Kinetics, mechanism and influencing factors [J]. Water Research, 2017,121:140.DOI:10.1016/j.watres.2017.05.019.
[33] Zeng L Y, Gong J Y, Dan J F, et al. Novel visible light enhanced Pyrite-Fenton system toward ultrarapid oxidation of p-nitrophenol: Catalytic activity, characterization and mechanism [J]. Chemosphere, 2019,228:232-240.DOI:10.1016/j.chemosphere.2019.04.103.
[34] 曾令玉.黄铁矿(FeS2)异相Fenton反应催化氧化对硝基酚的研究 [D]. 武汉:华中科技大学, 2019.
Zeng L Y. Study on catalytic Oxidation of P-nitrophenol in heterogeneous Fenton reaction of FeS2. [D]. WuHan: HuaZhong University of Science and Technology, 2019.
[35] Yamashita T, Hayes P. Analysis of XPS spectra of Fe2+and Fe3+ions in oxide materials [J]. Applied Surface Science, 2008,254(8):2441-2449.
[36] 吕源财.纳米零价铁钯/微生物联合体系降解2,2',4,4'-四溴联苯醚的研究 [D]. 广州:华南理工大学, 2016.
Lv Y C. Degradation of 2,2',4,4' -tetrabromobiphenyl ether by nanometer zero-valent ferro-palladium/microorganism system [D]. GuangZhou: South China University of Technology, 2016.
[37] Hou L, Zhang Q H, Jéromr F, et al. Shape-controlled nanostructured magnetite-type materials as highly efficient Fenton catalysts [J]. Applied Catalysis B Environmental, 2014,144:739-749.DOI:10.1016/ j.apcatb.2013.07.072.
[38] 杨智临.铁基材料产羟基自由基特征与除砷机制 [D]. 北京:中国地质大学, 2020.
Yang Z L. Hydroxyl radical production and arsenic removal mechanism of iron based materials [D]. BeiJing: China University of Geosciences, 2020.
[39] Zhang Y, Zhou Z, Wen F, et al. A flower-like MoS2decorated MgFe2O4nanocomposite: Mimicking peroxidase and colorimetric detection of H2O2and glucose [J]. Sensors and Actuators B-Chemical, 2018,275:155-162.DOI:10.1016/j.snb.2018.08.051.
[40] 陈亚明.Fe0及其硫化改性制备FeSx/Fe0去除水中Cr(Ⅵ)的研究 [D]. 济南:山东大学, 2016.
Chen Y M. Fe0and sulfide modified synthesis FeSx/Fe0removing Cr (Ⅵ) research [D]. JiNan: Shandong University, 2016.
[41] Bae S, Kim D, Lee W. Degradation of diclofenac by pyrite catalyzed Fenton oxidation [J]. Applied Catalysis B Environmental, 2013, 134-135(9):93-102.
[42] 李春娟.芬顿法和类芬顿法对水中污染物的去除研究 [D]. 哈尔滨:哈尔滨工业大学, 2009.
Li C J. Research on the Removal of pollutants in water by Fenton method and Fenton-like Method [D]. HaErBin: Harbin Institute of Technology, 2009.
[43] GB3838-2002 地表水环境质量标准 [S].
[44] Min X, Li Y, Ke Y, et al. Fe-FeS2adsorbent prepared with iron powder and pyrite by facile ball milling and its application for arsenic removal [J]. Water Science and Technology, 2017,76(1):192-200.
[45] Che H, Bae S, Lee W. Degradation of trichloroethylene by Fenton reaction in pyrite suspension [J]. Journal of Hazardous Materials, 2011,185(2):1355-1361.
[46] 朱国鹏.Fe3O4@MoS2量子点光辅助芬顿技术处理四环素废水的研究 [D]. 长春:吉林大学, 2020.
Zhu G P. Study on treatment of tetracycline Wastewater by Fe3O4@MoS2Quantum dot Light Assisted Fenton Technology [D]. ChangChun: Jilin University, 2020.
[47] 刘 杰.纳米Fe3O4及其复合材料催化过氧化物去除水中氯酚的研究 [D]. 哈尔滨:哈尔滨工业大学, 2014.
Liu J. Catalytic removal of chlorophenol from water by nanometer Fe3O4and its composites [D]. HaErBin: Harbin Institute of Technology, 2014.
[48] Wu D, Chen Y, Zhang Y, et al. Ferric iron enhanced chloramphenicol oxidation in pyrite (FeS2) induced Fenton-like reactions [J]. Separation and Purification Technology, 2015,154:60-67.DOI:10. 1016/j.seppur.2015.09.016.
[49] 周 洋.基于黄铁矿的非均相类-Fenton反应高效降解邻苯二甲酸二乙酯的机制研究 [D]. 芜湖:安徽师范大学, 2019.
Zhou Y. Degradation of diethyl phthalate by Heterogeneous Fenton reaction based on pyrite [D]. WuHu: AnHui Normal University, 2019.
Fe3O4/FeS2activated H2O2degradation of typical phenylarsonic acid pollutants.
HUA Jie, WANG Min, LIN Shu-ting, JIANG Yan-ting, LIN Chun-xiang, LV Yuan-cai*, LIU Ming-hua
(Department of Environmental Science and Engineering, Fuzhou University, Fuzhou 350108, China)., 2021,41(6):2646~2656
Fe3O4/FeS2catalyst was successfully prepared by hydrothermal method, and employed to mediate a heterogeneous Fenton system for the remediation of a typical phenylarsonic acid pollutant (roxarsone, ROX). The characterization results of XRD, SEM, XPS and magnetic measurement system (VSM) showed that Fe3O4/FeS2displayed evident granular particles and good magnetic properties. The results of ROX degradation experiments showed that under optimal conditions (4.5of the initial pH, 20mg/L of ROX initial concentration, 0.15g/L of Fe3O4/FeS2dosage and 0.034g/L of H2O2concentration), the heterogeneous Fenton system could instantaneously degrade 96.74% of ROX in 1min, which was much better than of the systems mediated by sole Fe3O4or FeS2. In addition, Fe3O4/FeS2could be effectively recycled by magnets, and also exhibited good reusability. After 3 runs, the degradation efficiency of ROX was still over 80%. Mechanism analysis revealed that plenty of hydroxyl radicals (×OH) could be generatedthe catalytic reaction between Fe3O4/FeS2and H2O2. Subsequently, the×OH could quickly attacked the C-As, C-N, and C-C bonds in the ROX molecule, resulting in the dearsenication, denitrification and ring opening reactions, as well as the formation of a series of organic products (such as phenols, quinones, small molecular organic acids, etc.) and inorganic products (As(V) and NO3-). Finally, the released inorganic arsenic could be adsorbed on the surface of the catalyst, while the organic product was further mineralized.
Fe3O4/FeS2;H2O2;phenarsonic acid;heterogeneous catalysis;arsenic adsorption
X703.5
A
1000-6923(2021)06-2646-11
华 洁(1995-),女,四川简阳人,福州大学硕士研究生,主要从事非均相氧化技术降解有机污染物.发表论文1篇.
2020-11-08
国家自然科学基金资助项目(51908132);福建省自然科学基金资助项目(2018J05017)
* 责任作者, 讲师, yclv@fzu.edu.cn
