N. europaea/Nc. mobilis谱系在垃圾渗滤液处理中的脱氨贡献
2021-07-23熊英,向斯,程凯
熊 英,向 斯,程 凯
./.谱系在垃圾渗滤液处理中的脱氨贡献
熊 英1,2,向 斯1,2,程 凯1*
(1.湖北工业大学资源与环境工程学院,河湖生态修复与藻类利用湖北省重点实验室,湖北 武汉 430068;2.武汉凯诺金环境生物科技有限公司,湖北 武汉 430068)
为了解垃圾渗滤液处理系统中菌群结构与脱氨效果的关系,采用16S rRNA基因高通量测序技术分析了15个实际垃圾渗滤液处理系统中的自养氨氧化细菌(AOB)的群落结构,监测了其中1个处理系统中的AOB群落结构的周年变化,并采集实际垃圾渗滤液开展了为期45d的模拟试验.结果表明,属是垃圾渗滤液处理系统中的优势自养氨氧化细菌,其相对丰度与脱氨活性呈显著正相关(<0.05).在此菌属中,和的相对丰度与脱氨活性显著正相关(<0.05),这3种菌在系统发育上同属于/谱系,说明该谱系是实际垃圾渗沥液处理系统中的优势AOB类群,并对垃圾渗滤液脱氨有重要贡献.
垃圾渗滤液;氨氧化;二代测序;生物多样性
生物法是现阶段国内外污水处理技术的核心,而微生物的氨氧化是其中的重要组成部分[1],具有氨氧化功能的微生物主要包括自养氨氧化细菌(AOB)[2]、异养氨氧化细菌[3]、厌氧氨氧化细菌[4]和氨氧化古菌[5-6]等,其中,AOB是众多实际污水处理系统中氨氧化的主要菌群[2,7].根据细胞形态和胞质内膜结构的不同可将AOB分为亚硝化单胞菌属()、亚硝化螺菌属()、亚硝化球菌属()、亚硝化叶菌属()和亚硝化弧菌属()等5个属[7].在现有的污水处理系统中,属和属是最为常见的2个属[2,8],其中又以属对氨氧化的贡献最大[2,9].如Wagner等[10]认为(该菌在系统发育上属于属)是高氨氮污水处理系统中AOB的优势菌;Mobarry等[11]发现在活性污泥和生物膜样品中,属是AOB中的优势菌属;Purkhold等[8]也发现市政和印染废水中AOB的优势属也是属.
垃圾渗滤液成分复杂、水质水量变化大,含有高浓度的氨氮、难降解有机物和重金属.以往对于垃圾渗滤液处理系统中氨氧化菌群结构的研究主要集中在解析不同处理工艺、渗滤液的成分、温度、溶解氧和光照等的影响,如Xiong等[12]通过在实验室内模拟的移动床生物膜反应器(MBBR)中,接种市政污水处理厂中的活性污泥处理成熟垃圾渗滤液,发现的相对丰度与脱氨活性有一定的关系;Isaka等[13]在实验室气升式反应器中,通过固定化微生物处理垃圾渗滤液,发现在低温环境(10℃)下,属是垃圾渗滤液氨氧化阶段的主要微生物;Chen等[1]在实验室采用缺氧-好氧-好氧-缺氧AOOA工艺处理实际垃圾渗滤液,将反应器中的溶解氧长期控制在低水平(0.1mg/L)时,发现主要由属积累亚硝酸盐;孙洪伟等[14]在实验室内采用单级上流式厌氧污泥床-序批式活性污泥法(UASB—SBR)联用工艺处理实际垃圾渗滤液,发现AOB中以属和属为主.如上所述,虽然有部分研究认为某些AOB菌“属”在垃圾渗滤液中分布较广,但对具体AOB菌“种”的分布规律尚缺乏认识,其与脱氨活性的关系也不清楚,特别是上述研究通常都是对实验室内的模拟垃圾渗滤液处理系统[1,15-17]或少数几个实际垃圾渗滤液处理系统[18]研究所得,缺乏较大空间和时间尺度的系统调查,故难以全面评价具体AOB菌种在实际垃圾渗滤液处理系统中的贡献.
本文采用16S rRNA基因高通量测序技术,分析了来源于15个实际垃圾渗滤液污水处理系统的AOB菌群结构,监测了其中1个处理系统中AOB菌群结构的周年变化,并采用实际垃圾渗滤液开展了为期45d的模拟试验,有助于精细评价不同AOB菌种在实际垃圾渗滤液处理系统中的贡献.
1 材料和方法
1.1 不同垃圾渗滤液处理系统的调查
1.1.1 样品来源 从湖南会同(S1)、麻阳(S2)、靖州(S3)、通道(S4)、安江(S5)、洪江(S6)、益阳(S7)、怀化(S8)、溆浦(S9)、芷江(S10)、宜章(S11)、郴州(S12)和澧县(S13),四川大英(S14)和威远(S15)等地(图1)垃圾渗滤液处理站的一级好氧池分别采集了15个泥水混合物样品.这些垃圾渗滤液处理站均采用非膜法处理工艺,生化系统则主要采用SBR- AOAO工艺,处理量为50~300m3/d,进水氨氮浓度为400~1300mg/L.

图1 采样点的分布
1.1.2 脱氨速率的测定 分别取100mL样品装入250mL锥形瓶,于31℃,200r/min振荡培养,0和24h时测氨氮浓度并计算脱氨速率[mg/(L×h)],计算公式如下:

式中:C表示24h的氨氮浓度,mg/L;0表示0h的氨氮浓度,mg/L.
1.1.3 AOB菌群结构分析 使用DNA提取试剂盒从采集的15个泥水混合物样品中提取DNA,使用Qubit® dsDNA HS Assay Kit 检测DNA浓度.16S rRNA基因序列V3和V4区的PCR扩增以20~30ng DNA为模板,上/下游引物[19]分别为CCTACGG- RRBGCASCAGKVRVGAAT和GGACTACNVGG- GTWTCTAATCC,反应体系为25μL:Takara taq酶(15U/μL) 0.5μL;缓冲液2.5μL;dNTP混合液 (2.5mmol/L) 2μL;模板 20ng;上下游引物各1μL;超纯水18μL.反应条件:94℃预变性3min;94℃变性5s; 57℃退火90s;72℃延伸10s;24个循环;72℃最终延伸5min.PCR产物采用基于Illumina平台的16S rRNA宏基因组测序(苏州金唯智),最终得到的序列使用VSEARCH(1.9.6)进行序列聚类(序列相似性设为97%),再用RDP classifier贝叶斯算法对OTU的代表性序列进行物种分类学统计(分类到属).进一步,对于能够分类到属的结果,其序列再经Blastn比对后,按相似度大于99%的标准分类到种[20].
1.2 湖南芷江某垃圾填埋场的周年监测
1.2.1 样品来源 样品取自湖南芷江某垃圾渗滤液处理站的一级好氧池,取样时间为2017年4月~2018年4月,取样间隔为2个月,分析其AOB菌群结构.
1.2.2 脱氨速率的测定 根据该处理站一级好氧池每日的进水流量、进水氨氮浓度和出水氨氮浓度,计算月平均脱氨速率,计算公式如下:


1.3 模拟垃圾渗滤液处理系统搭建与监测
1.3.1 模拟反应装置的搭建与运行 如图2所示,模拟反应装置主体材质为PVC,有效容积为10L.进水流量根据出水氨氮浓度调整(进水速度为(5.5± 3.3)L/d,对应的水力停留时间为27~111h),溶解氧控制为0.5~2.0mg/L,环境温度控制为30℃以促进亚硝化[21],pH值为7.6~8.5;出水经沉淀后的活性污泥的回流比为150%~200%.试验共运行45d,每天监测进出水的氨氮和亚硝酸盐氮浓度、反应器内溶解氧量和pH值.还采集了第3, 13, 25, 35, 45d的活性污泥样品,分析其AOB菌群结构.

图2 试验装置示意
1.3.2 试验用水和接种污泥 试验所用垃圾渗滤液取自湖南芷江垃圾渗滤液处理站的一级好氧池,其基本水质如表1所示.所用污泥为好氧池剩余污泥压滤所得,其含水率为70%,接种至模拟反应装置后的SV30为30%.

表1 垃圾渗滤液的水质情况
1.4 检测与计算方法
氨氮的测定采用纳氏试剂比色法,亚硝酸盐氮的测定采用N-(1-奈基)-乙二胺光度法[22],DO和pH值采用YSI Pro Plus多参数水质测量仪测定.
通过SPSS Statistics 22.0进行相关分析,用Origin 8.0软件作图.
2 结果与讨论
2.1 垃圾渗滤液处理系统的AOB群落结构
如表2所示,在15个不同垃圾渗滤液处理站的活性污泥中,MLSS的波动范围为0.30~11.38g/L, AOB占总菌的相对丰度的波动范围为0.20%~ 28.98%,其中:大多数自养氨氧化菌属占AOB的平均比例均低于1%,但科的属和属在AOB中的平均占比分别高达87.24%和9.54%,特别是,在其中12个来源的样本中,属占AOB的比例超过了90%.进一步的分析还表明,和是属的主要成员,它们在属的平均占比分别为26.67%和45.24%.此外,这2种菌在属中的占比波动范围较大(0~100%),考虑到这15个污水处理站的生化处理工艺是相似的,推测造成此差异的主要原因是各污水处理站的进水水质及具体的运行操控方法[23].

表2 不同采样点的AOB相对丰度(%)
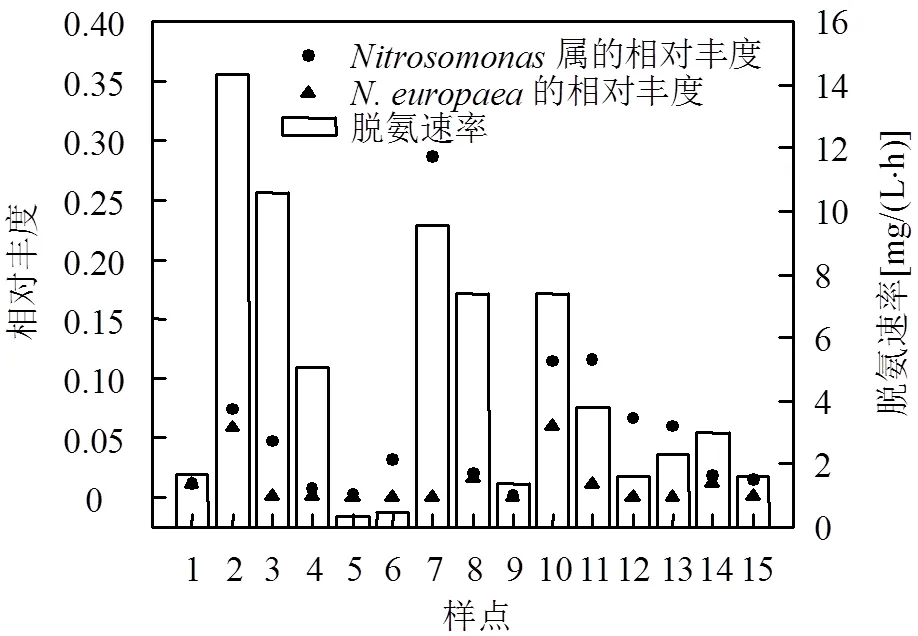
图3 不同采样点的脱氨速率及主要AOB的相对丰度
由图3可见,脱氨速率的波动范围为0.5~ 14.3mg/(L×h),平均值为4.7mg/(L×h).进一步的相关分析表明,脱氨速率不但与AOB占总菌的相对丰度及属占总菌的相对丰度显著正相关(<0.05),也与占总菌的相对丰度显著正相关(<0.05),而与属和占总菌的相对丰度无显著相关(分别为0.834和0.829).
2.2 某垃圾填埋场污水处理系统AOB群落结构的周年变化
如表3所示,AOB占总菌的相对丰度波动范围为0.62%~3.66%,其中大多数自养氨氧化菌属占AOB的平均比例均低于1%,但属在AOB中的平均占比高达82.42%,同时,从9月份开始,属占AOB的比例均超过了90%.进一步分析还发现,、和是属的主要成员,其在属的平均占比分别为30.45%、40.43%和26.47%.

表3 不同月份样品中的AOB相对丰度(%)

图4 不同月份的脱氨速率与主要AOB的相对丰度
由图4可见,脱氨速率的波动范围为8.1~ 12.4mg/(L×h),平均值为9.6mg/(L×h).进一步的相关性分析表明,脱氨速率不但与AOB占总菌的相对丰度及属占总菌的相对丰度显著正相关(<0.05),也与占总菌的相对丰度显著正相关(<0.05),而与和占总菌的相对丰度无显著相关性(分别为0.734和0.852). 此外,这3种菌在属中的占比波动范围也较大(0~99.61%),推测其原因除了包括进水水质变化和运行操控方法外,还可能受水温的影响[24].
2.3 模拟垃圾渗滤液处理系统中脱氨活性与AOB群落结构
表4显示,AOB占总菌比例的波动范围为0.54%~2.17%,其中:大多数自养氨氧化菌属占AOB的平均比例均低于1%,仅属在AOB中的平均占比高达86.43%.进一步的分析还表明,、和是o属的主要成员,其在属的平均占比分别为35.36%、32.41%和29.20%.

表4 反应器中AOB相对丰度(%)
由图5可见,出水亚硝酸盐氮浓度的波动范围为0.2~184.2mg/L,平均值为32.7mg/L.进一步的相关性分析表明,出水亚硝酸盐氮浓度不但与AOB占总菌的相对丰度及属占总菌的相对丰度显著正相关(<0.05),也与占总菌的相对丰度显著正相关(<0.05),而与和占总菌的相对丰度无显著相关性(分别为0.129和0.216).
采用高通量测序技术对15个实际垃圾渗滤液处理系统的系统调查、湖南芷江某垃圾填埋场的周年监测以及模拟垃圾渗滤液处理系统中的AOB菌群结构分析,发现属占AOB的平均比例超过了80%,是AOB中的优势属.而近年来针对垃圾渗滤液的研究则多基于单个污水处理系统或室内模拟处理装置,如何晓红等[25]采用变性梯度凝胶电泳(PCR-DGGE)技术,对实验室内模拟的连续式好氧硝化混合反应器(CSTR)中活性污泥进行菌群结构分析,发现了属是AOB中的优势属;曾薇等[26]采用PCR-DGGE技术对实验室内模拟的UASB-A/O反应器中活性污泥进行菌群结构分析,发现属是AOB中的优势属;Chen等[1]对实验室内AOOA反应器中的活性污泥中进行了分析,也发现了属是AOB中的优势属;王秀杰等[27]采用16S rRNA基因克隆文库技术分析了实验室内模拟的膜生物反应器(MBR)中的活性污泥的菌群结构,发现属占AOB的41.1%;Isaka等[13]采用PCR-DGGE和FISH技术分析了实验室内气升式反应器中活性污泥的菌群结构,发现属占AOB的60%;Kim等[17]通过荧光原位杂交(FISH)技术分析了实验室内BAF(生物滤池)反应器中菌群结构,也发现属占AOB的60%以上.表5对比了本研究与上述文献报道的异同:本研究在较大空间尺度和较长时间尺度上证明属是实际垃圾渗滤液处理系统中AOB的优势属,且优势度(占比平均超过80%)明显高于以往基于实验室模拟系统的研究(占比最高为60%,平均为42%).

图5 反应器中主要AOB的相对丰度与出水亚硝酸盐氮浓度
本研究还发现,AOB和属占总菌的相对丰度与脱氨速率(或出水亚硝酸盐氮浓度)呈显著正相关(<0.05).类似的,廖小兵等[30]利用荧光定量PCR技术对实验室内SBR反应器中AOB的含量变化进行分析,发现AOB的含量与脱氨活性有着显著正相关性.通常,污水处理系统中细菌的数量为1012~ 1013cells/L[31],而根据本文测出的AOB丰度(0.2%~ 29.0%)和氨氧化速率[0.46~14.34mg/(L×h)],可推算出本文中单个AOB细胞的氨氧化能力为2.3× 10-12~ 6.9×10-10mgN/cell/h,这与实际污水处理系统的研究结果是基本吻合的:Harms等[32]发现市政污水处理系统中单个AOB细胞的氨氧化能力范围为1.1×10-10~ 1.7×10-10mgN/(cell×h),Limpiyakorn等[31]对12个污水处理厂活性污泥的研究发现单个AOB细胞的氨氧化能力为不超过6.9×10-10mgN/(cell×h),而Gabarró等[16]也发现垃圾渗滤液处理系统中单个AOB细胞的氨氧化能力为1.8×10-11~6.0×10-11mgN/(cell×h).

表5 不同(模拟)垃圾渗滤液处理系统中的AOB群落结构比较
注:“—”表示未测定.
本研究的3个不同试验中脱氨速率(或出水亚硝酸盐氮浓度)分别与和占总菌的相对丰度显著正相关(<0.05),而这3种菌在系统发育上同属于/谱系[7].此前有少量研究表明该谱系在污水中较其它AOB更容易生长[12,33],如Limpiyakorn等[34]在实验室内的模拟高氨污水处理系统中,采用PCR-DGGE技术发现谱系是AOB中的优势菌,并发挥了主要的氨氧化作用;Siripong等[35]调查了7个不同生活污水处理厂,采用基于16S rRNA和基因的T-RFLP技术也发现谱系是低氨污水处理系统中的优势AOB,但该谱系在垃圾渗滤液中对高氨污水脱氨的贡献尚未见诸报道.本研究结果说明/谱系对垃圾渗滤液脱氨有重要贡献,究其原因,可能与该谱系的AOB具有较强的抗逆性有关:如该谱系中的的终端氧化酶具有高度的多样性,其基因组也编码有多种重金属的抗性基因[36],导致其能够适应垃圾渗滤液这种污染成分复杂的高氨污水.此外,生态分布较广的菌种通常具有较强的环境适应性,故其在生物增效(Bioaugmentation)工程中往往具有更好的效果[37].而本研究发现谱系在垃圾渗滤液中广泛分布,这为应用该谱系的微生物来提高垃圾渗滤液的脱氨效率[38]提供了理论支持.
3 结论
3.1属在AOB中的占比平均超过80%,/谱系在属中的占比平均超过55%,分别是实际垃圾渗沥液处理系统中AOB的优势属和优势谱系.
3.2/谱系中的、和的相对丰度与脱氨活性显著正相关,说明该谱系对垃圾渗沥液脱氨有重要贡献.
[1] Chen Z, Wang X, Yang Y Y,et alPartial nitrification and denitrification of mature landfill leachate using a pilot-scale continuous activated sludge process at low dissolved oxygen [J]. Bioresource Technology, 2016,218:580-588.
[2] Park H D, Noguera D R. Evaluating the effect of dissolved oxygen on ammonia-oxidizing bacterial communities in activated sludge [J]. Water Research, 2004,38(14):3275-3286.
[3] Duan S, Zhang Y, Zheng S. Heterotrophic nitrifying bacteria in wastewater biological nitrogen removal systems: A review [J]. Critical Reviews in Environmental Science and Technology, 2021,3:1-37.
[4] Zhang L, Okabe S. Ecological niche differentiation among anammox bacteria [J]. Water Research, 2020,171(15):115468.1-115468.14.
[5] Wu L, Chen X, Wei W, et al. A critical review on nitrous oxide production by ammonia-oxidizing archaea [J]. Environmental Science and Technology, 2020,54(15):9175–9190.
[6] Limpiyakorn T, Maria F, Thanasita C, et al. amoA-encoding archaea in wastewater treatment plants: a review [J]. Applied Microbiology and Biotechnology, 2013,97(4):1425-1439.
[7] Koops H P, Purkhold U, Andreas P R, et al. The lithoautotrophic ammonia-oxidizing bacteria [J]. Prokaryotes, 2006,5(2):778-811.
[8] Purkhold U, PommereningRöser A, Juretschko S,et alPhylogeny of all recognized species of ammonia oxidizers based on comparative 16S rRNA and amoA sequence analysis: implications for molecular diversity surveys. [J]. Applied and Environmental Microbiology, 2000, 66(12):5368-5382.
[9] Wells G F, Hee-Deung P, Chok-Hang Y, et alAmmonia-oxidizing communities in a highly aerated full-scale activated sludge bioreactor: betaproteobacterial dynamics and low relative abundance of Crenarchaea [J]. Environmental Microbiology, 2010,11(9):2310-2328.
[10] Wagner M, Noguera D R, Juretschko S,et al. Combining fluorescent in situ hybridization (fish) with cultivation and mathematical modeling to study population structure and function of ammonia-oxidizing bacteria in activated sludge [J]. Water Science and Technology, 1998, 37(4/5):441-449.
[11] Mobarry B K, Wagner M, Urbain V, et al. Phylogenetic probes for analyzing abundance and spatial organization of nitrifying bacteria. [J]. Applied and Environmental Microbiology, 1996,62(2):2156-2162.
[12] Xiong J Y, Zheng Z, Yang X Y, et al. Mature landfill leachate treatment by the MBBR inoculated with biocarriers from a municipal wastewater treatment plant [J]. Process Safety and Environmental Protection, 2018,119:304-310.
[13] Isaka K, Yoshie S, Sumino T. Nitrification of landfill leachate using immobilized nitrifying bacteria at low temperatures [J]. Biochemical Engineering Journal, 2007,37(1):49-55.
[14] 孙洪伟,郭 英,彭永臻,等.实际垃圾渗滤液短程生物脱氮的常温实现及低温维持[J]. 中国环境科学, 2013,33(11):1972-1977.
Sun H W, Guo Y, Peng Y Z, et alThe achievement of partial nitrification at normal temperature and maintenance at low temperature for real landfill leachate [J]. China Environmental Science, 2012,126(6):283-289.
[15] 孙洪伟,王淑莹,张树军,等.高氮渗滤液短程深度脱氮及反硝化动力学[J]. 环境科学, 2010,31(1):129-133.
Sun H W, Wang S Y, Zhang S J, et al. Advanced nitrogen removal via nitrite from landfill leachate with high nitrogen concentration and kinetics of denitritation [J]. Environmental Science, 2010,31(1):129- 133.
[16] Gabarró J, Ganigué R, Gich F, et alEffect of temperature on AOB activity of a partial nitritation SBR treating landfill leachate with extremely high nitrogen concentration [J]. Bioresource Technology, 2012,126(6):283-289.
[17] Kim D J, Lee D I, Keller J. Effect of temperature and free ammonia on nitrification and nitrite accumulation in landfill leachate and analysis of its nitrifying bacterial community by FISH [J]. Bioresource Technology, 2006,97(3):459-468.
[18] 李振山,邵 军,孙海美,等.垃圾渗滤液处理系统中微生物群落结构变化研究[J]. 北京大学学报(自然科学版), 2010,46(3):435-441.
Li Z S, Shao J, Sun H M, et alVariation of microbial community structures in landfill leachate treatment system [J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 2010,46(3):435-441.
[19] Guo R B, Fu S F, Wang F, et alImpacts of microaeration on the anaerobic digestion of corn straw and the microbial community structure [J]. Chemical Engineering Journal, 2016,287:523-528.
[20] Kim M, Oh H S, Park S C, et al. Towards a taxonomic coherence between average nucleotide identity and 16S rRNA gene sequence similarity for species demarcation of prokaryotes [J]. International Journal of Systematic and Evolutionary Microbiology, 2014,64(2): 346-351.
[21] 李 芸,熊向阳,李 军,等.膜生物反应器处理晚期垃圾渗滤液亚硝化性能及其抑制动力学分析[J]. 中国环境科学, 2016,36(2):419- 427.
Li Y, Xiong X Y, Li J, et al. Performance of nitritation process in membrane bioreactor for old landfill leachate and analysis of inhibition kinetics [J]. China Environmental Science, 2016,36(2): 419-427.
[22] 国家环境保护总局.水和废水监测分析方法[M]. 4版.北京:中国环境科学出版社, 2002.
State Environmental Protection Administration. Water and wastewater monitoring and analysis method [M]. 4th Ed. Beijing: China Environmental Science Press, 2002.
[23] 王 凯,武道吉,陈举欣,等.SBR处理渗滤液深度脱氮的影响因素研究[J]. 中国环境科学, 2016,36(11):3287-3294.
Wang K, Wu D J, Chen J X, et al. The influential factors of landfill leachate advanced nitrogen removal by SBR [J]. China Environmental Science, 2016,36(11):3287-3294.
[24] 王思萌,苗圆圆,彭永臻,等.低温投加短程硝化污泥下城市污水SPN/A工艺运行特性[J]. 中国环境科学, 2019,39(4):1456-1463.
Wang S M, Miao Y Y, Peng Y Z, et al. Operation characteristics of the SPN/A process for municipal wastewater under low temperature shortcut nitrification sludge [J]. China Environmental Science, 2019, 39(4):1456-1463.
[25] 何晓红,杨 暖,陶 勇,等.高浓度氨氮废水短程硝化及氨氧化菌群分析[J]. 应用与环境生物学报, 2013,19(2):313-317.
He X H, Yang N, Tao Y, et al. Shortcut nitrification of high ammonia concentration wastewater and ammonia-oxidizing bacterial community [J]. Chinese Journal of Appled and Environmental Biology, 2013,19(2):313-317.
[26] 曾 薇,杨 庆,张树军,等.采用FISH、DGGE和Cloning对短程脱氮系统中硝化菌群的比较分析[J]. 环境科学学报, 2006,26(5): 734-739.
Zeng W, Yang Q, Zhang S J, et al. Analysis of nitrifying bacteria in short-cut nitrification-denitrification processes by using FISH, PCR- DGGE and Cloning [J]. Acta Scientiae Circumstantiae, 2006,26(5): 734-739.
[27] 王秀杰,李 军,李 芸,等.晚期垃圾渗滤液MBR亚硝化系统中细菌及功能菌的多样性[J]. 北京工业大学学报, 2017,43(9):1416-1425.
Wang X J, Li J, Li Y, et al. Diversity of bacteria and functional bacteria in MBR shortcut nitrification system treating late landfill leachate [J]. Journal of Beijing University of Technology, 2017,43(9):1416-1425.
[28] 梁俊宇,周 鸿,赵 晴,等.垃圾渗滤液部分亚硝化的启动运行及菌群分析[J]. 水处理技术, 2018,44(3):99-103.
Liang J Y, Zhou H, Zhao Q, et al. Analysis of start-up, operation and microbial community during landfill leachate partial nitritation [J]. Technology of Water Treatment, 2018,44(3):99-103.
[29] Kulikowska D, Jóźwiak T, Kowal P, et alMunicipal landfill leachate nitrification in RBC biofilm – Process efficiency and molecular analysis of microbial structure [J]. Bioresource Technology, 2010, 101(10):3400-3405.
[30] 廖小兵,许玫英,邓代永,等.晚期垃圾渗滤液的部分亚硝化[J]. 环境工程学报, 2012,6(9):2918-2922.
Liao X B, Xu M Y, Deng D Y, et al. Partial nitrification of old landfill leachate [J]. Chinese Journal of Environmental Engineering, 2012, 6(9):2918-2922.
[31] Limpiyakorn T, Shinohara Y, Kurisu F, et al. Communities of ammonia-oxidizing bacteria in activated sludge of various sewage treatment plants in Tokyo [J]. FEMS Microbiology Ecology, 2005, 54(2):205-217.
[32] Harms G, Layton A C, Dionisi H M, et al. Real-time PCR quantification of nitrifying bacteria in a municipal wastewater treatment plant. [J]. Environmental Science & Technology, 2003, 37(2):343-351.
[33] Koops H P, Pommerening-Röser A. Distribution and ecophysiology of the nitrifying bacteria emphasizing cultured species [J]. FEMS Microbiology Ecology, 2001,37(1):1-9.
[34] Limpiyakorn T, Kurisu F, Sakamoto Y,et alEffects of ammonium and nitrite on communities and populations of ammonia-oxidizing bacteria in laboratory-scale continuous-flow reactors [J]. FEMS Microbiology Ecology, 2007,60(3):501-512.
[35] Siripong S, Rittmann B E. Diversity study of nitrifying bacteria in full-scale municipal wastewater treatment plants [J]. Water Research, 2007,41(5):1110-1120.
[36] Stein L Y, Arp D J, Berube P M, et alWhole-genome analysis of the ammonia-oxidizing bacterium,C91: implications for niche adaptation [J]. Environmental Microbiology, 2007,9(12):2993-3007.
[37] Thompson I P, Gast C J V D, Ciric L, et al. Bioaugmentation for bioremediation: the challenge of strain selection [J]. Environmental Microbiology, 2005,7(7):909-915.
[38] 熊 英,向 斯,程 凯.一株高适应性CZ-4的脱氨特性[J]. 中国环境科学, 2019,39(8):3365-3372.
Xiong Y, Xiang S, Cheng K. Nitrogen removal characteristics of a highly adaptableCZ-4 [J]. China Environmental Science, 2019,39(8):3365-3372.
The contribution oflineage to the deamination in full-scale landfill leachate treatment systems.
XIONG Ying1,2, XIANG Si1,2, CHENG Kai1*
(1.Hubei Key Laboratory of Ecological Restoration for River-Lakes and Algal Utilization for College of Resources and Environmental Engineering, Hubei University of Technology, Wuhan 430068, China;2.Wuhan Cyano-King Environmental Technology Co.Ltd, Wuhan 430068,China)., 2021,41(6):2602~2609
In order to study the relationship between the microbial community structure and the deamination effect in landfill leachate treatment systems, 16S rRNA high-throughput sequencing technology was used to analyze the community structure of autotrophic ammonia oxidizing bacteria (AOB) in 15 full-scale landfill leachate treatment systems. Meanwhile, the annual change of the community structure of AOB in one of the treatment systems was monitored. Moreover, a 45-day simulation test using real landfill leachate was carried out to study the deamination activity. The results showed thatwas the dominant AOB genus in landfill leachate treatment systems, and its relative abundance was positively correlated with the deamination activity (<0.05). Within the genus, the relative abundance of,and, which all belongs to thelineage, were positively correlated with deamination activity (<0.05). The results indicated that thelineage was the dominant AOB group in the full-scale landfill leachate treatment systems, and greatly contributed to the deamination in landfill leachate.
landfill leachate;ammonia oxidation;next-generation sequencing;biodiversity
X703.1
A
1000-6923(2021)06-2602-08
熊 英(1994-),女,湖北孝感人,湖北工业大学硕士研究生,主要研究方向为氨氧化微生物技术.发表论文1篇.
2020-10-15
国家科技重大专项(2017ZX07602002)
* 责任作者, 教授, chengkaicn@163.com
