非饱和带二氧化碳入侵对表生植物及土壤的影响
2021-07-23赵晓红王文科邓红章罗平平杨雨萌
潘 颖,赵晓红,王文科,邓红章,韩 枫,罗平平,杨雨萌,张 徽
(1.长安大学旱区地下水文与生态效应教育部重点实验室,陕西 西安 710054;2.长安大学建筑工程学院,陕西 西安 710061;3.中国地质调查局水文地质环境地质调查中心,河北 保定 071051)
环境中的CO2与全球气候变化、植物生长发育及人类健康安全息息相关,研究CO2的减排技术如地质碳储存(GCS)及CO2对生态环境的影响至关重要。在地震、火山爆发和采矿等干扰下,GCS可能会发生泄漏,高浓度CO2通过裂缝、地质断层或注水井向上移动并逃逸到地表环境中[1]。因此,CO2对地下水、土壤、植被、大气等环境的影响及其监测技术[2−5]备受关注。
过量的CO2对地下水可能会造成一系列影响,包括pH值降低[6−8],某些离子(如镉、镁、铅、砷、锌等)浓度发生变化[9],水体氧化还原电位的变化可能引发某些化学反应及改变一些污染物的生物活性[9−12]。有文献研究CO2渗流对土壤化学的影响,揭示了pH值、辉石、钠长石、石英等矿物,CaO、MgO、Fe2O3、Mn3O4等氧化物以及Mg、K、Ba、Al、Cr、Fe、Mn、Pb、Co等金属元素浓度的下降趋势[13−14]。
另外,大量研究关注了高浓度CO2对生态系统和表生植被的影响。CO2浓度升高会影响土壤酶、土壤呼吸、根系分泌物、微生物活性和群落结构[15−18]。Kruger等[19]研究了德国Leacher See天然陆地CO2排放口的植被和微生物种群,发现双子叶植物比单子叶植物对CO2注入更为敏感。有研究考察了自然产生的CO2对植物生长的影响,发现植株高度和CO2浓度之间存在很强的负相关[20]。此外,CO2浓度升高会对植物的光合作用、根呼吸和植物发育产生不利影响[21−22]。在诺丁汉大学校区的ASGARD(Artificial Soil Gasassing Response Detection)基地进行的类似研究表明:种子萌发率、生长响应与CO2浓度呈负相关关系[23]。West等[24]通过模拟CO2泄漏试验,发现单子叶植物比双子叶植物更耐胁迫,这也与其他研究结果[19,25- 26]一致。虽然这些研究探讨了土壤和生态系统对CO2入侵的响应,但很少进行系统、全面的模拟试验。
本研究利用长安大学渭水校区的CO2泄漏模拟试验平台,对当地选定的土壤和植物进行可控的CO2注入,研究高浓度CO2入侵非饱和带土壤对植物生长、光合作用、代谢作用和抗逆性的影响,探讨土壤理化性质的变化,评估CO2对生态环境安全的影响,同时寻找可用于监测CO2泄漏的潜在指示植物。
1 材料与方法
1.1 研究地点和试验控制系统
长安大学渭水校区水与环境原位试验场(图1)总面积13 300 m2,其中CO2模拟试验区2 190 m2,包括CO2混配系统、CO2监测塔和温室,可模拟和探索高浓度CO2对表生植物和土壤地球化学性质的影响。
图1(b)为温室,由4个单独室组成,每个室有15个木制试验样框,见图1(c)。通过试验框中圆形进气管从底部注入不同浓度的CO2,CO2浓度配比调控系统由计算机控制,可将高压气瓶中纯CO2和空气以不同的体积比混合,并按照设计的浓度及释放速率将CO2通过压缩机和配气管道输送到各个试验区。
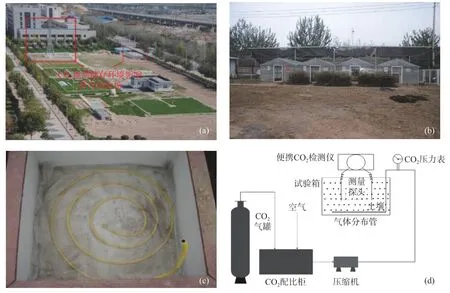
图1 原位试验场地总览(a)、温室(b)、温室试验框(c)及CO2入侵模拟试验流程图(d)Fig.1 Overview of the test field(a),the greenhouse(b),the plant plot(c)and the schema of CO2 transport system(d)
1.2 试验方法和样品采集
研究中使用的土壤采自鄂尔多斯GCS工程示范区。播种前,将土壤与一定量的有机肥料混合并充分搅拌均匀。此后,将温室中每个试验框装满相等重量的土壤,用相同体积的自来水浇灌保持20%~40%的水分。选择C3单子叶植物黑麦草和小麦,C3双子叶植物豌豆,C4单子叶植物玉米和C4双子叶植物苋菜,在4个温室60个试验框中播种,每种植物在同一温室内设置三个平行样。在植物生长期内(4月—11月),从试验框底部持续注入高浓度CO2。同一温室CO2浓度相同,不同温室浓度分别设定为5%、10%和15%(V/V),第四个温室作为对照组,没有注入CO2。
在植物生长周期期间,测量植株高度和叶片数,并在成熟时记录果实的重量和数目。取植物叶片样分析植物光合作用、代谢功能以及抗逆性变化。植物样品采集后保存在冰箱中,并在一周内完成测试分析。
土壤取样时将所有植物去除,从20~30 cm深度采集土壤样品,每个温室试验框中采点2~3处,每个框均采集,后将土壤样混合均匀,最终形成4份土壤样品,分别标记为X0、X5、X10、X15(分别代表注入0、5%、10%和15%的 CO2)。将收集的土壤样品风干并通过200目筛网过筛除去大的根茎及颗粒,存储在干净袋子中,进行测试和分析。
1.3 指标及测试方法
1.3.1 植物生理生化指标
使用标准方法测量植株高度和叶片数。挑选新鲜的植物样品进行生理生化指标测试:抗逆性指标包括过氧化氢酶(CAT)、过氧化物酶(POD)、超氧化物歧化酶(SOD)、脯氨酸(PRO)和丙二醛(MDA);光合作用指标包括叶绿素a、b和类胡萝卜素;代谢功能指标包括可溶性蛋白质和糖。所有测量均根据标准方法进行[27]。
1.3.2 土壤理化性质
土壤pH值通过标准脱CO2水萃取法(水土比为2.5∶1)使用pH计测定[28]。按照标准程序,使用全自动凯氏定氮仪(Foss 8 400,丹麦)测量总氮(TN),使用间断化学分析仪(ADA,CleverChem200,德国)分析氨(NH+4)、硝酸盐(NO−3)、总磷(TP)和有效磷(AP)。采用火焰光度计(6400A,德国)测试总钾(TK)和有效钾(AK)。通过X射线衍射仪(XRD)(D / MAX-3C,日本)研究土壤矿相组成变化,并通过元素分析仪(VarioELⅢ,德国)测量土壤总碳(TC)及有机碳(TOC)。
2 试验结果与讨论
2.1 CO2入侵对表生植物的影响
2.1.1 发芽率和表观性状
选择豌豆作为目标植物,在发芽的第10天进行测试。图2为4种植物在生长过程中的表观形状。可以看出:在对照区和CO2浓度为5%、10%和15%的土壤中,豌豆的发芽率分别为90%、82%、69%、46%,发芽率与CO2浓度之间存在直接的负相关关系。植物在对照土壤中生长良好,茎较高,叶片颜色较深,密度也较高。在高CO2浓度下,植物的生长受到显著抑制,特别是豌豆。

图2 不同浓度CO2入侵下植物的生长状况(从上到下:小麦、玉米、黑麦草、豌豆)Fig.2 The pictures of plants(from top to bottom: wheat,corn,ryegrass and pea)
2.1.2 植物生长和果实质量
在植物生长中期测量株高和叶片数,结果如图3(a)(b)所示。可以看出,玉米和苋菜高度受CO2影响最明显,玉米在5%区域中最低,较对照区低44.94%,但在不同CO2浓度下高度没有明显差异;苋菜在10%区域高度最低,比对照组低约45.45%。黑麦草和豌豆高度在其他浓度区变化不大,在15%时株高最低,分别低于对照19.15%和7.8%。值得注意的是,随着CO2浓度的增加,豌豆高度也有小幅增加的趋势,在10%达到最高。
小麦和豌豆的叶片数随着CO2浓度的增长没有显著变化,而黑麦草的叶片数有适度增加。玉米和苋菜的叶片数在5%和10% CO2浓度区下分别比对照区低20%和46.15%。
收获小麦和豌豆果实以测定其重量和数量,结果如图3(c)(d)所示。对照区的小麦果实总重量达到40 g,而其他CO2浓度区的小麦果实的重量不到5 g;豌豆荚的重量和数量与CO2浓度呈负相关,相关系数分别为0.912和0.981。

图3 植株高度(a)、叶片数量(b)、果实质量(c)及颗粒数(d)等的生长情况Fig.3 Plant growth analysis including plant height(a),plant leaf number(b),fruit weight(c) and fruit quantity(d)
2.1.3 植物光合作用
如图4所示,黑麦草、豌豆和玉米的叶绿素a在浓度为5%的CO2影响下增加,后随CO2浓度升高而降低;小麦和苋菜中叶绿素a含量随着CO2浓度升高先下降后升高。与叶绿素a相比,叶绿素b和类胡萝卜素的含量很低,在CO2干扰下变化不大,尤其是类胡萝卜素。总体上,CO2浓度对黑麦草、小麦和苋菜光合作用的影响是显而易见的,对豌豆和玉米的影响相对较弱。在高CO2浓度下叶绿素含量增加,表明适度CO2可以促进植物的光合作用。
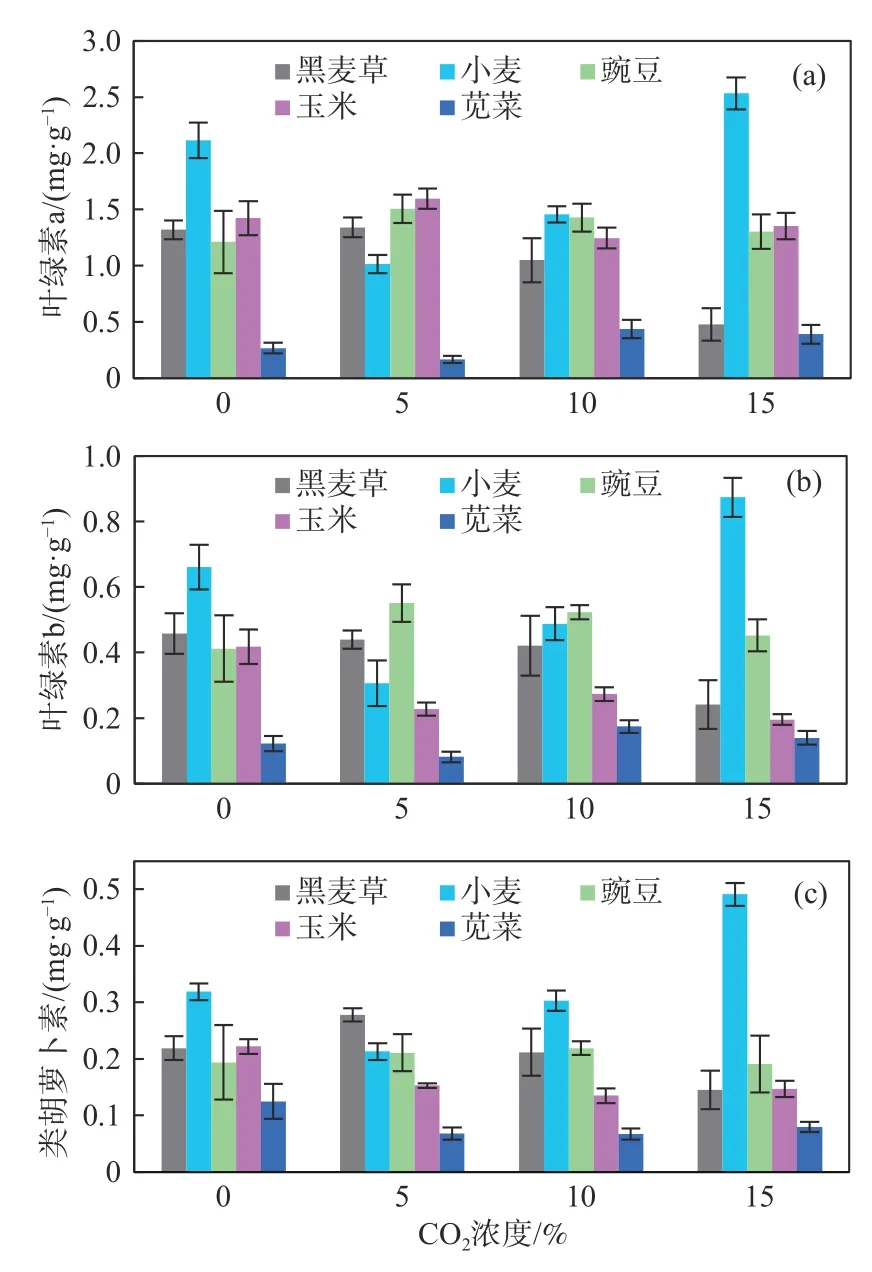
图4 不同CO2浓度下植物的光合作用指标Fig.4 Photosythesis of plants under CO2 exposure
2.1.4 植物代谢功能
蛋白质对细胞和生物的生命活动十分重要。在植物细胞中,可溶性蛋白对植物具有特异性调节代谢和脱水保护作用[29],植物可通过合成更多的可溶性蛋白质以降低渗透压,维持细胞充沛并减少伤害[30−31]。表1为5种植物在不同CO2浓度影响下可溶性蛋白质浓度。可以看出,不同植物表显著下降,但当CO2分别达到10%和15%后,基本保持稳定;玉米和苋菜叶片中蛋白质含量分别在15%和10%出现最大值,比对照组总体含量增加;豌豆的蛋白质含量有一定的下降,但变化幅度不大。
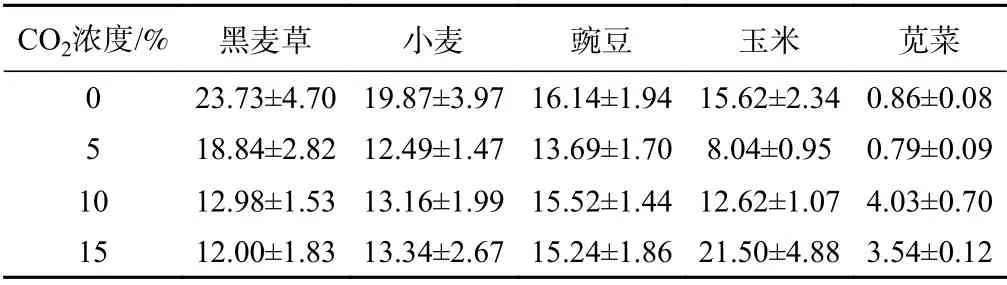
表1 不同CO2浓度下植物的可溶性蛋白浓度Table 1 Soluble protein concentrations of the plants under CO2 exposure/(mg·g−1)
可溶性糖是新陈代谢的主要产物,对调节植物的生长、发育、成熟、衰老和抗逆性,以及对渗透调节和蛋白质储存至关重要[32]。通常,在环境压力下会观察到植物中糖类含量的增加,以平衡渗透压、减少水分流失、维持植物的生长[33]。如表2所示,随着CO2浓度的增加,所有植物中的可溶性糖含量均有所增加,黑麦草和小麦中的可溶性糖含量远高于玉米、豌豆和苋菜。另外,当CO2浓度为5%时,黑麦草和小麦的含糖量已明显增加;豌豆和玉米在10%下才开始增加,苋菜在15%时变化较明显。
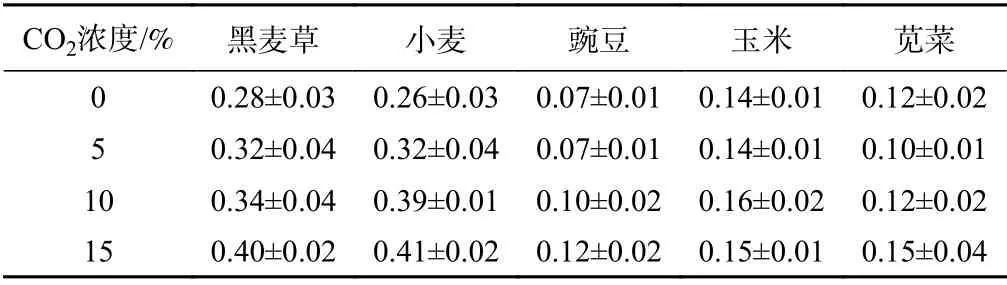
表2 不同CO2浓度下植物的可溶性糖浓度Table 2 Soluble saccharide concentrations of the plants under CO2 exposure/(μmol·g−1)
2.1.5 植物抗逆性
正常情况下植物体内自由基维持在浓度很低的水平,当遭受某种环境胁迫时自由基就会增多,而SOD、CAT、POD等酶活性的增强可以清除超氧自由基、H2O2和过氧化物[34],减少生物所受的伤害。
图5显示,除苋菜外,其他植物中的POD远高于SOD和CAT。与对照组相比,黑麦草在15% CO2影响下,SOD、CAT的活性有所降低,POD总体升高;小麦中的SOD活性没有明显变化,CAT、POD先降低后升高;豌豆中的SOD、CAT、POD变化不明显,说明其对外界胁迫的敏感性较低;玉米中的SOD、CAT浓度相似,对CO2不敏感,但在5%时POD显著增加,随后急剧下降;苋菜体内的SOD、CAT、POD含量最低,在CO2浓度增加时,SOD降低,CAT先升高,然后保持稳定,而POD无明显变化。
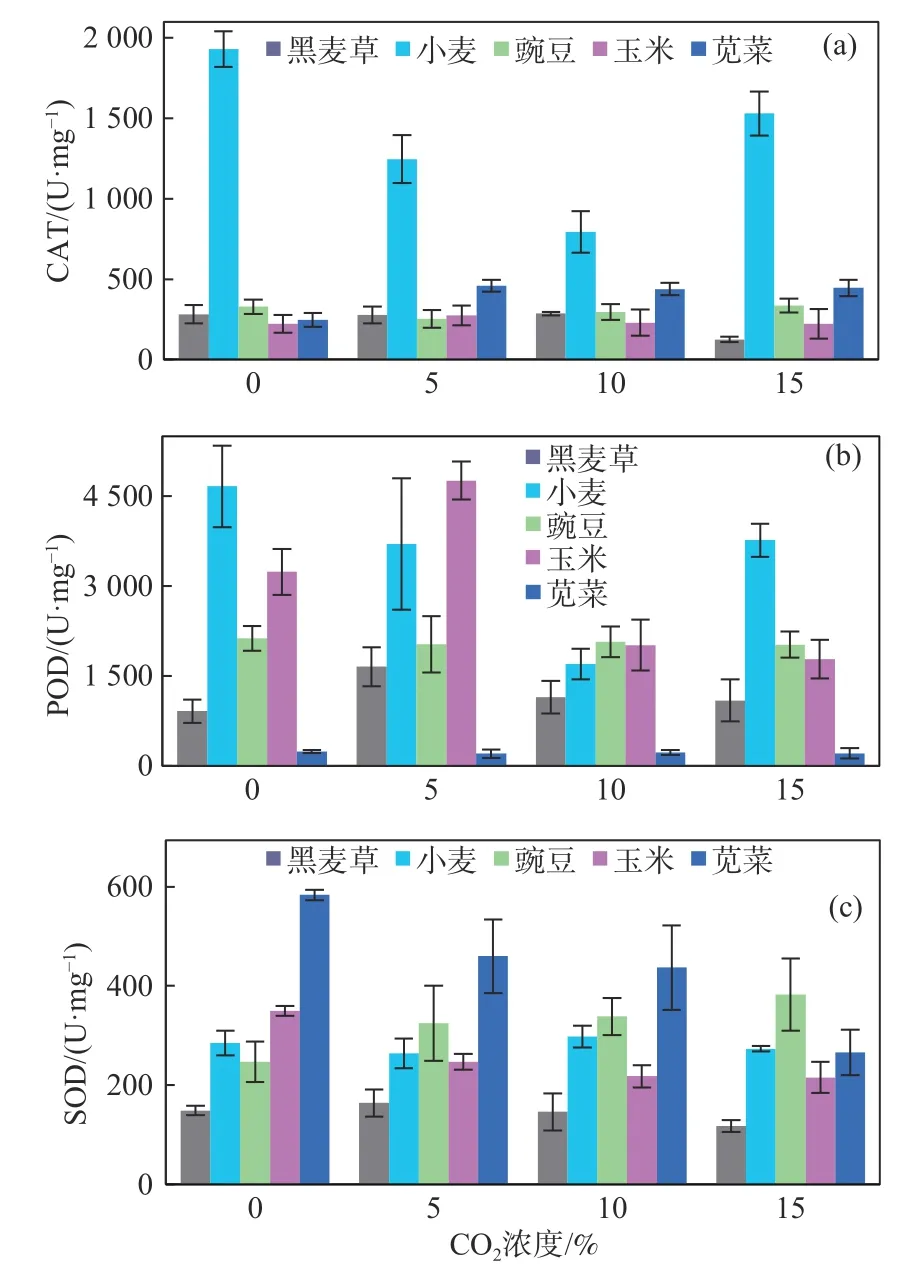
图5 不同CO2浓度下植物的抗氧化酶活性Fig.5 Antioxidant enzyme activity of plants under the CO2 exposure
植物在处于压力和衰老的状态下产生自由基,会导致膜脂质过氧化作用增强[35]。MDA是膜脂质过氧化过程中的重要产物,严重影响膜的健康,因此MDA可用作评估膜脂过氧化水平的指标[35−36]。如表3所示,所有植物中的MDA浓度都非常低。在CO2浓度增加的情况下,黑麦草,小麦,豌豆和玉米中的MDA浓度呈上升趋势,且在15%和10%时,黑麦草和小麦的MDA显著增强。苋菜中的MDA含量相对稳定。

表3 不同CO2浓度下植物的丙二醛浓度Table 3 MDA concentrations of the plants under CO2 exposure/(μmol·g−1)
PRO是植物蛋白的一种成分,广泛存在于植物的各个部位,包括根、茎、叶、花和果实[37]。当植物遭受干旱、寒冷、高温和盐分等胁迫时,调节渗透的PRO浓度将增加,以降低水势和伤害。从表4中可以看出,黑麦草中的PRO随CO2浓度的增加而降低,在CO2达到10%后急剧下降;小麦没有明显的变化趋势,总体上PRO浓度下降;豌豆中PRO含量随CO2浓度升高增加明显;玉米在5%时增加31.4%,但在较高的CO2浓度下又迅速下降;苋菜中PRO含量减少,在10%条件下含量处于最小值,比对照组减少了64%。
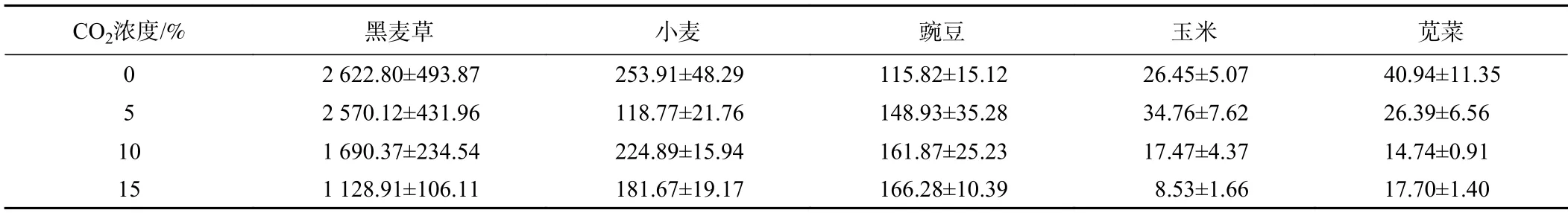
表4 不同CO2浓度下植物的脯氨酸浓度Table 4 Proline concentrations of the plants under CO2 exposure/(mg·g−1)
2.2 土壤理化性质
土壤pH值是土壤理化性质的重要参数,通常在pH值小于4或大于9时,植物的代谢功能会受到抑制或破坏。此外,pH值也会影响植物对Ca、Mg、N、P和K等离子的吸附。本研究中,原始风干土壤(对照区)的pH为8.85。在注入CO2后,5%、10%和15%浓度区的pH分别为8.98,9.10,9.12,表明风干土壤pH值随CO2浓度的增加而略微升高。
如图6所示,土壤中的TN和TC浓度范围分别在0.2~0.24 g/kg和14.18~16.25 g/kg之间,并且随着CO2浓度的增加而降低,最大降幅分别为16.7%和12.7%。土壤中NH+4(0.73~13.12 mg/kg)和NO−3(2.35~18.09 mg/kg)含量较低,但在5%和10%时NH+4含量有明显升高,硝酸盐总体上与总氮的变化一致。土壤中的TP含量为0.505~0.543 g/kg,CO2入侵可导致TP浓度略微升高;AP的占比很低,仅为TP的2%~2.6%,在CO2入侵的条件下没有明显变化。TK在10% CO2时含量最高,为20.1 g/kg;AK占比TK不足1%,在CO2影响下比对照降低了约一半。如图6(d)所示:TOC约占TC的25%~30%,在CO2胁迫下有较小波动。
图7为土壤XRD衍射图谱。根据标准图谱,位于27°,28°和29.5°的衍射峰确定为SiO2(silica),钙长石- CaO.Al2O3.2SiO2(anorthite)和CaCO3的特征峰;伊利石- KAl2[(OH)2AlSi3O10](illite)的主要特征峰位于8.8°、27° 2θ角,与SiO2重叠;高岭石- Al4[Si4O10](OH)8(kaolinite)的最强峰是在12.5°;绿泥石和蒙脱石的衍射峰变化不太明显。通过比较峰的位置和强度,土壤的主要成分是SiO2,并且在暴露于CO2的情况下,CaCO3和钙长石含量稍有增加,土壤的结晶程度增强,但总体变化不明显。
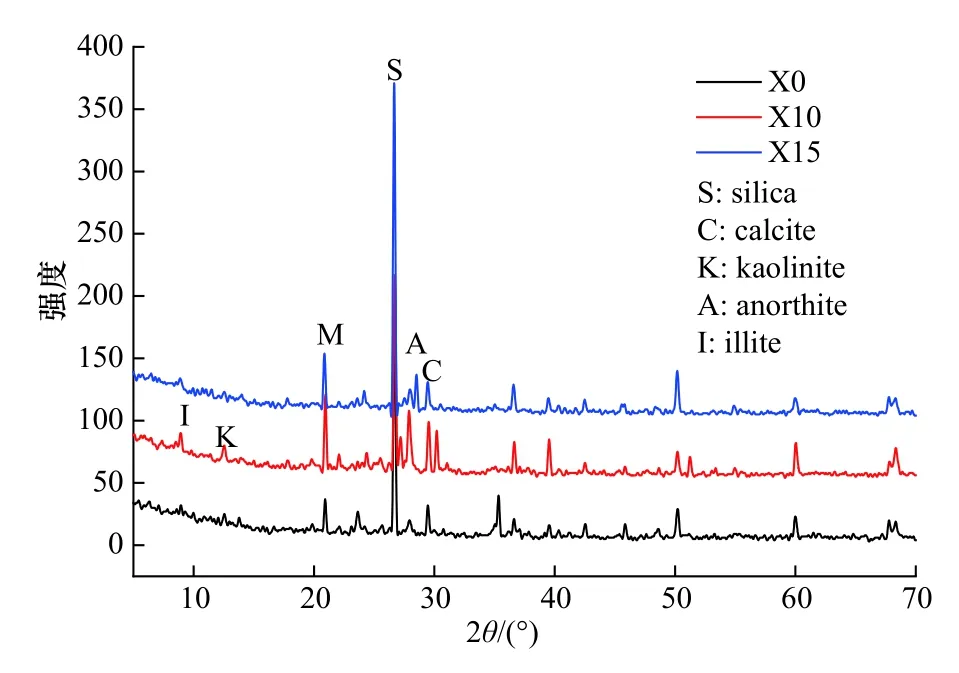
图7 土壤XRD衍射图谱(X0:对照; X10:10%; X15:15%)Fig.7 XRD image of soil(X0: control; X10: 10%; X15: 15%)
2.3 讨论
非饱和带土壤特性对植物的生长至关重要。通常,土壤是一个复杂的多相系统,水分、气体成分和矿物质会影响土壤的物理和化学性质。
CO2在土壤水相中溶解产生的H2CO3,分解为H+和HCO−3,会导致土壤pH下降[38]。试验使用土壤原位pH计进行了现场测量,其值在6.4~7.8之间,此时CO2气体在土壤中处于饱和状态,土壤含水率较高,CO2气体溶于土壤水相,导致土壤pH值较低。而风干土壤X0(对照)的pH为8.85,X5、X10、X15的pH逐渐增加至9.12。与原位pH值不同,风干土壤中已无CO2气体,其pH值主要受可溶性矿物质的影响。长期注入CO2,土壤中产生了更多的碱性CaCO3、Ca(HCO3)2、钙长石,从而引起pH值略微升高。此外,XRD测试证实了矿物的结晶及其类型的变化,这也与以前的研究结果相吻合[39]。
由于复杂的气-水-土壤多相反应过程,如溶解、交换、水合作用、水解和腐蚀等过程,矿物类型和浓度会发生改变[40- 41]。高浓度CO2入侵会导致土壤气相中CO2含量的变化,并增加H+、HCO−3、CO23−的浓度,从而破坏沉淀-溶解平衡,导致矿物类型和含量、孔隙度、渗透率发生变化[42]。本文中CO2的入侵也影响了土壤营养元素氮、磷、钾及碳含量。但总体上,土壤的理化性质变化不明显,表明在短时期内CO2的入侵不足以给土壤带来显著变化。
土壤特性、天气条件、地貌、植被和土地利用类型都是影响植物生长的主要因素。由于本试验在温室中进行,因此CO2浓度是影响植物生长的主要因素。试验结果表明,高浓度CO2对不同植物生长和发育产生的影响比较复杂:不同植物对不同浓度CO2的响应不同,但总体上高浓度CO2会抑制植物的生长发育,可能由于土壤pH的降低、CO2浓度的升高抑制了植物根系的呼吸和对营养物质及微量元素的吸收[43]。
对于植物的光合作用,CO2入侵对不同植物的影响不同。在低浓度5%,CO2可以促进黑麦草、豌豆和玉米的光合作用,而在较高浓度下会产生抑制作用。相反,在低CO2浓度下,小麦和苋菜的光合作用受到抑制,但在10%和15%的高CO2浓度下,光合作用得到增强。这一现象可能是由于不同植物光合作用的CO2饱和点不同所致。
蛋白质和糖类对于植物代谢至关重要。随着CO2含量的增加,C3植物黑麦草、小麦和豌豆的蛋白质增加,而C4植物玉米和苋菜的蛋白质减少。糖类在所有植物中均有提高,特别是C3植物黑麦草、小麦和豌豆。结果表明与C4植物相比,CO2入侵对C3植物的代谢影响更为显著。
植物中SOD、CAT和POD浓度与CO2浓度变化没有显著相关性,这可能是由于SOD、CAT、POD的抗逆性阈值不同所致。而且,不同植物的抗逆性机制是多种多样的:玉米主要依赖于蛋白质的增加,黑麦草依赖于糖和POD,小麦、豌豆和苋菜主要依赖于糖、SOD和CAT。总体上,黑麦草和玉米对CO2胁迫较为敏感,具有其作为CO2泄漏指示植物的潜在优势。但由于本研究时间较短,未获得显著规律,未来的研究应侧重CO2长期入侵对土壤性质的影响及揭示植物抗逆性的详细机理,为评估CO2对生态环境带来的潜在威胁提供理论与技术支持。
3 结论
(1)CO2入侵非饱和带会导致土壤pH的变化。随着CO2浓度的增加,氮、碳、有效钾、有效磷相对减少,而TP、TK没有明显变化。XRD表明CO2的入侵可能促进CaCO3、钙长石等矿物的增加,并提高土壤的晶化程度。
(2)CO2入侵对植物的生长、生理生化系统都会产生不利影响:植物叶片光合作用受到明显抑制,各植物体内的可溶性糖、蛋白质、PRO等渗透调节物质以及CAT、POD、SOD等抗氧化酶对CO2入侵的响应均有很大差异。相比较而言,可溶性糖和POD的敏感性较高;
(3)不同植物对CO2胁迫的响应不同,各因子的变化趋势也不同:C3单子叶黑麦草和C4单子叶玉米比其他植物更敏感,具有作为监测CO2泄漏的指示植物的潜力。
