乳酸菌肽聚糖对丙烯酰胺的吸附特性研究
2021-07-23刘清波董和亮赵思佳冯文晓邵美丽
刘清波,张 丹,董和亮,赵思佳,冯文晓,邵美丽,
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.齐齐哈尔食品药品检验检测中心,黑龙江齐齐哈尔 161006;3.黑龙江省垦区质量技术监督检验检测中心,黑龙江哈尔滨 150030)
丙烯酰胺(acrylamide,AA)是一种应用于合成聚丙烯酰胺及其水溶性聚合物的化学药品[1]。2002 年,斯德哥尔摩大学专业人士和瑞典国家食品管理局(National Food Administration,NFA)研究人员首次发现经油炸、烘烤高温处理的淀粉类食品中存在AA[2]。进一步研究发现AA广泛存在于油炸薯类、早餐谷物、咖啡等食物[3−4]中。国家癌症组织已将AA划分为2A级致癌物,AA具有神经毒性[5−6]、生殖毒性[7]、遗传毒性[8],会引起神经系统损伤,诱导动物生殖细胞染色体突变及遗传物质改变。鉴于此,通过热加工食品摄入体内的AA会对人体健康产生一定的安全隐患,因此减少食品中AA含量及其造成的危害成为食品安全领域非常值得关注的问题之一。
目前,去除AA的方法包括物理法、化学法以及生物法,其中生物法具有天然、安全、高效、低毒、廉价等优点。生物法中常见吸附剂包括壳聚糖、果皮、益生菌等,但壳聚糖、果皮在未经处理应用时,其自身吸附率很低,许多研究人员需要利用改性提高其吸附能力。而乳酸菌作为生物吸附剂直接使用时,其吸附率高、操作简单、易于提取且无二次污染。乳酸菌在黄曲霉毒素、赭曲霉毒素、伏马毒素、铅、汞、铬等危害物质的吸附脱毒方面有广泛应用[9−12],但在AA吸附脱毒方面研究甚少。本课题组研究证实乳酸菌对AA具有良好的吸附能力,高压灭活菌株吸附效果优于未经灭活菌株,且吸附AA后形成的复合物在体外胃肠模拟实验中具有良好的稳定性,其中植物乳杆菌对AA的吸附能力优于干酪乳杆菌和嗜酸乳杆菌[13]。进一步探究乳酸菌吸附AA的分子机制,发现乳酸菌吸附AA主要部位是细胞壁而非胞外多糖和表面蛋白,吸附能力与细胞壁粗糙程度呈正相关,即细胞壁越粗糙,对AA的吸附率越高[14],且已证实约占细胞壁质量90%的肽聚糖(Peptidoglycan,PG)是乳酸菌吸附AA的关键结构[15]。但有关乳酸菌PG吸附AA的影响因素及在胃肠环境下的吸附状况尚有待进一步研究。因此,本实验选择4 株乳酸菌PG为研究对象,以吸附率为指标,探究不同影响因素(PG浓度、AA浓度、时间、pH、温度及离子浓度)及人工模拟胃肠环境下乳酸菌PG对AA吸附能力的影响,旨在了解不同乳酸菌PG对AA的吸附特性,为AA生物脱毒应用提供理论支撑,同时为AA的去除提供一条新思路。
1 材料与方法
1.1 材料与仪器
植物乳杆菌1.0665(L.plantarum1.0665)、干酪乳杆菌ATCC393(L.caseiATCC 393)、嗜酸乳杆菌KLDS 1.0307(L.acido PhilusKLDS 1.0307)、嗜热链球菌 KLDS1.0316(Streptococcus thermophilusKLDS 1.0316)均由东北农业大学食品学院菌种库保存;丙酮、乙腈 色谱纯,哈尔滨市志飞生物技术公司;MRS培养基、三氯乙酸(TCA)(分析纯)北京奥博星生物技术有限公司;丙烯酰胺(acrylamide,AA)标准品(纯度≥99%)美国Amresco公司;冰醋酸(分析纯)、胰蛋白酶(250 U/mg)、Tris-Hcl、中性蛋白酶(30000 U/mg)哈尔滨市美莱生物科技有限公司。
LC-20A高效液相色谱系统 日本岛津公司;DL-360A超声破碎仪 北京东联哈尔仪器制造有限公司;DK-98-Ⅱ恒温水浴锅 常州荣冠实验分析仪器厂;GL-21M高速冷冻离心机 北京东联哈尔仪器制造有限公司;HVE-50 高压灭菌锅 浙江德育制造有限公司;DHP-9272 电热恒温培养箱 江苏中坤仪器厂。
1.2 实验方法
1.2.1 溶液配制 人工胃液:取质量分数为10%的盐酸加去离子水稀释调整至pH值分别为1.5、2.5、3.5,然后加入胃蛋白酶,充分溶解后,用0.22 μm滤膜除菌,4 ℃保存备用[16]。
胆盐溶液:分别用无菌去离子水配制0.1%、0.2%、0.3%、0.4%牛胆盐溶液,用0.22 μm的滤膜除菌,4 ℃保存备用[16]。
胰蛋白酶溶液:称取6.8 g KH2PO4,溶解于500 mL无菌去离子水中,调节pH至6.8,并定容至l000 mL,然后向溶液中添加胰蛋白酶,使溶液终浓度为1 g/100 mL,充分溶解后,用0.22 μm的滤膜除菌,4 ℃保存备用[16]。
1.2.2 PG的提取 将活化好的植物乳杆菌1.0665(Lactobacillus plantarum1.0665)、干酪乳杆菌ATCC393(Lactobacillus caseiATCC 393)、嗜酸乳杆菌KLDS 1.0307(Lactobacillus acidophilusKLDS 1.0307)和嗜热链球菌 KLDS 1.0316(Streptococcus thermophilusKLDS 1.0316)四株菌以3%~4%的接种量接入到50 mL MRS培养基中于37 ℃培养24 h后离心(4 ℃,8000 r/min)5 min,收集菌体,用无菌去离子水离心洗涤两次。然后按1:10 向菌体中加入10%三氯乙酸(TCA),摇匀后置100 ℃沸水中搅拌20 min,冷却后6000 r/min,4 ℃离心10 min,沉淀用无菌去离子水洗涤后,加入2 倍体积氯仿:甲醇(1:2,V/V)振荡6 h,并于6000 r/min,4 ℃离心10 min,再次洗涤沉淀,并将其溶于含有3 mg/mL胰蛋白酶和10 mg/mL中性蛋白酶的0.1 mol/L pH7.6 的Tris-HCl缓冲液中,37 ℃,150 r/min摇床振荡过夜,然后8000 r/min离心20 min收集沉淀并洗涤后,经冻干机冷冻干燥,得到粉末状PG提取物[17−20]。
1.2.3 PG鉴定 称取一定质量的上述PG冻干粉末,加入浓度为0.1 mol/L的磷酸盐缓冲液(pH为6.2)中,将其配制成浓度为1 mg/mL的溶液,再加入溶菌酶,将其浓度调整为300 μg/mL,同时以不加溶菌酶的PG作为对照组。于37 ℃振荡12 h,期间每间隔1 h进行一次取样,稀释5 倍后在600 nm波长下测定其吸光度值,观察肽聚糖的溶解状况[17]。
1.2.4 PG纯度的测定 采用高效液相色谱法进行PG纯度的测定,检测条件:色谱柱:色谱柱为Alltima Inertsil ODSP-C18(150 mm×4.6 mm,5 μm),检测波长:225 nm,柱温:37 ℃,流动相:H2O,流速:0.6 mL/min,进样量:20 μL。样品处理:将肽聚糖样品溶于无菌去离子水配制成1 mg/mL的PG溶液。根据肽聚糖在色谱图上的峰面积比来鉴定肽聚糖的纯度。
1.2.5 各因素对PG吸附AA的影响
1.2.5.1 pH对PG吸附AA的影响 将PG冻干粉溶于去离子水制备5 mg/mL的PG溶液,且分别调节pH为3、5、7、9、11。取900 μL该PG溶液与6 μg/mL AA 100 μL混匀,于37 ℃作用6 h,然后离心(4 ℃,8000 r/min,5 min),收集上清液。按照1.2.7 测定PG对AA的吸附率,重复操作三次。
1.2.5.2 温度对PG吸附AA的影响 将PG冻干粉溶于去离子水制备5 mg/mL的PG溶液,调节溶液pH为5。取900 μL该PG溶液与6 μg/mL AA 100 μL混匀,分别在4、20、37、50 ℃下作用6 h,然后离心(4 ℃,8000 r/min,5 min),收集上清液。按照1.2.7 测定PG对AA的吸附率,重复操作三次。
1.2.5.3 时间对PG吸附AA的影响 将PG冻干粉溶于去离子水制备5 mg/mL的PG溶液,调节溶液pH为5。取900 μL该PG溶液与6 μg/mL AA 100 μL混匀,37 °C,分别与AA作用2、4、6、8、10 h,然后离心(4 ℃,8000 r/min,5 min),收集上清液。按照1.2.7 测定PG对AA的吸附率,重复操作三次。
1.2.5.4 PG浓度对PG吸附AA的影响 分别称取5、10、15、20、25 mg肽聚糖冻干粉于1 mL无菌去离子水中,分别制备5、10、15、20、25 mg/mL的PG溶液,调节溶液pH为5。取900 μL该PG溶液与6 μg/mL AA 100 μL混匀,于37 ℃作用6 h。然后离心(4 ℃,8000 r/min,5 min),收集上清液。按照1.2.7 测定PG对AA的吸附率,重复操作三次。
1.2.5.5 AA浓度对PG吸附AA的影响 将PG冻干粉溶于去离子水制备5 mg/mL的PG溶液,调节溶液pH为5。取900 μL该PG溶液分别与不同浓度的AA(0.2、0.4、0.6、0.8、1.0 μg/mL)100 μL混匀,于37 °C作用6 h。然后离心(4 °C,8000 r/min,5 min),收集上清液。按照1.2.7 测定PG对AA的吸附率,重复操作三次。
1.2.5.6 钙离子浓度对PG吸附AA的影响 将PG冻干粉分别溶于浓度为0.2、0.4、0.6、0.8、1 mol/L的钙离子溶液,使PG终浓度为5 mg/mL。取900 μL该PG溶液与6 μg/m AA 100 μL混匀,于37 ℃作用6 h。然后离心(4 ℃,8000 r/min,5 min),收集上清液。按照1.2.7 测定PG对AA的吸附率,重复操作三次。
1.2.6 模拟胃肠环境条件下PG吸附AA的影响
1.2.6.1 模拟胃环境 将PG冻干粉分别溶于不同pH(1.5、2.5、3.5)的人工胃液制备5 mg/mL的PG溶液。取900 μL相应PG溶液与6 μg/mL AA 100 μL混匀,37 ℃,分别作用2、4、6、8 h。然后离心(4 ℃,8000 r/min,5 min),收集上清液。按照1.2.7 测定PG对AA的吸附率,重复操作三次。
1.2.6.2 模拟肠环境 a.胆盐浓度对PG吸附AA的影响:将PG冻干粉分别溶于不同浓度(0.1%、0.2%、0.3%、0.4%)牛胆盐溶液,制备5 mg/mL的PG溶液。取900 μL相应PG溶液与6 μg/mL AA 100 μL混匀,37 ℃,分别作用2、4、6、8 h,然后离心(4 ℃,8000 r/min,5 min),收集上清液。按照1.2.7 测定PG对AA的吸附率,重复操作三次。
b.胰蛋白酶对PG吸附AA的影响:将PG冻干粉分别溶于胰蛋白酶溶液制备5 mg/mL的PG溶液。取900 μL相应PG溶液与6 μg/mL AA 100 μL混匀,37 ℃,分别作用2、4、6、8 h,然后离心(4 ℃,8000 r/min,5 min),收集上清液。按照1.2.7 测定PG对AA的吸附率,重复操作三次。
1.2.7 PG对AA的吸附率的测定 采用高效液相色谱法,检测条件:色谱柱为Alltima Inertsil ODSPC18(150 mm×4.6 mm,5 μm),流动相为5%甲醇溶液,流速为1 mL/min,进样体积为20 μL,紫外检测波长为205 nm。PG与AA反应离心后,测定所回收上清液中AA的含量,并按式(1)计算PG对AA的吸附率。以不加PG溶液的AA工作液为空白对照(AA含量的测定方法如上)。

式中:C0:空白样液中AA的含量,μg;Ce:加入AA的菌悬液经离心收集的上清液中AA的含量,μg。
1.3 数据处理
2 结果与分析
2.1 鉴定结果
溶菌酶是一种能够水解致病菌中粘性多糖的碱性酶,它主要作用于细菌细胞壁的肽聚糖,溶菌酶能够破坏N-乙酰葡萄糖胺和N-乙酰胞壁酸这两种结构之间的β-1,4 糖苷键,从而水解肽聚糖。研究表明,溶菌酶能够识别细菌肽聚糖,常用于鉴定肽聚糖[21]。本研究的溶菌酶实验结果如图1所示。从图1 中可以看出,随着溶菌酶试验的不断进行,四种溶液的吸光度均逐渐降低,最终趋于平衡,其中,植物乳杆菌1.0665 的PG溶液、干酪乳杆菌ATCC 393 的PG溶液和嗜酸乳杆菌KLDS 1.0307 的PG溶液的吸光度均在8 h左右趋于平衡,而嗜热链球菌KLDS 1.0316的PG溶液的吸光度在10 h左右趋于平衡。以上说明提取物能够被溶菌酶完全水解,所提取的物质是肽聚糖。
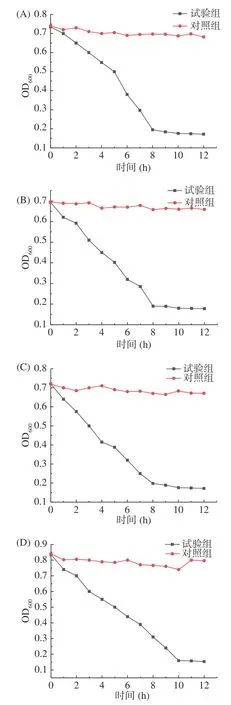
图1 四株乳酸菌PG溶菌酶实验结果Fig.1 Lysozyme assay observed from peptidoglycans from four lactic acid bacteria
2.2 PG纯度测定结果
PG纯度鉴定结果如图2 所示,从图2可知,所提取的四株菌的肽聚糖样品峰面积百分比为98%~99%,证明所提取的肽聚糖样品纯度高。
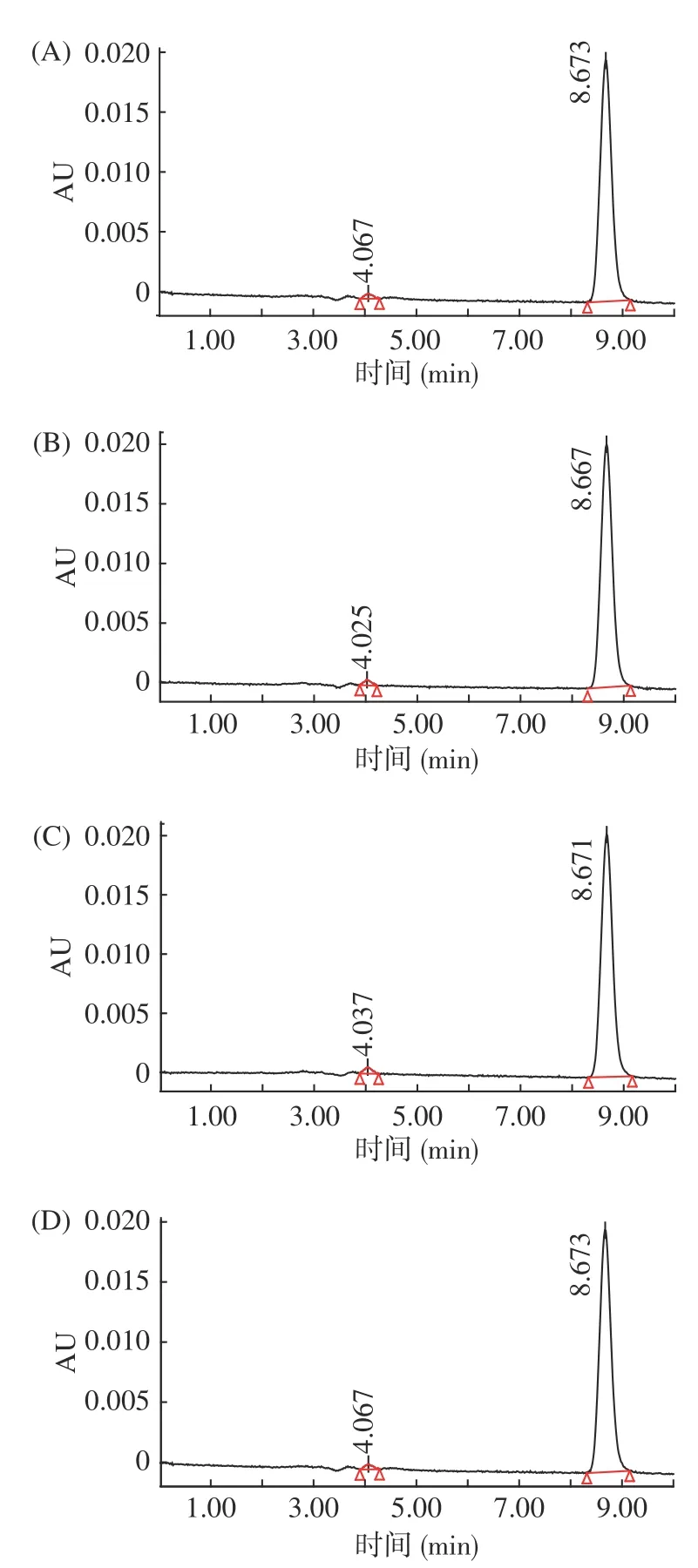
图2 四种PG的高效液相色谱图Fig.2 High performance liquid chromatography of four PG
2.3 各因素对PG吸附AA的影响
2.3.1 pH对PG吸附AA的影响 由图3 可知,同一菌株PG在不同pH下对AA的吸附性存在显著差异(P<0.05)。随着pH的增大,4 株乳酸菌PG对AA的吸附率呈先增大后减小的趋势,当pH为5 时,4 株乳酸菌PG对AA的吸附率均达到最大值,其中植物乳杆菌1.0665 的PG吸附率最大,可达87.35%。当pH>5 后,4 株乳酸菌PG对AA的吸附率逐渐降低,在pH为11 时,PG对AA吸附率最低,其范围为18.59%~51.25%。这说明酸性条件有助于PG对AA的吸附。宁妍[22]研究表明pH对PG分子某些结构的水解产生一定的影响,具体体现在一部分肽键发生水解,游离的羧基和氨基发生变化,另外水解为临近多肽链的结合作用提供了更多的空间,使其结合更易发生。且PG肽链上的第三位氨基酸是内消旋二氨基庚二酸型,且含有丙氨酸、谷氨酸等氨基酸。其中,二氨基庚二酸、谷氨酸及丙氨酸中的部分羧基可发生电离[23]。因此,pH影响了PG结构的变化,影响着基团的解离,进一步影响了PG表面结合位点的暴露,引起吸附率明显变化。
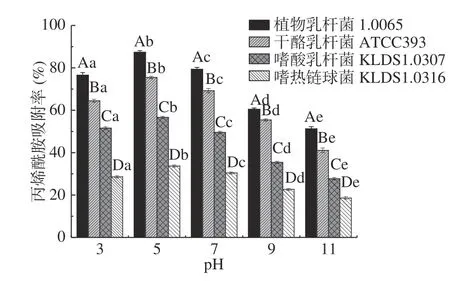
图3 不同pH对PG吸附AA的影响Fig.3 Effects of different pH on acrylamide bound by the peptidoglycans
2.3.2 温度对PG吸附AA的影响 由图4 可知,同一菌株的PG在不同的温度下对AA的吸附率存在显著差异(P<0.05)。随着温度增高,4 株乳酸菌的PG对AA的吸附率呈先上升后下降的趋势,当温度为37 ℃时,4 株菌的PG对AA的吸附率均达到最大,其中植物乳杆菌1.0665 的PG对AA吸附率达87.35%,显著高于其它3 株菌PG(P<0.05)。PG是由乙酰氨基葡萄糖、乙酰胞壁酸与4~5 个氨基酸短肽聚合而成的多层网状大分子结构。PG对温度敏感,因此温度会影响PG结构变化,使PG的交联度发生变化,结合位点暴露发生变化,进而其对AA吸附效果发生明显变化。
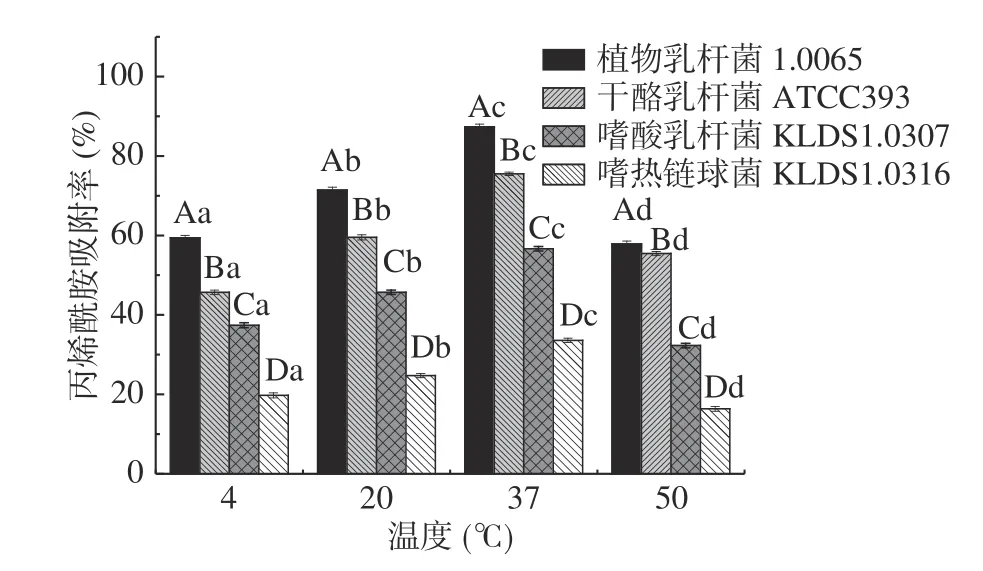
图4 不同温度对PG吸附AA的影响Fig.4 Effects of different temperatures on acrylamide bound by the peptidoglycans
2.3.3 时间对PG吸附AA的影响 由图5 可知,在2~6 h内,4 株乳酸菌的PG对AA的吸附率均随着培养时间的延长而增大,并且存在显著性差异(P<0.05),其中,植物乳杆菌1.0665 的PG对AA的吸附率增长最快,共升高了37.58%。当反应继续进行时,4 株菌的PG对AA的吸附率随时间的增长变得平缓,且差异不显著(P>0.05)。这与Jin等、Wang等[24−25]利用生物吸附法去除重金属发现的时间对吸附作用的影响规律相似,分析原因可能是前期PG表面存在大量的吸附位点,吸附速率较快,随着时间的逐渐延长,表面吸附结合位点达到饱和,从而吸附过程逐渐平缓,因此本实验中AA吸附最适宜时间为6 h。
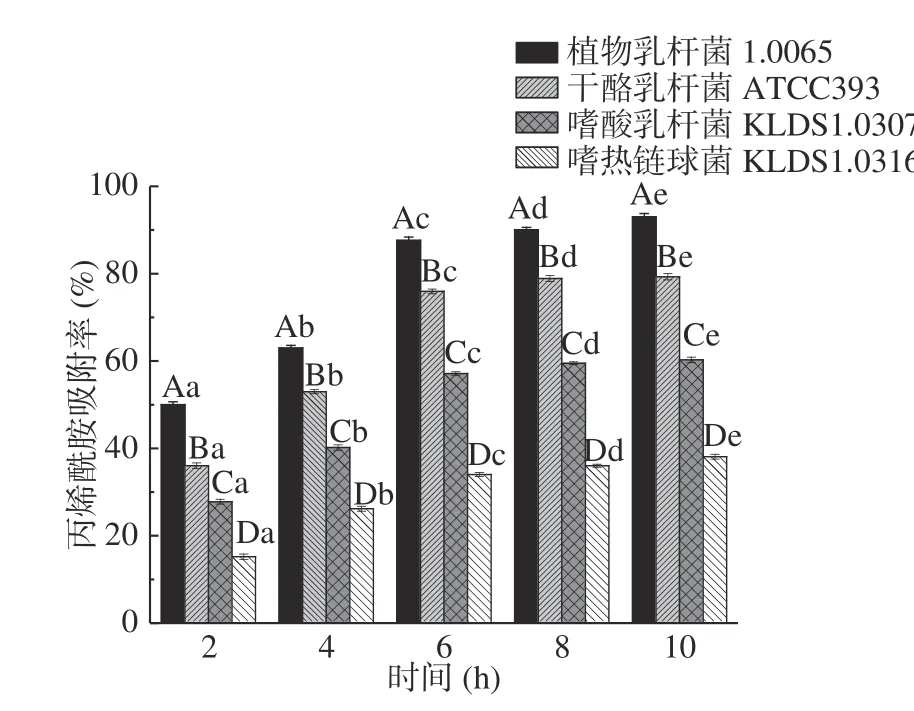
图5 不同时间对PG吸附AA的影响Fig.5 Effects of different time on acrylamide bound by the peptidoglycans
2.3.4 PG浓度对PG吸附AA的影响 如图6 所示,同一菌株的PG对AA的吸附率均随着PG浓度的升高而增加,但差异不显著(P>0.05)。当PG浓度相同时,4 株乳酸菌的PG对AA吸附率有显著性差异(P<0.05)。Zhang等[15]发现PG吸附AA前后,其C-O、C=O和N-H这三种官能团的波数发生了明显改变,说明四株乳酸菌PG中的这三种官能团参与了其对AA的吸附。因此,推测当PG浓度为5 mg/mL时,PG上的结合位点已经开始饱和,随着PG浓度的增加,对AA的吸附效果影响不明显。
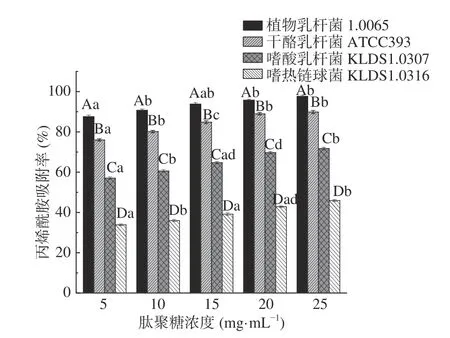
图6 不同PG浓度对PG吸附AA的影响Fig.6 Effects of different peptidoglycan concentrations on acrylamide bound by the peptidoglycans
2.3.5 AA浓度对PG吸附AA的影响 由图7 可知,同一种菌株的PG在不同AA浓度条件下对AA吸附率具有显著性差异(P<0.05)。AA浓度在0.2~1 μg/mL范围内,4 株乳酸菌的PG对AA的吸附率随着AA浓度的增大而降低。当AA浓度达1 μg/mL时,4 株乳酸菌PG对AA的吸附率均最低。这与Gungal等[26]研究溶液中重金属吸附特性基本一致,Gungal认为这与吸附位点的饱和有关。因此推测AA浓度为0.2 μg/mL时,PG表面吸附位点开始饱和,由此之后随着AA浓度的增加,吸附率逐渐减小。
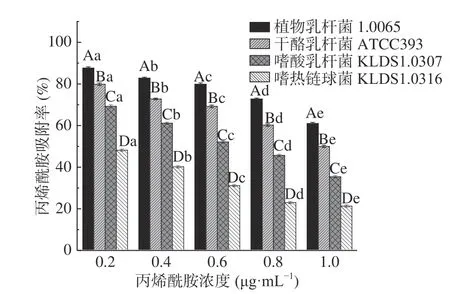
图7 AA浓度对PG吸附AA的影响Fig.7 Effects of acrylamide concentrations on acrylamide bound by the peptidoglycans
2.3.6 钙离子浓度对PG吸附AA的影响 由图8可见,在 0~0.6 mol/L钙离子浓度范围内,4 株菌的PG对AA的吸附率均随着钙离子浓度的增加而显著增大(P<0.05),当钙离子浓度为0.6 mol/L时,4 株菌的PG对AA的吸附率达到最大,其中植物乳杆菌1.0665 的PG对AA的吸附率最高,约为87.18%。当钙离子浓度继续增大至1 mol/L时,PG对AA的吸附率变化不显著(P>0.05)。
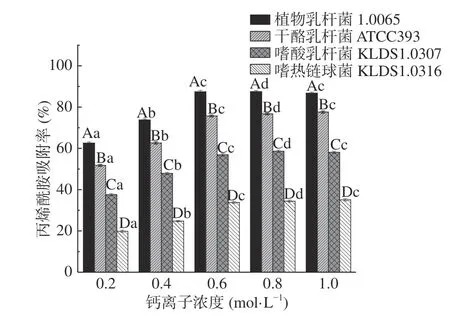
图8 不同钙离子浓度对PG吸附AA的影响Fig.8 Effects of Ca2+ concentrations on acrylamide bound by the peptidoglycans
2.4 人工模拟胃环境对PG吸附AA的影响
由表1 可知,在不同pH的人工胃液中,4 株乳酸菌的PG对AA吸附率呈显著差异(P<0.05),但相同pH、不同作用时间条件下,4 株乳酸菌的PG对AA的吸附能力基本上没有呈现显著性差异(P>0.05),这表明4 株乳酸菌的PG对AA的吸附特性受pH影响很大,但与反应时间关系不大。在同一吸附时间下,4 株乳酸菌的PG均在pH为3.5 时对AA的吸附率最高。Zhang等[27]研究发现,胃液中乳脂链球菌的细胞对致突变物质的吸附能力受pH的显著影响。本实验也发现PG的AA的吸附率在模拟胃环境实验中受pH影响显著。Zhao等[28]发现pH显著影响植物乳杆菌对伏马菌素的结合作用,其原因是pH影响PG之间糖苷键水解,进而影响其结构变化。因此,推测pH通过影响PG结构发生变化,使其表面基团暴露,结合位点数量发生改变,从而影响吸附效果。
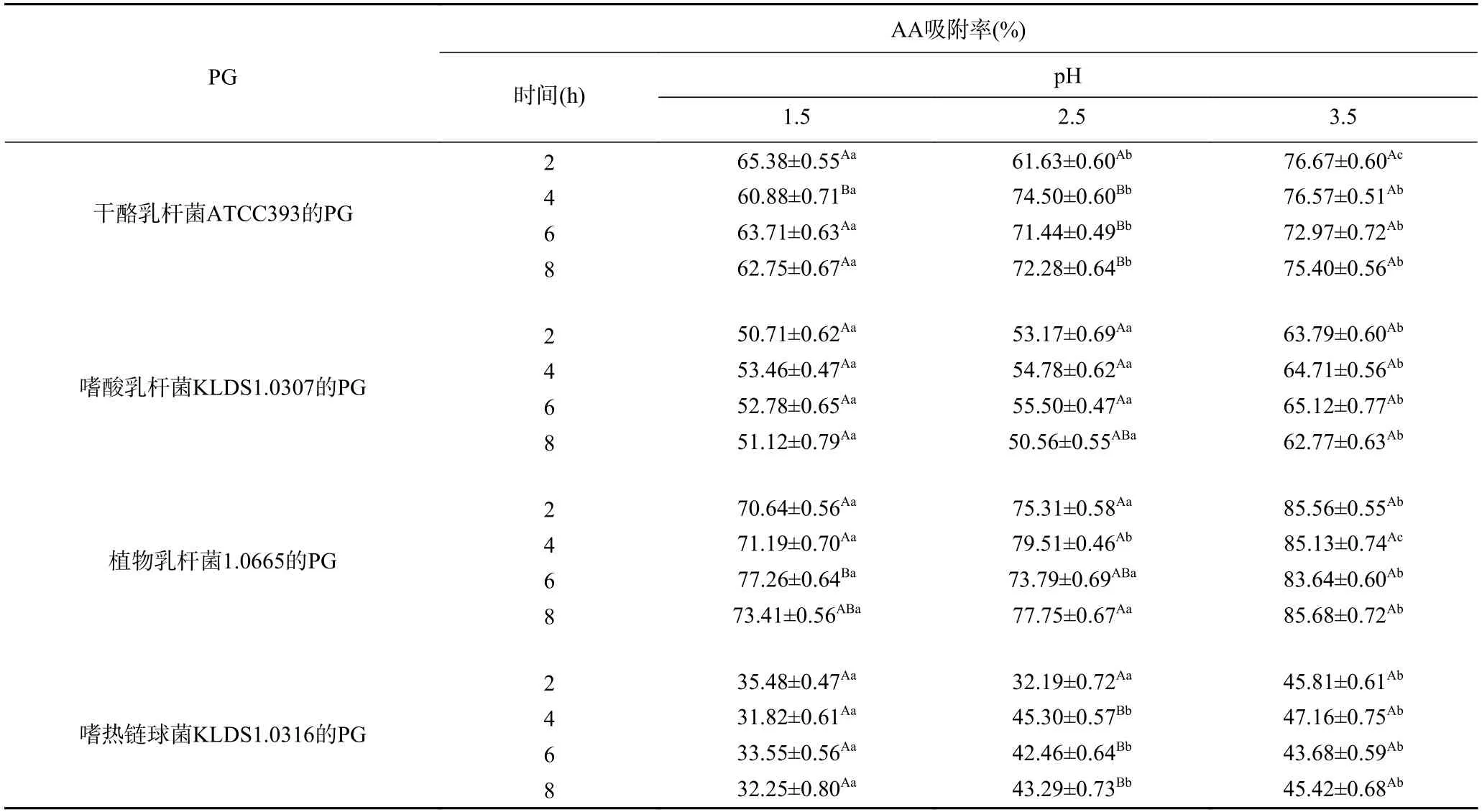
表1 人工胃环境对4 种PG吸附AA的影响Table 1 Effects of artificial gastric juice on acrylamide bound by the four peptidoglycans
2.5 人工模拟肠环境
2.5.1 胆盐浓度对PG吸附丙烯酰胺的影响 研究发现[29−30],胆盐对于细菌的蛋白质和磷脂具有破坏作用。胆盐的这种破坏作用有可能会影响肽聚糖的蛋白及其氨基酸的结构,从而影响肽聚糖对丙烯酰胺的吸附作用。而本实验也发现,乳酸菌的PG对AA吸附率受胆盐影响较大。由表2 看出,相同时间下,同一PG在不同浓度胆盐处理后,其对AA的吸附率存在差异,其中,嗜酸乳杆菌KLDS1.0307及嗜热链球菌KLDS1.0316 的PG对AA的吸附率的最高值均出现在0.3%胆盐浓度条件下,而植物乳杆菌1.0665和干酪乳杆菌ATCC393 的PG对AA的吸附率最大值出现在0.4%胆盐浓度条件下,这说明0.3%~0.4%胆盐浓度条件下更有利于乳酸菌的PG对AA的吸附;此外,在胆盐浓度相同时,不同吸附时间下,4 株乳酸菌PG对AA的吸附率也存在差异,这说明作用时间对4 株乳酸菌的PG吸附AA的能力也产生了较大影响,其中植物乳杆菌1.0665 PG对AA的吸附率在0.4%胆盐浓度条件下,处理4 h后达到最高,为84.67%。

表2 胆盐浓度对4 种PG吸附丙烯酰胺的影响Table 2 Effects of bile salt concentrations on acrylamide bound by the peptidoglycans
2.5.2 胰蛋白酶作用时间对PG吸附AA的影响 由表3 可知,经胰蛋白酶处理时,同一种菌株的PG对AA的吸附率并没有随时间变化而显著改变,说明胰蛋白酶对4 株乳酸菌的PG吸附AA的能力没有显著影响(P>0.05)。而漆叶琼[16]在探究乳酸菌吸附苯并芘过程中,证明了PG是乳酸菌吸附苯并芘的关键结构,并发现经胰蛋白酶处理时,随处理时间不同,有些菌株的吸附率呈极显著差异,而有些菌株吸附率并未受到影响。进一步证实胰蛋白酶对乳酸菌吸附能力的影响具有菌株特异性。
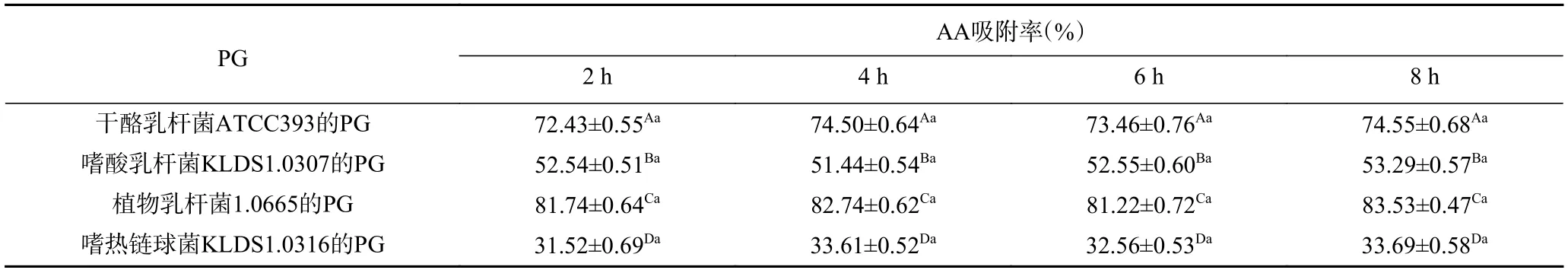
表3 胰蛋白酶作用时间对4 种PG吸附AA的影响Table 3 Effect of trypsin action time on the adsorption of AA by 4 PG
3 结论
因AA广泛存在于人们常用的食品中,其对人体健康又存在安全隐患,因此对AA进行生物脱毒的研究是必要的,而在生物脱毒的过程中,一些因素对脱毒效果产生的影响是不可忽视的。本实验发现4 株乳酸菌的PG对AA均具有良好的吸附效果,其中植物乳杆菌1.0665 的PG吸附效果最好。6 种影响因素(pH、温度、时间、PG浓度、AA浓度及钙离子浓度)均对PG吸附AA具有一定的影响。其中pH、温度以及AA浓度对PG吸附AA具有明显影响,吸附率随着pH及温度的升高呈先增大后减小的趋势,且随着AA浓度的升高而减少。在6 h以内,4 株乳酸菌PG对AA的吸附率随时间的延长而显著增加(P<0.05),但6 h后无显著性变化。在0.6 mol/L以内,吸附率随着钙离子浓度的增大而显著增加(P<0.05)。而PG浓度对同一菌株PG吸附AA不具有显著性。模拟胃环境下,不同pH明显影响着PG对AA的吸附效果,反应时间没有明显影响。模拟肠环境下,胆盐浓度和反应时间均显著影响PG对AA的吸附效果,而胰蛋白酶对PG吸附AA的能力没有显著影响。以上结果为AA的生物脱毒奠定了基础并提供理论支撑。
