生物可及性和生物利用度体外模型及其在食品污染物暴露评估中的应用
2021-07-23徐飞飞李跃麒赖月妃池慧钦吴炜亮杨杏芬
徐飞飞,李跃麒,林 珺,赖月妃,池慧钦,吴炜亮,,杨杏芬,
(1.南方医科大学公共卫生学院,食物安全与健康研究中心,广东省热带病研究重点实验室,粤港澳污染物暴露与健康联合实验室,广东广州 510515;2.暨南大学医学院,广东广州 510632)
消费者经膳食途径摄入在生产(包括农作物种植、动物饲养和兽医用药)、加工、包装、贮存、运输、销售,直至食用等过程中产生的或由环境污染带入的、非有意加入的化学性危害物质,可对人体造成潜在的不良健康效应,如通过食物链富集于食品的环境污染物、食品生产加工过程中生成的热加工副产物等[1]。在评估化学污染物的暴露风险时,常考虑其在膳食中是否存在、浓度水平、膳食消费模式等因素[2]。然而,人体胃肠道的消化吸收是综合消化液分泌、酶反应、胃肠动力等复杂的过程,化学污染物的结构、物理化学性质及其与食品基质的结合形态等因素均会影响污染物通过胃肠壁转运进入血液循环的比例[3]。例如,由于氨基酸的盐析作用使得多溴联苯醚的溶解性降低,其在植物源性食品中的消化吸收比例与蛋白质含量呈显著的负相关关系[4];碳水化合物能够组装成胶团簇从而增强疏水性分子的转运能力,使食物中持久性有机污染物在胃肠道释放的比例升高[5];高脂溶性的化学污染物如二噁英因其无法在消化道内形成分子溶液而未被胃肠道完全吸收[6−7]。但是,传统的风险评估未将这些相关因素纳入考量范围。因此,相关的化学污染物暴露评估结果可能存在高估或低估人群的暴露水平及其毒性作用[2,8]。
为了更精准地量化化学污染物在体内的毒性作用、代谢过程对人体健康的影响,多种体外生物可及性和生物利用度的体外测试方法已应用于测定化学污染物从食品基质转移释放和吸收效率,以明晰其真实的膳食暴露水平。因此,本文通过综述现有的生物可及性和生物利用度体外模型,分析其在食品污染物风险评估中的应用,旨在为化学污染物的膳食暴露评估精准化提供方法学参考依据。
1 生物可及性和生物利用度的体外测试模型
1.1 生物可及性及体外测试模型
生物可及性为评估化学污染物潜在健康危害的首个切入点和校正因子。虽然不同研究定义生物可及性存在细微差别,但生物可及性(Bioaccessibility)主要是指在胃肠道消化过程中,化学污染物从基质(如食物、土壤等)释放到胃肠液中的量与摄入总量的比值,表示基质中化学污染物可被人体吸收的相对量,也是人体可能吸收的最大量[9]。迄今为止,国内外专家学者已构建多种模拟不同消化阶段的体外模型,这些模型主要分为静态模型和动态模型两类,其基本原理均基于人体胃肠道重要的生理参数来模拟体内消化过程,但不同的模型体系在模拟器官构成、消化液成分、固液比、pH、消化时间等方面存在一定差异,如表1 所示。
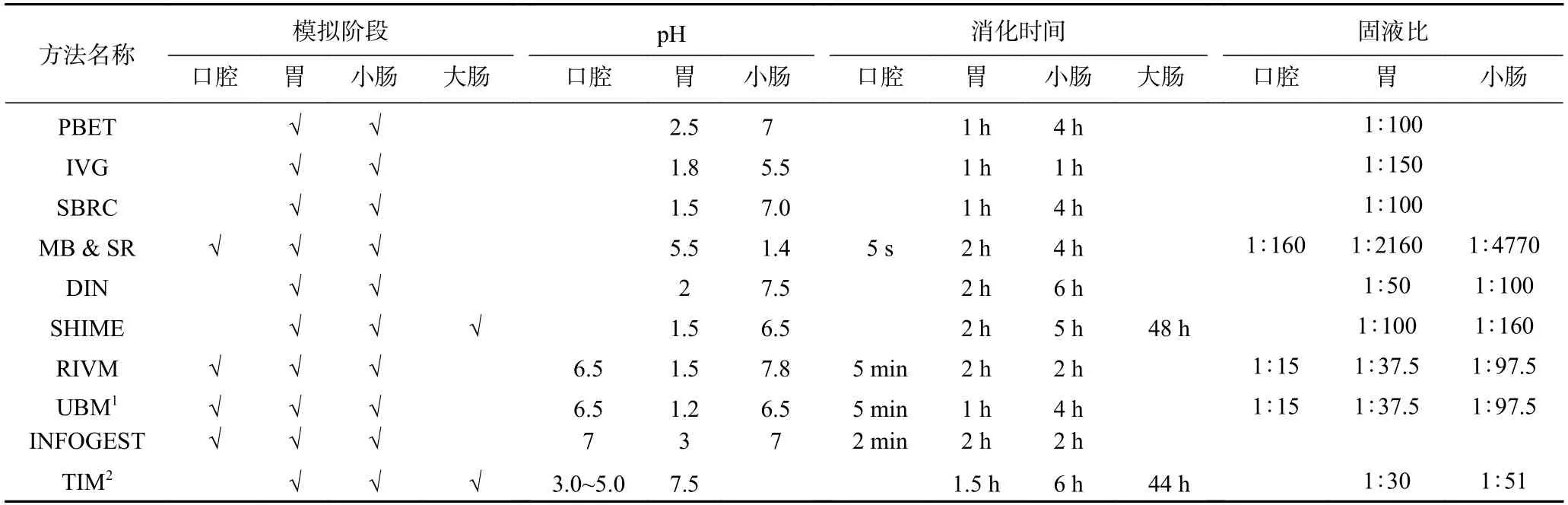
表1 体外胃肠模拟方法比较Table 1 Comparison of in vitro gastrointestinal simulation methods
体外消化模型最初是应用于评估环境(如土壤)中污染物的生物可及性,之后随着不断地改进,其逐渐开始应用于食品污染物暴露评估的领域。目前发展较为成熟的有生理原理提取模型(the Physiologically Based Extraction Test,PBET)、荷兰公共卫生与环境国家研究院建立的RIVM模型(National Institute of Public Health and the Environment)、德国标准化学会认可的DIN模型(Deutsches Institut für Normung)、婴儿人体肠道微生物生态系统模拟器(Simulator of Human Intestinal Microbial Ecosystem of Infants,SHIME)、荷兰应用科学研究院营养与食品研究所(the Netherlands Organization,TNO)研发的TIM模型(TNO Gastrointestinal Model)等体外消化模型,其中DIN模型的应用主要集中在环境污染物的研究,而TIM动态模型由于其复杂性在应用过程中具有较高难度。在实际应用过程中,研究者会根据情况将不同模型的消化液成分、消化时间等参数进行调整而形成新的体外消化实验方法,由于这些新的消化方法并未正式命名,下述统称为其它体外消化模型。
PBET模型实质是在37 ℃下模拟胃和小肠两个消化阶段的连续提取,模型研发设计者Ruby等利用大鼠和幼猪模型的验证实验表明其是口服Pb生物可及性测定的良好预测模型[10−13]。RIVM模型是由荷兰公共卫生与环境国家研究院开发,模拟口腔、胃以及小肠三个重要消化阶段的体外模型[14−15]。DIN模型由口腔、胃和小肠三部分组成,并通过加入奶粉、有机酸和多种无机盐以模拟人体更真实的消化情况[16]。SHIME模型是由比利时根特大学的Molly等研发的引入肠道微生物群的模拟人体胃肠生态系统,由胃、小肠、升结肠、横结肠和降结肠五部分组成[17−18]。TIM模型是一种数控动态体外胃肠模拟模型,由胃、十二指肠、空肠及回肠四个模块组成[19]。上述模型中,PBET模型其具有简便快速、经济、可操作性强等特点,在食品污染物生物可及性评估领域应用较为广泛,但模型只包含两个消化阶段,且消化液成分简单,未能充分模拟人体真实的生理情况。与其他模型相比,通过RIVM模型得到的土壤重金属生物可及性数据在中间范围,更接近人群体内的口服生物利用度数据[15,20]。因此,RIVM模型被认为是最适合进行体外批量消化的静态模型,并获得了荷兰和丹麦等国家监管机构的认可[21],但该模型的重复性还需进一步验证[21−24]。经验证的DIN模型已被德国标准化学会采用,并作为测定土壤中无机和有机污染物生物可及性的标准方法(DIN 19738-2004)[25]。该模型主要应用于评估土壤、沉积物和飞灰等环境样品中重金属和类金属的生物可及性[26−27],尚未应用于食品化学污染物评估。TIM动态模型通过幂指数数学方程控制胃肠消化液的转运,并考虑了人体的胃肠动力学参数,与静态模型相比更接近人体真实的生理情况[28],可作为其他体外模拟方法的验证方法。然而,该模型组成复杂,并不适合对大样本量的测试分析。
1.2 生物利用度及体外测试模型
化学污染物的生物可及性与生物利用度之间存在一定的相关性,其反映的是经口摄入化学污染物的生物利用度达到最大时的情况,但是由于化学物性质的差异,生物可及性并不等同于生物利用度,它们分别表示了人体胃肠道消化吸收过程中的不同环节,生物可及性和生物利用度之间的关系如图1 所示。一般地,生物利用度(Bioavailability)定义为进入人体后能够通过消化道吸收,最终到达血液或淋巴组织内(即进入人体内循环)的化学污染物的浓度水平占摄入总量的比例[9]。作为测定污染物生物利用度的首选模型,如啮齿类、幼猪等动物模型,其可较为真实地反映人体肠道吸收化学污染物的整个过程[29]。然而,由于动物模型涉及实验时间长、费用高和动物伦理等问题,部分已被实验效能更高的体外细胞模型替代。同时,体外细胞模型也已逐渐成为评估食品中化学污染物生物利用度的常规模型。

图1 生物可及性和生物利用度的关系Fig.1 The relationship between bioaccessibility and bioavailability
Caco-2 细胞模型是一种人克隆结肠腺癌细胞。在特定的培养条件下,其可生长成为连续单层的结构和功能类似于分化的小肠上皮细胞,具有微绒毛,并含有与小肠刷状缘上皮相关的多种酶系和特征转运蛋白[30−32]。在几十年的发展过程中,该模型逐渐成为最成熟的小肠细胞吸收体外模型,并已广泛应用于药物、营养素、食品和环境等多种基质的金属元素生物利用度研究[33−37]。Caco-2 细胞的来源导致其特征更类似于结肠细胞,使得在将其应用于生物利用度模型时,结果的准确性受细胞转运蛋白表达、旁路途径的吸收等因素的影响[38−41]。因此,其他细胞吸收模型被提出,如刷状缘膜囊泡和人小肠上皮细胞等,但这些模型仍未得到充分验证,标准操作规程也未形成[42−43]。相较于这些模型,Caco-2 细胞模型具操作简便、通量高、稳定性和准确性高的特点,目前仍被认为是评价生物利用度的最佳体外模型。
Caco-2 细胞模型中缺少人体肠道真实环境中的肠黏液层保护而可能会受消化液中酶的降解,导致影响相关的评估结果。因此,为在体外模拟肠黏液层,Wikman-Larhed等[44]和Walter等[45]研究人员分别提出了改良Caco-2 细胞模型的方法,即引入可产生黏液的细胞株HT29-MTX与Caco-2 细胞共培养,使模型更接近人类肠道上皮。除与黏液细胞株共培养优化模型外,还可通过共培养技术模拟炎症状态[46]、肠道菌群生态环境[47]等人体真实的肠道情况。另外,使用干细胞并产生胃肠道类器官以模拟人类肠道的更多参数,是当前改进体外肠道系统的新进展。Yamanaka等[48−49]研究人员通过强制表达四种转录因子使从小鼠胚胎和成人成纤维细胞培养诱导形成的多能干细胞(induced pluripotent stem cells,iPSCs)重新编程而达到多种分化潜能状态。源自iPSCs诱导的肠细胞模型具有非致癌性、高表达转运蛋白、具有诱导潜能的肠道标志物和代谢酶等优点[50−52],较Caco-2 细胞模型更符合体内的实际情况。然而,共培养模型和iPSCs衍生的肠细胞模型对培养条件和操作技术均需更高的要求,且成本高,耗时长[33],因此尚未在食品污染物评估领域得到应用。但是,共培养模型及iPSCs培养诱导形成不同的胃肠道类器官可以更真实地模仿人体肠道环境,被认为是目前改进体外细胞模型评估生物利用度的新方法、新手段,在构建肠道细胞模型方面具有极大的潜能[53]。
2 模型在食品污染物暴露评估中的应用
2.1 植物源性食品
生物可及性模型主要应用于评估植物源性食品中的重金属、持久性有机污染物经过胃肠道的消化过程而从食品基质释放的可被吸收的浓度水平,部分生物毒素、农药残留以及加工过程中产生的污染物(如丙烯酰胺等)的研究近年来也有陆续报道(如表2 所示)。在植物源性食品污染物生物可及性的研究中,主要使用PBET、RIVM、SHIME和TIM等体外消化模型和基于Caco-2 细胞模型的肠道吸收模型。
研究发现,蔬菜中金属元素的生物可及性受其物理化学性质和烹调方式的影响。Intawongse等采用PBET模型获得了莴苣、菠菜等蔬菜中金属元素的生物可及性,结果表明重金属 Cd和Pb的生物可及性较低,而Mn、Cu、Zn和 Mo等金属元素的生物可及性较高(如表2 所示)[55];Mnisi和Zhuang等[54,69]采用PBET模型的研究结果则表明,烹调方式可显著降低蔬菜中重金属的生物可及性。然而,通过SHIME模型引入肠道微生物,则发现蔬菜中Fe的生物可及性可提高1.3~1.8 倍,而Mn、Cu和Zn的生物可及性出现不同程度的降低,范围在3.7%~100%之间[58]。利用不同模型所测得的生物可及性结果也会有所不同,如利用PBET模型获得大米中Cd的生物可及性为30%~50%,略低于RIVM模型所获得结果(74%~83%和90.04%~100.70%)[24,54,61]。Torres-Escribano等[63]利用TIM模型测定了食品认证参考材料海藻中As、Cd、Pb和Hg的生物可及性,发现动态和静态模型的生物可及性值之间存在显著差异,这应该是各种体外条件(pH、消化时间、酶浓度和类型、固液比、蠕动和转运的动静态调节等)综合影响的结果(见表2)。

表2 体外消化模型在植物源性食品生物可及性评估的应用Table 2 Applications of in vitro digestion models in the bioaccessibility evaluation of plant-based foods
如表2 所示,与蔬菜中重金属污染物的生物可及性相似,植物源性食品中的多溴联苯醚、滴滴涕等持久性有机污染物的生物可及性均低于50%,这可能与其脂溶性的物化性质相关[4,66]。然而,对于植物源性食物中真菌毒素的研究则显示出了较高的生物可及性。如花生及荞麦中的黄曲霉毒素B1和赭曲霉素A的生物可及性可分别高达83%和100%[61]。Motta等[62]利用RIVM模型研究了玉米食品中伏马菌素B1的生物可及性,发现其生物可及性范围为37%~64%,而使用其他体外消化模型测定谷类食品、饼干和面包中镰刀菌毒素A、A1、B和B1的生物可及性范围为40.4%~79.9%[65]。此外,体外消化模型亦应用于评价加工过程中产生的污染物以及农药残留的生物可及性,如Sansano等[64]使用其他体外消化模型对西班牙快餐店和超市销售的炸薯条、饼干和速溶咖啡中的丙烯酰胺进行了研究,结果表明丙烯酰胺在消化过程中显著增加,增加比例最高的食品为甜饼干,高达410%±163%。Shi等[59]利用SHIME模型测定了苹果中五种拟除虫菊酯的生物可及性,胃消化阶段和肠消化阶段的生物可及性存在一定的差异,分别为13.0%~23.5%和18.99%~31.10%。由此可知,利用体外消化模型评估某种污染物的生物可及性时,仍需对具体的食品品种及污染物种类进行具体分析。随着模型的推广,对不同食品基质中污染物的生物可及性研究逐步地开展,如应用PBET模型测定浆果和蘑菇中的As[66−57],RIVM模型测定海藻中的Cd[24]、其它体外消化模型测定茶叶中的Cd和Pb等重金属[68],果汁中的棒曲霉素以及面包中的镰刀菌毒素[64]等(见表2)。
由于Caco-2 细胞模型是体外研究污染物生物利用度的金标准,目前大部分的研究均使用该模型对污染物的生物利用度进行评估(如表3 所示)。Fu等[34]通过PBET模型和Caco-2 细胞模型研究了蔬菜中Cd和Pb的生物利用度,结果提示未经烹调蔬菜中Cd和Pb的生物利用度显著高于烹调后的生物利用度。然而,Laparra等[70]的研究结果则表明烹调后大米的无机砷生物利用度显著增加。除烹调方式影响污染物的生物利用度外,食品中的其他元素和成分亦对污染物的生物利用度有一定的影响,如Lee等[71]的研究结果表明,烹调后精米中总砷的生物利用度为糙米的1.4~1.5 倍;叶绿素、玉米纤维等大分子食品成分可降低持久性有机污染物2,3,7,8-四氯二苯并-p-二噁英的跨细胞转运量,即其生物利用度[72]。此外,有研究报道指出不同土壤种植的稻米中的Cd生物利用度也存在一定差别[73]。
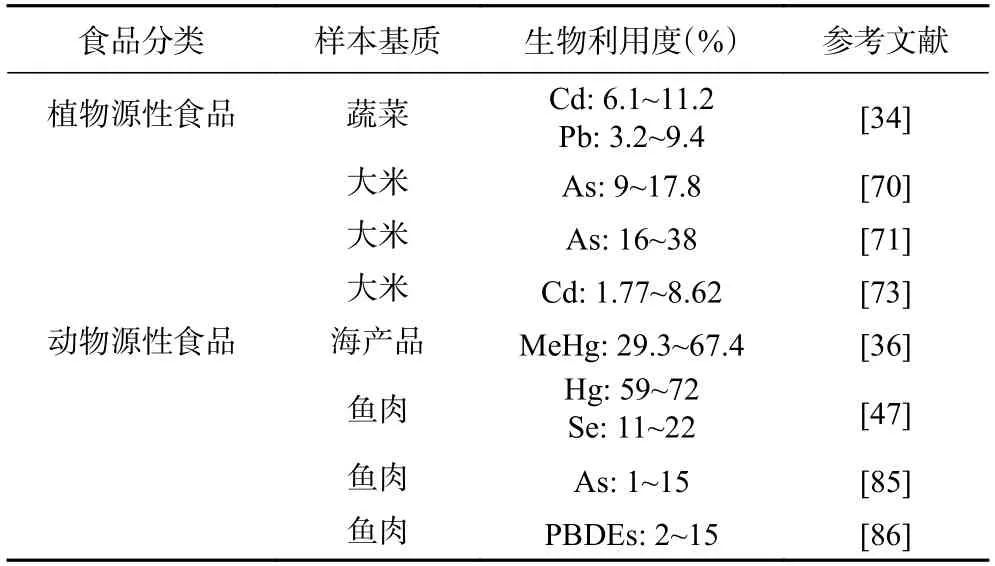
表3 Caco-2 细胞模型在食品污染物中生物利用度评估的应用列举Table 3 Applications of Caco-2 cell model in the bioavailability evaluation of food contaminants
2.2 动物源性食品
动物源性和植物源性食品基质之间具有明显差别,这些差异可在一定程度上影响污染物的生物可及性和生物利用度。因此,有必要使用体外模型评估动物源性食品中各类污染物的生物可及性和生物利用度(如表3、表4 所示)。目前,在动物源性食品污染物的生物可及性评估研究中,应用较为广泛的模型有PBET、RIVM、SHIME和TIM模型,肠道吸收模型主要是Caco-2 细胞模型。
不同种类动物源性食品中的重金属生物可及性研究也是研究的热点之一。Peng等[74]利用RIVM模型评估了我国不同省份市售小龙虾中重金属元素(见表4)的生物可及性,其范围在70%~110%之间。西班牙市售海产品中As的生物可及性也有相似的结果,而Hg和甲基汞的生物可及性则在17%~77%[75]。烹调方式可降低海产品中重金属Hg和Cd的生物可及性,而且通过SHIME模型引入肠道微生物评估烹调方式对海产品中Hg和As的生物可及性。研究结果表明,肠道微生物可进一步降低Hg的生物可及性,而烹调方式则能显著提高砷酸盐的生物可及性[76−80],结果与植物源性食品生物可及性的研究结果相似。Torres-Escribano等[63]使用TIM模型测定龙虾肝胰腺和海藻中的As、Cd、Pb和Hg生物可及性,结果显示动物源性食品中四种重金属的生物可及性略高于植物源性食品。此外,如表4所示,PBET、SHIME等消化模型也应用于研究海产品中重金属形态与生物可及性之间的相关性[77−78]。
动物源性食品中有机污染物、生物毒素、兽药残留以及食物加工过程中产生的丙烯酰胺、杂环胺等的生物可及性研究也已有报道。Xing等[3]使用其它体外消化模型的研究发现淡水鱼中多氯联苯的生物可及性远低于蔬菜,而Shen等[6]利用RIVM模型研究发现,大米和蔬菜中的多氯联苯以及多氯二苯并-p-二噁英的生物可及性低于牛肉和鱼肉。Yu等[4]使用其它体外消化模型研究了不同种类动物源性食品中多溴联苯醚的生物可及性,其中以淡水鱼中的多溴联苯醚生物可及性最高,但仅约40%的多溴联苯醚释放于消化液中。如表4 所示,利用RIVM模型研究海产品中的生物可及性,结果显示多环芳烃并非完全释放于消化液中,而且经烹调后多环芳烃的生物可及性还可进一步降低[81]。Sobral等[82]利用其他静态体外消化模型评估不同烹调方式处理下鸡胸肉中9 种常见真菌毒素的生物可及性,发现其生物可及性范围为1%~90%,且烹调过程中添加混合香料(包含香菜、柠檬浆、迷迭香等)可增加真菌毒素的生物可及性。利用RIVM模型获得的贝类中冈田酸的生物可及性可高达70%~90%[83]。鸡肉中β-内酰胺类、四环素类、磺胺类、氟喹诺酮类、大环内酯类和抗球虫病药等6 类抗菌和抗虫药物的生物可及性亦有报道,这些兽药在经过体外消化后的生物可及性最高可达60%[84]。与植物源性食品相似,油炸动物性食品中的丙烯酰胺在体外消化过程中含量亦有增加,其中增加比例最高的食品为炸鸡块,可达94%±11%,而利用其他体外消化模型获得的熟肉中杂环胺的生物可及性范围为30%~50%[68]。

表4 体外消化模型在动物源性食品中生物可及性评估的应用列举Table 4 Applications of in vitro digestion models in the bioaccessibility evaluation of animal-based foods
相似地,在评估动物源性食品中污染物的生物利用度时,相关研究也多采用Caco-2 细胞模型。使用Caco-2 细胞模型评估海产品中甲基汞的生物利用度,得到的结果为29.3%~67.4%,将相关数据应用于甲基汞暴露评估时,甲基汞的暴露水平较原来减少42%[36]。Caco-2 细胞模型应用于评估鱼肉中Hg和Se的生物利用度时,发现小肠细胞对Hg和Se的转运率低于14%,大部分Hg和Se残留在细胞内[47]。鱼肌肉中不同形态的有机砷可影响其生物利用度,砷甜菜碱较其它形态更容易通过Caco-2 单层细胞模型[85]。此外,Caco-2 细胞模型也应用于不同营养物质对鱼肌肉中多溴联苯醚生物利用度的影响[86]。
3 结语与展望
虽然大多数生物可及性和生物利用度体外模型最初应用于评估环境介质中污染物的潜在健康风险,然而随着模型进一步改良和推广应用,这些模型已适用于食品安全评估领域,作为评价化学污染物膳食暴露风险的策略。在评估过程中,一些模型方法如RIVM模型以及Caco-2 细胞模型,被不断地被修正和优化,更能真实反映化学污染物在体内消化吸收的情况。与其他模型一样,生物可及性和生物利用度的模型应该是简单、有效、适用性广的模型,但参数的相关性越大,适用性越广,复杂性也越高。因此,国内外学者在建立相关模型的研究上付诸了极大的努力。
目前,国内外在建立污染物的生物可及性和生物利用度模型方面已取得一定的成效,包括建立了较为成熟的静态模型,将结肠和肠道微生物引入模型,以及开发了新型的动态模型等,但仍存在尚待解决的问题:a.国际上还未出现标准化的方法或权威的效果评价手段可供使用。不同的生物可及性及利用度模型在相同的样本上使用显示出相似的趋势,但每次测试的不同操作条件又使不同方法之间产生较大范围的结果值,导致无法确定究竟哪种方法更为准确;b.不同污染物的易感人群不同,而不同人群(如婴儿和老年人)胃肠道内酶浓度等参数也有很大的不同,静态模型在此方面的应用上有较大的局限性。如为了更准确地模拟体内情况,应使用动态模型,可动态模型的复杂性同样限制了该模型应用推广;c.虽已将结肠和肠道微生物引入模型,但肠道微生物对有毒金属吸收的影响研究及对宿主和肠道微生物间的相互作用方面考虑较少,相关的模型也较为复杂,操作困难,还需进一步探索;d.不同的污染物常常有可能同时存在,并且在消化吸收的过程中相互影响,现有的研究大多数是侧重于单个污染物的研究,所以还需进一步探索这种相互作用,为暴露评估提供更多有用的信息。
