沉默LncRNA TUG1对骨肉瘤细胞放射敏感性影响
2021-07-22李同相王冰玲邓焰军
邵 林,李同相,肖 睿,王冰玲,邓焰军
(宜宾市第一人民医院a:骨二科;b:整形烧伤科,四川宜宾644000)
骨肉瘤属于骨原发性恶性肿瘤,其主要特点为侵袭性强、致死率高、致残率高及预见性差,严重影响患者生活质量[1]。目前放射治疗是治疗骨肉瘤的主要手段,但放射抵抗明显降低其治疗效果[2]。因此增强骨肉瘤患者放射敏感性成为亟待解决的问题。长链非编码RNA牛磺酸上调基因1(long non-coding RNA taurine upregulated gene1,LncRNA TUG1)在骨肉瘤中的表达与骨肉瘤预后不良及病情有关[3]。长链非编码的RNA TUG1通过在骨肉瘤细胞中充当mir-335-5p的ceRNA而促进迁移和侵袭[4~6]。然而,TUG1对骨肉瘤放射敏感性的影响仍然未知。因此本研究主要探讨放射抵抗的骨肉瘤细胞中TUG1变化对骨肉瘤细胞凋亡及放射敏感性的影响,分析其是否可通过吸附miR-328-3p而发挥作用以期为骨肉瘤治疗提供新靶点。
1 材料与方法
1.1 细胞与主要试剂
人成骨细胞hFOB 1.19由上海通派生物科技有限公司提供,骨肉瘤细胞HOS由上海赛默生物科技发展有限公司提供。
RPMI 1640培养基、胰蛋白酶、胎牛血清均购自美国Gibco公司;Lipofectamine2000转染试剂购自美国 Invitrogen公司;si-TUG1、miR-328-3p mimic、miR-328-3p inhibitor及其阴性对照质粒均购自上海吉玛生物科技有限公司;凋亡检测试剂盒购自美国Sigma公司;Trizol试剂购自北京索莱宝公司;反转录试剂盒与SYBR G人PCR Master Mix试剂盒均购自美国ABI公司。
1.2 细胞处理
室温使用X射线放疗机(6 MeV X)射线垂直照射细胞,照射剂量率为2.0 Gy/min,调整靶皮距(70 cm),照射剂量为600 cGy/次,培养12 h,用0.25%胰蛋白酶消化存活细胞,消化细胞进行传代培养,以上过程重复5次后将其命名为HOS-R细胞。
HOS-R细胞生长融合度达50%~80%时参照Li⁃pofectamine2000转染试剂说明书,将si-TUG1、miR-328-3p mimic及其相应阴性对照转染入HOS-R细胞,分别命名为沉默对照组、沉默TUG1组、过表达miR-NC组、过表达miR-328-3p组。再进行si-TUG1与miR-NC共转染,命名为TUG1+抑制miRNC组;si-TUG1与miR-328-3p inhibitor共转染,命名为沉默TUG1+抑制miR-328-3p组。转染前1 d将培养基更换为Opti-MEM减血清培养基,转染6 h后弃转染液并将细胞培养基更换为含有10%胎牛血清的 RPMI 1640 完全培养基培养[7]。
1.3 检测指标
1.3.1 照射与克隆形成试验
收取生长良好的HOS细胞与HOS-R细胞接种于6孔板,放入37℃恒温培养箱培养,用0、2、4、6、8 Gy不同照射剂量照射细胞,若出现细胞克隆团终止培养,用PBS洗涤3次×10 min,采用甲醇固定,20 min后用吉姆萨染色,40 min后用清水洗涤,置于显微镜下观察有效克隆数。绘制放射存活曲线图。
1.3.2 qRT-PCR检测
收集hFOB 1.19、HOS、HOS-R细胞及转染各组HOS-R细胞,分别加入Trizol试剂提取RNA,并按照反转录试剂盒说明书合成cDNA,qRT-PCR法检测TUG1、miR-328-3p相对表达量。
1.3.3 细胞凋亡检测
HOS-R细胞经4Gy剂量照射48 h后用预冷PBS洗涤细胞,加入100 μl 1×Binding Buffer重悬细胞,调整细胞密度(2×105个细胞/ml),取 195 μl细胞悬液依次加入 5 μl Annexin V-FITC(避光孵育 15 min,1 000 r/min转速离心3 min)与5 μl PI(避光孵育15 min),放入流式细胞仪检测细胞凋亡。
1.3.4 基因双荧光素酶检测
将含有miR-328-3p结合位点的TUG1 3'UTR序列及其突变体插入荧光素酶报告基因载体中得到TUG1-Wt、TUG1-Mut,同时将HOS-R细胞接种于24孔板,待细胞生长融合度达80%左右时分别将miR-328-3p mimic或 miR-NC与 TUG1-Wt、TUG1-Mut共转染HOS-R细胞,继续培养24 h后收集细胞,根据双荧光素酶报告基因检测试剂盒说明书测定相对荧光素酶活性。
1.4 统计学方法
2 结果
2.1 放射抵抗的骨肉瘤细胞中TUG1高表达
细胞存活分数与TUG1表达检测结果见图1。放射后HOS-R骨肉瘤细胞存活分数显著高于HOS细胞存活分数,差异有统计学意义(P<0.05)。Gy为2时(P<0.001),Gy为 4时(P<0.001),Gy为 6时(P<0.001),Gy为8时(P<0.001);HOS与HOS-R细胞中TUG1表达水平均显著高于人成骨细胞hFOB 1.19(P<0.001),HOS-R细胞中TUG1表达水平显著高于HOS细胞(P<0.001)。
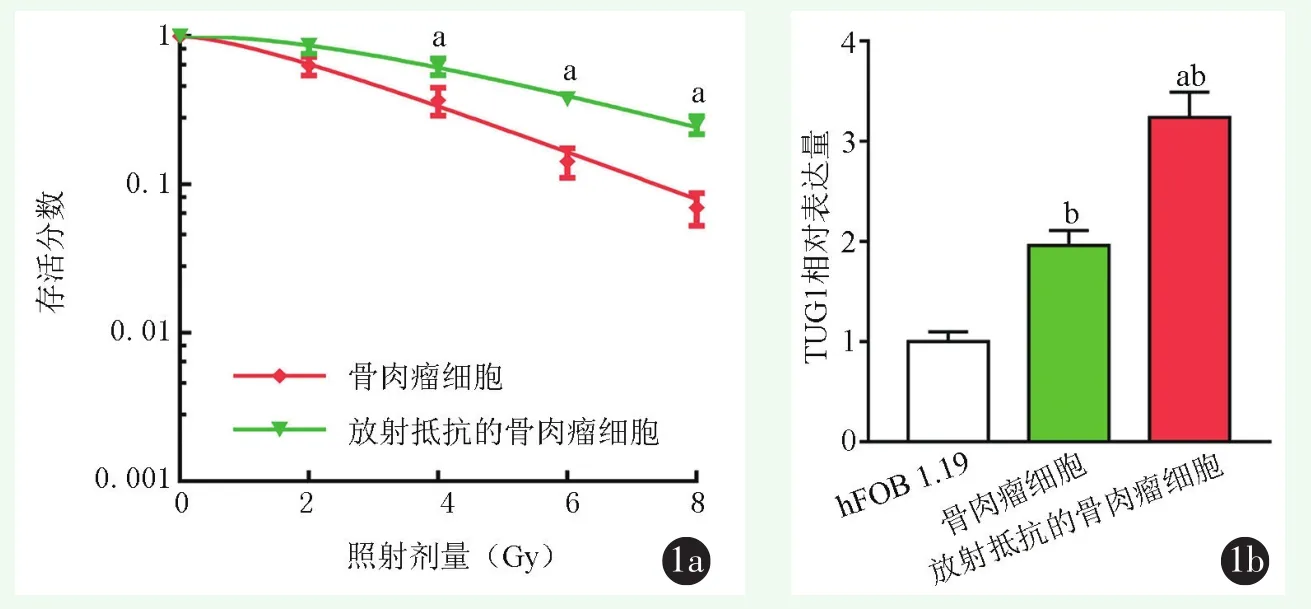
图1 放射抵抗的骨肉瘤细胞中TUG1的表达 1a:骨肉瘤细胞和放射抵抗的骨肉瘤细胞的放射存活曲线图 1b:人成骨细胞hFOB 1.19和骨肉瘤细胞、放射抵抗的骨肉瘤细胞中TUG1的表达情况,与骨肉瘤细胞相比,aP<0.05;与hFOB 1.19细胞相比,bP<0.05
2.2 沉默TUG1增加HOS-R细胞的放射敏感性
沉默对照组TUG1的表达量为(1.01±0.07),沉默TUG1组TUG1的表达量为(0.27±0.04),差异有统计学意义(P<0.001)。不同剂量照射向两组的细胞存活分数见图2,沉默TUG1组细胞存活分数较沉默对照组显著减少(P<0.05),Gy为2时(P<0.001),Gy为4时(P=0.000),Gy为6时(P<0.001),Gy为8时(P<0.001)。沉默TUG1组HOS-R细胞增敏比(SER)为 1.539。
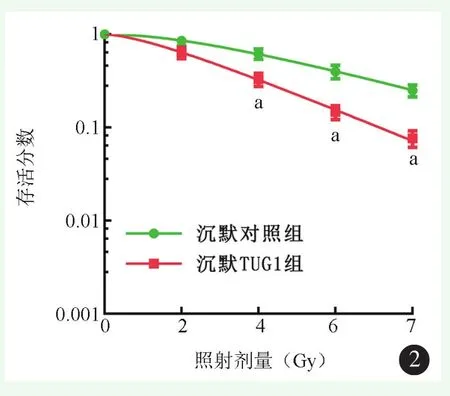
图2 沉默TUG1对放射抵抗的骨肉瘤细胞放射敏感性的影响
2.3 沉默TUG1促进放射照射诱导的HOS-R细胞凋亡
细胞凋亡检测结果见图3。沉默TUG1组与沉默对照+4Gy组较沉默对照组放射照射诱导的HOS-R细胞凋亡率明显增加(P<0.001),与沉默对照+4Gy组相比,沉默TUG1+4Gy组明显增加HOS-R细胞凋亡率(P<0.001)。
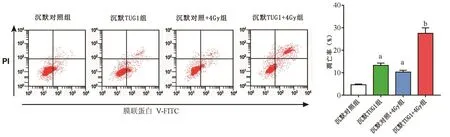
图3 沉默TUG1对4Gy辐射照射48 h后HOS-R细胞凋亡的影响 3a:流式细胞仪检测细胞凋亡情况 3b:细胞凋亡检测结果直方图,与沉默对照组相比,aP<0.05;与沉默对照+4Gy组相比,bP<0.05
2.4 TUG1可吸附调节miR-328-3p的表达
miR-328-3p基因双荧光素酶检测结果见图4。过表达miR-328-3p组相对荧光素酶活性显著降低(P=0.00),突变型TUG1-Mut相对荧光素酶活性无明显变化(P=0.367)。qRT-PCR检测沉默 TUG1后HOS-R细胞中miR-328-3p相对表达量明显高于沉默对照组(P<0.001)。
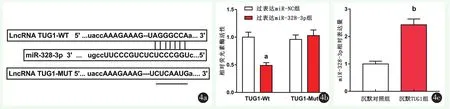
图4 TUG1可调控miR-328-3p的表达 4a:TUG1与miR-328-3p互补结合的核苷酸位点示意图 4b:过表达miR-328-3p对荧光素酶活性的影响 4c:沉默TUG1对HOS-R细胞中miR-328-3p表达的影响
2.5 过表达miR-328-3p增加HOS-R细胞的放射敏感性
miR-328-3p的表达对HOS-R细胞的放射敏感性的影响见图5。HOS细胞与HOS-R细胞中miR-328-3p的表达水平较hFOB 1.19细胞降低(P<0.001);miR-328-3p mimic转染HOS-R细胞后其表达水平显著升高(P<0.001);过表达miR-328-3p+4Gy组细胞凋亡率显著高于过表达miR-NC+4Gy组(P<0.001)。过表达 miR-328-3p放射增敏比为1.493。
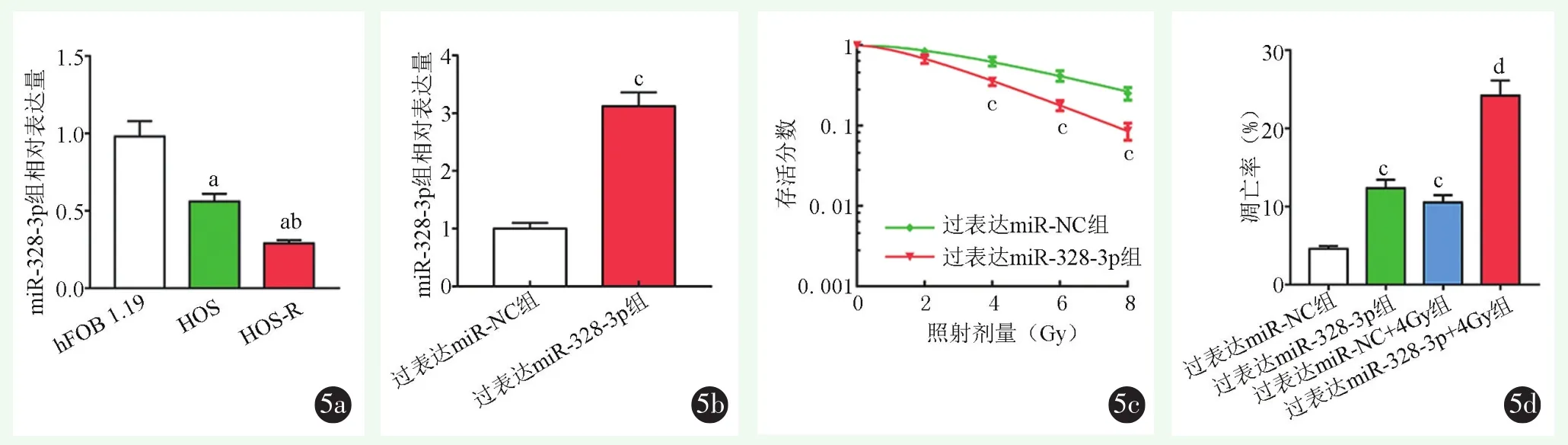
图5 过表达miR-328-3p对HOS-R细胞放射敏感性的影响:结果示与hFOB 1.19、HOS细胞相比,aP<0.05;与HOS细胞相比,bP<0.05;与过表达miR-NC组相比,cP<0.05;与过表达miR-NC+4Gy组相比,dP<0.05 5a:人成骨细胞hFOB 1.19和HOS、HOS-R骨肉瘤细胞中miR-328-3p的表达 5b:过表达miR-328-3p后HOS-R细胞中miR-328-3p的表达情况5c:过表达miR-328-3p对HOS-R细胞放射敏感性的影响情况 5d:过表达miR-328-3p对放射诱导的HOS-R细胞凋亡的影响
2.6 抑制miR-328-3p逆转了沉默TUG1对HOS-R细胞放射敏感性的影响
抑制miR-328-3p对沉默TUG1对HOS-R细胞放射敏感性的影响见图6。抑制miR-328-3p联合沉默TUG1后HOS-R细胞中miR-328-3p表达水平显著降低(P<0.001);抑制 miR-328-3p联合沉默TUG1后HOS-R细胞存活分数显著较高,抑制miR-328-3p联合沉默TUG1后放射诱导的HOS-R细胞凋亡率明显降低(P<0.001)。与沉默TUG1组放射增敏比(SER=1.487)相比,抑制miR-328-3p联合沉默TUG1后HOS-R细胞放射增敏比(SER=0.726)明显降低。
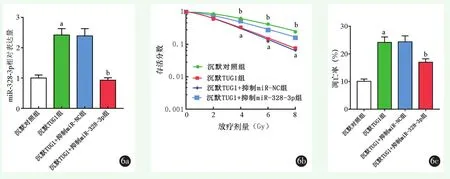
图6 抑制miR-328-3p联合沉默TUG1对HOS-R细胞放射敏感性及放射诱导的细胞凋亡的影响:结果示与沉默对照组相比,aP<0.05;与沉默TUG1+抑制miR-NC组相比,bP<0.05 6a:抑制miR-328-3p联合沉默TUG1后HOS-R细胞中miR-328-3p的表达 6b:抑制miR-328-3p联合沉默TUG1对HOS-R细胞放射敏感性的影响 6c:抑制miR-328-3p联合沉默TUG1对放射诱导的HOS-R细胞凋亡的影响
3 讨论
TUG1在脑胶质瘤细胞中呈高表达,沉默TUG1表达后,脑胶质瘤细胞增殖能力明显受到抑制并可诱导细胞凋亡[8]。沉默TUG1表达还可抑制神经母细胞瘤细胞迁移及侵袭能力[9]。宫颈癌细胞中TUG1表达上调,抑制TUG1表达后宫颈癌细胞增殖与侵袭能力亦受到抑制并可促进细胞凋亡[10]。TUG1在肺癌组织中表达水平高于对应癌旁组织,其表达量与肿瘤直径增大、高TNM分期相关,抑制其表达可抑制肺癌细胞增殖及促进细胞凋亡,沉默TUG1则可促进P16 m RNA及蛋白表达水平从而促进肺癌细胞生长[11]。与人正常乳腺上皮细胞HGC-27相比,TUG1在甲状腺癌组织和甲状腺癌细胞中表达上调,并可促进甲状腺癌细胞增殖、迁移及侵袭,下调其表达可抑制甲状腺癌细胞增殖、迁移及侵袭,TUG1还可通过竞争性结合miR-145而促进甲状腺癌细胞的进展[12]。与邻近组织中TUG1的表达相比,前列腺癌组织中TUG1的表达水平显著升高,其表达量与患者生存期有关,下调其表达可抑制前列腺癌细胞迁移及侵袭,上调其表达可促进前列腺癌细胞迁移及侵袭,敲除TUG1可抑制DGCR8的表达,上调TUG1表达后可促进DGCR8的表达,即TUG1可通过上调DGCR8的表达而促进前列腺癌细胞迁移及侵袭[13]。本研究结果显示,HOS与HOS-R细胞中TUG1表达水平显著升高,且同时随着照射剂量的不断增加HOS细胞存活分数低于HOS-R细胞存活分数,说明放射后可降低HOS细胞存活率但对HOS-R细胞无明显影响,其可能通过上调TUG1表达进而增强HOS-R细胞放射抵抗。经照射后发现细胞存活分数明显下降,细胞凋亡率随着沉默TUG1表达而显著增加,说明沉默TUG1表达可显著增强HOS-R细胞放射敏感性。提示抑制TUG1基因表达可能成为增强骨肉瘤细胞放射敏感性的潜在治疗靶点。
本研究用靶基因预测网站预测TUG1与miR-328-3p存在结合位点,推测TUG1可能对miR-328-3p有一定调控作用。提示TUG1可能通过靶向调控miR-328-3p的表达从而降低骨肉瘤细胞放射敏感性。miR-328-3p在非小细胞肺癌中低表达,上调miR-328-3p表达可抑制非小细胞肺癌细胞增殖及侵袭能力并可增强其放射敏感性[14]。miR-328-3p在胶质母细胞瘤、乳腺癌等恶性肿瘤细胞中表达水平均明显降低,并在肿瘤发生及发展过程中发挥抑癌基因作用[15]。本研究发现miR-328-3p可结合TUG1的3’UTR序列。沉默TUG1基因后miR-328-3p表达水平明显升高,上调miR-328-3p表达显著抑制HOS-R细胞存活分数并可诱导细胞凋亡进而增强HOS-R细胞的放射敏感性。抑制miR-328-3p表达联合沉默TUG1表达后HOS-R细胞存活分数明显增加而细胞凋亡率明显降低,放射增敏比亦明显降低,提示TUG1可直接调控miR-328-3p表达而影响HOS-R细胞放射敏感性。
综上所述,TUG1在骨肉瘤细胞与放射抵抗的骨肉瘤细胞中的表达量上调,而miR-328-3p的表达量下调,TUG1可通过靶向作用于miR-328-3p从而调控骨肉瘤细胞放射敏感性,沉默TUG1表达可增强骨肉瘤细胞的放射敏感性。但关于其具体作用机制尚需进一步探究。
