酵母细胞壁多糖对滩羊生长性能、免疫及抗氧化指标的影响
2021-07-22马吉锋赵东琪张建勇张俊丽梁小军张力莉
■马吉锋 赵东琪 张建勇 张俊丽 梁小军 张力莉
(1.宁夏农林科学院动物科学研究所,宁夏银川 750002;2.宁夏大学农学院,宁夏银川 750021;3.宁夏畜牧工作站,宁夏银川 750002)
随着畜牧业快速发展,动物饲料抗生素添加问题日益受到关注,抗生素大量使用及高残留、耐药性已经造成严重危害,目前开发抗生素替代品已成为研究热点。酵母细胞壁多糖作为一种替代品具有来源广泛、绿色高效、无残留、无耐药性等优点,在保护肠道健康[1]、吸附多种霉菌毒素[2]、增强机体免疫和应激抵抗力[3]、提高饲料转化率、促进动物生长发育等方面发挥了重要作用[4-5]。刘洪梅等[6]研究表明,在饲料中添加啤酒酵母β-葡聚糖制剂能有效提高鲤鱼的采食量、存活率,增强免疫功能。张金宝等[7]发现在哺乳仔猪饲料中添加酵母细胞壁多糖能显著提高断奶仔猪的生长性能,降低腹泻率,抑制肠道有害菌的生长。谭本杰等[8]在肉鸡日粮中添加酵母多糖能明显提高肉鸡生产性能,增强机体免疫力。酵母细胞壁多糖在单胃动物日粮中添加的报道较多,在肉羊生产中鲜有报道。封山禁牧后,滩羊由放牧到舍饲养殖,在高精料育肥情况下,滩羊免疫力下降,羊肉品质降低。本试验通过在育肥滩羊基础饲粮中添加酵母细胞壁多糖,探究酵母细胞壁多糖对滩羊生产性能、免疫及抗氧化指标的影响,以期为宁夏滩羊产业健康持续发展提供理论依据。
1 材料与方法
1.1 材料
1.1.1 酵母细胞壁多糖
由安琪酵母有限公司提供,甘露聚糖≥20%,β-葡聚糖20%~30%。
1.1.2 试验羊的选择和分组
采用完全随机区组设计方法,选择身体健康、记录齐全、体重30 kg 左右的育肥公滩羊60 只,平均分为四组,每组15 只圈养,对照组饲喂基础饲粮,试验1、2、3 组分别在对照组的基础上添加0.1%、0.2%和0.3%的酵母细胞壁多糖,各组羊只均编号入舍。试验期共70 d,其中预试期10 d,在预试期内对参试羔羊按常规程序进行消毒、防疫、打耳号、驱虫。正试期60 d,每天06:00、18:00 分2 次进行饲喂,自由饮水。
1.2 试验日粮
根据各阶段肉羊对营养物质需求,参照《肉羊饲养标准》(NY/T 816—2004)配制,饲粮组成及营养水平见表1。

表1 基础饲粮组成及营养水平(干物质基础)
1.3 生长性能测定指标及方法
增重及日增重:分别于试验开始和试验结束对滩羊个体空腹24 h进行称重,计算增重和日增重。
采食量:每天饲喂前对饲料进行称重,于第2 d清晨饲喂前对剩料进行称重。
1.4 屠宰指标测定及方法
严格按照羊屠宰工艺流程,需要屠宰的羊只宰前24 h停止饲喂,宰前8 h要停止饮水。
1.4.1 宰前体重
屠宰前停食24 h实测体重。
1.4.2 胴体重
屠宰放血后,去毛皮,去内脏、头和蹄(除肾脏及周围脂肪)静置30 min后称量。
1.4.3 眼肌面积
测量倒数第1和第2肋骨之间脊椎上眼肌横切面面积。在最后1~2 胸椎处切开,经冰冻定型后,用硫酸纸描绘眼肌轮廓,用求积仪测量面积;也可以用公式计算:眼肌面积=眼肌高×眼肌宽×0.7。
1.4.4 屠宰率
屠宰率(%)=胴体重/宰前活重×100
1.4.5 GR值
指在第12 与第13 肋骨之间,距背中线11 cm处的皮下脂肪组织厚度,作为代表胴体脂肪含量的标志。
1.4.6 背膘厚的测定
采用游标卡尺测量胴体两侧的第12与第13肋骨肋处背膘厚。
1.5 肉品质测定及方法
1.5.1 取样
从每只试验羊胴体第12根肋骨后取背最长肌约400 g,用自封袋封口包装,贴上标签,置于0~4 ℃保存,尽快用于测定肉品质各项指标。
1.5.2 物理指标测定
主要包括熟肉率、失水率、嫩度。
1.5.2.1 嫩度宰后2 h 内,用嫩度仪自带取样器垂直于肌纤维方向取背最长肌约1.5 cm厚的肉样,用嫩度仪测定剪切值,每个样3个重复,单位为N。
1.5.2.2 系水力
用0.01 g的扭力天平称量供试肉样(W1),在肉样上下各覆盖一层医用纱布,纱布外各垫18 片快速定型分析滤纸,然后将垫好的肉样放置于压力仪的平台上,匀速缓慢摇动压力仪的摇把,将平台升至压力仪显示相当于35 kg 的读数时为止,保持5 min,然后迅速松动摇把,压力读数复位,取出肉样,立即在天平上称重(W2),计算系水率。肌肉系水力(%)=(W1-W2)/W1×100。
1.5.2.3 熟肉率
取背最长肌肉样50 g 左右,放入沸水中煮沸30 min,取出后晾30 min,计算熟肉率。熟肉率(%)=(蒸后肉样重/蒸前肉样重)×100。
1.6 血液采集及血液指标测定
1.6.1 血清制备
在试验结束当天早晨空腹颈静脉采集10 mL 血液,静止30 min 后,3 000 r/min 离心5 min 制备血清,待测血清中的生化指标、抗氧化指标及免疫指标。
1.6.2 测定方法
血液生化指标测定:血清中总蛋白(TP)、球蛋白(GLOB)、白蛋白(ALB)、谷丙转氨酶(ALT)、血清尿素氮(UREA)用贝克曼公司Au5800 全自动生化分析仪测定,胰岛素(INS)采用放射免疫分析法测定。
免疫因子测定:绵羊干扰素-γ(IFN-γ)(ELISA试剂盒生产批号E20190920-74008A)采用酶联免疫法测定、绵羊白细胞介素2(IL-2)(ELISA 试剂盒生产批号E20190912-74011A)采用酶联免疫法测定、绵羊白细胞介素6(IL-6)(ELISA试剂盒生产批号E20190908-74013A)采用酶联免疫法测定、绵羊白细胞介素10(IL-10)(ELISA 试剂盒生产批号E20190913-74827A)采用酶联免疫法测定、肿瘤坏死因子α(TNF-α)采用放射免疫分析法测定。
免疫指标:绵羊免疫球蛋白A(IgA)(ELISA 试剂盒生产批号E20190918-74033A)采用酶联免疫法测定、绵羊免疫球蛋白G(IgG)(ELISA 试剂盒生产批号E20190919-74034A)采用酶联免疫法测定、绵羊免疫球蛋白M(IgM)(ELISA 试剂盒生产批号E20190916-74038A)采用酶联免疫法测定。
抗氧化指标测定:绵羊超氧化物歧化酶(SOD)(ELISA 试剂盒生产批号E20190929-74016A)采用比色法测定、绵羊谷胱甘肽过氧化物酶(GSH-Px)(ELI⁃SA 试剂盒生产批号E20190911-74025A)采用比色法测定、绵羊总抗氧化物(T-AOC)(ELISA 试剂盒生产批号E20190906-74921A)采用比色法测定、绵羊丙二醛(MDA)(ELISA 试剂盒生产批号E20190926-77036A)采用比色法测定。
1.7 数据处理
试验数据采用SPSS 13.0统计软件进行单因素方差分析及LSD法进行多重比较,结果用“平均值±标准差”表示。
2 结果与分析
2.1 酵母细胞壁多糖对滩羊生长性能的影响(见表2)

表2 酵母细胞壁多糖对滩羊生长性能的影响
由表2 可知,滩羊育肥期日增重试验2 组均高于试验1组、试验3组、对照组,且与试验3组、对照组差异显著(P<0.05);干物质采食量量各组差异不显著(P>0.05),但饲料转化效率试验2 组优于其他组(P<0.05),表明添加0.2%的酵母细胞壁多糖的育肥效果优于其他组。
2.2 酵母细胞壁多糖对滩羊屠宰性能的影响(见表3)
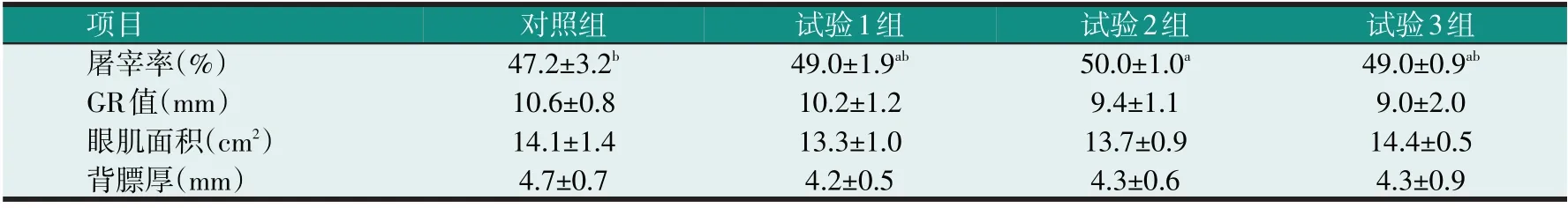
表3 酵母细胞壁多糖对滩羊屠宰性能的影响
由表3 可知,试验2 组的屠宰率显著高于对照组(P<0.05),滩羊的GR 值、眼肌面积、背膘厚各组间差异不显著(P>0.05),但试验组的背膘厚均低于对照组,说明添加酵母细胞壁多糖有提高屠宰率、减少背膘厚的趋势。
2.3 酵母细胞壁多糖对滩羊肉品质的影响(见表4)
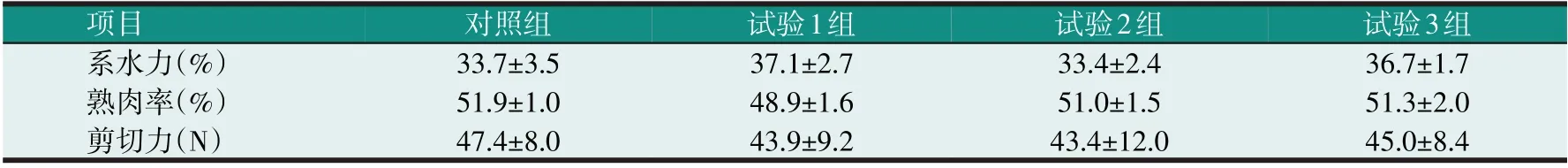
表4 酵母细胞壁多糖对滩羊肉品质的影响
由表4可知,各组间系水力、熟肉率、剪切力差异不显著(P>0.05),但试验组剪切力值均低于对照组,说明添加酵母细胞壁多糖有改善羊肉嫩度的趋势。
2.4 酵母细胞壁多糖对滩羊免疫指标的影响(见表5)

表5 酵母细胞壁多糖对滩羊免疫指标的影响
由表5 可知,IgM 试验2 组与试验1 组、对照组差异极显著(P<0.01),试验3组与试验1组、对照组差异显著(P<0.05),其他各组间差异不显著(P>0.05)。IgG 试验2 组与试验1 组、试验3 组、对照组差异极显著(P<0.01),试验3组与试验2组、对照组差异极显著(P<0.01),其他各组间差异不显著(P>0.05)。IgA 试验2 组与试验1 组、对照组差异极显著(P<0.01)。试验3 组与对照组差异极显著(P<0.01),其他各组间差异不显著(P>0.05)。
2.5 酵母细胞壁多糖对滩羊免疫因子的影响(见表6)

表6 酵母细胞壁多糖对滩羊免疫因子的影响
由表6 可知,IL-2 试验2 组与对照组差异显著(P<0.05); 试验3组与试验1组差异显著(P<0.05),和对照组差异极显著(P<0.01);其他各组间差异不显著(P>0.05)。IL-6各组间差异不显著(P>0.05)。IL-10试验2 组与试验1 组差异显著(P<0.05),与对照组差异极显著(P<0.01);其他各组间差异不显著(P>0.05)。IFN-γ 试验2 组与试验1 组差异显著(P<0.05),和对照组差异极显著(P<0.01);试验3 组与对照组差异极显著(P<0.01);其他各组间差异不显著(P>0.05)。TNF-α试验2 组与对照组差异显著(P<0.05);试验3 组与对照组差异极显著(P<0.01),其他各组间差异不显著(P>0.05)。
2.6 酵母细胞壁多糖对滩羊血液抗氧化指标的影响(见表7)

表7 酵母细胞壁多糖对滩羊血液抗氧化指标的影响
由表7可知,SOD试验1组、试验2组、试验3组与对照组差异极显著(P<0.01);试验3 组与试验1 组差异显著(P<0.05);其他各组间差异不显著(P>0.05)。MDA试验1组、试验2组、试验3组和对照组差异极显著(P<0.01);其他各组间差异不显著(P>0.05)。GSH-Px 试验2组与试验1组、对照组差异极显著(P<0.01),其他各组间差异不显著(P>0.05)。T-AOC 试验1 组、试验2 组、试验3 组与对照组差异极显著(P<0.01),其他各组间差异不显著(P>0.05)。
2.7 酵母细胞壁多糖对滩羊血液生化指标的影响(见表8)
由表8 可知,试验组的滩羊血液生化指标TP、GLOB 比对照组均有提高,但各组间差异不显著(P>0.05);ALB、A/G、UREA 各组间差异均不显著(P>0.05);ALT 各试验组均低于对照组,且试验1 组与对照组差异显著(P<0.05);INS 试验3 组高于对照组、试验1 组、试验2 组,且与对照组差异极显著(P<0.01)。
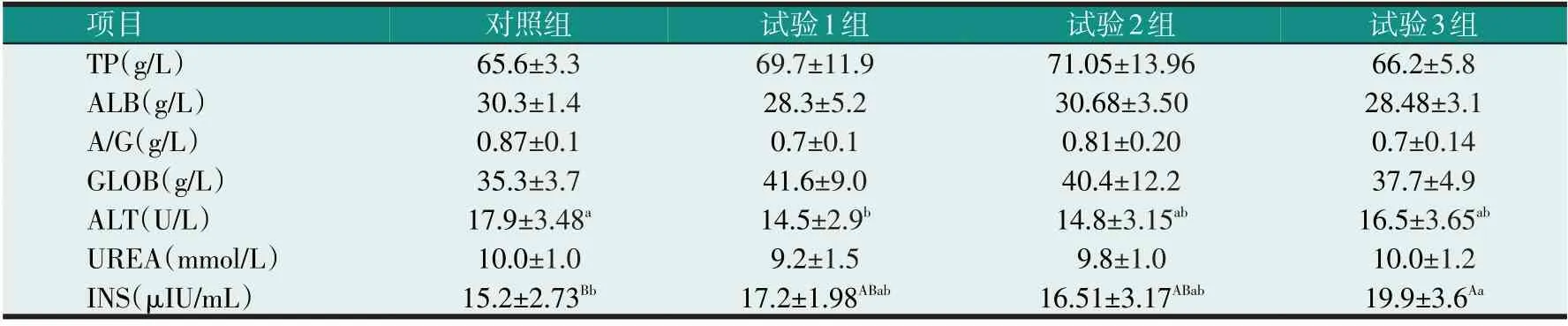
表8 酵母细胞壁多糖对滩羊血液生化指标的影响
3 讨论
3.1 酵母细胞壁多糖对滩羊生长性能、屠宰性能及肉品质的影响
日增重通常用来表示家畜的生长速度,是反映家畜生长性能和饲料利用率的重要指标。许飞龙等[10]研究表明日粮中添加0.1%的酵母细胞壁多糖对提高断奶仔猪的日增重有改善作用。王辉田等[11]发现日粮中添加2 000 mg/kg 的酵母细胞壁多糖提高了22~43日龄肉仔鸡的日增重,并降低了料肉比。薛萍等[12]研究表明产蛋鸡饲粮中酵母细胞壁多糖和益生素的不同添加剂量组合均可改善蛋鸡生产性能。本试验中,添加0.1%、0.2%的酵母细胞壁多糖与上述结果一致,但添加量为0.3%时,滩羊的ADG 明显降低,与Wang等[13]、许飞龙等[10]、刘观忠等[14]的报道一致,可能是由于酵母细胞多糖中甘露寡糖改善了肠道内环境和菌群结构,促进有益菌群生长,提高了免疫力,促进营养物质在小肠的吸收,从而促进动物生长,但比例较高的酵母细胞壁多糖抑制了滩羊肠道微生物的生长,从而影响了滩羊的生长性能。
屠宰性能是肉羊屠宰价值的重要参考,屠宰率是反映动物屠宰性能的重要指标,眼肌面积反映动物胴体的发育程度。背膘厚度是胴体品质测定的另一个重要指标,其厚度与瘦肉率呈负相关[15]。酵母细胞壁多糖对牛、羊屠宰性能的研究报道很少,本试验研究表明,日粮中添加酵母细胞壁多糖提高了滩羊的屠宰率、GR 值、背膘厚各组无明显差异,但背膘厚低于对照组,说明添加酵母细胞壁多糖有提高屠宰率、减少背膘厚的趋势。
随着人们生活水平的提高,肉的食用品质(涉及熟肉率、系水力、剪切力等多个指标特性)的研究越来越受到人们的关注[16]。本试验中,酵母细胞壁多糖各添加组熟肉率、系水力与对照组相比无明显变化,但剪切力比对照组均有降低,说明添加酵母多糖对滩羊肉熟肉率、系水力基本没有影响,对滩羊肉的嫩度有改善的趋势。
3.2 酵母细胞壁多糖对滩羊免疫指标的影响
酵母细胞壁多糖通过改变动物机体免疫过程中的多个途径增强机体的特异性和非特异性免疫力,最终调节动物机体免疫[17]。黄婧溪等[18]研究表明,添加酵母细胞壁多糖能提高黄羽肉鸡的免疫性能。李学俭[19]研究表明β-甘露聚糖酶可以显著提高断奶仔猪血清IgG、IgA 水平。本试验中,滩羊日粮中添加酵母细胞壁多糖时,滩羊血清中IgG、IgA、IgM 的浓度显著高于对照组,与上述研究结果基本一致,添加比例为0.2%时,IgG、IgA、IgM浓度都达到最高,表明在滩羊日粮中添加酵母细胞壁多糖可以一定程度上提高滩羊的机体免疫力。邵亚群等[20]在日粮中添加酵母细胞壁多糖能够显著提高犊牛血清中免疫球蛋白IgG 和IgA含量以及IL-4和TNF-α含量,增强犊牛机体免疫力。刘星[21]发现在肉鸡饲粮中添加酵母细胞壁多糖IL-2水平有升高趋势。本试验中,酵母细胞壁多糖添加组滩羊血清IL-2、IL-10、IFN-γ、TNF-α浓度均比对照组有提高,IL-6 浓度有降低的趋势,这与上述研究结果有相似之处,还有研究表明,断奶仔猪日粮添加毕赤酵母甘露寡糖对IL-2和IFN-γ无显著影响,添加0.2%毕赤酵母甘露寡糖明显提高断奶仔猪血清中IL-10 的含量,降低血清中TNF-a 含量[22],与本试验中部分结论不一致,说明添加酵母细胞壁多糖可能通过分泌促进IL-10 等抗炎性因子来缓解过度免疫反应和免疫应激,这与IgA、IgG、IgM 随着酵母细胞壁多糖添加量增加而递减相印证,促炎因子IL-2、IFN-γ、TNFα与抗炎性因子IL-10 同步升高,可能因为试验期间每天补充酵母细胞壁多糖使机体产生了细胞免疫耐受,本试验只在试验结束时采血,正好赶上酵母细胞壁多糖引起细胞因子发生改变,抗炎因子IL-10 未能真正发挥作用导致促炎因子的同步升高,抗炎因子发生作用后细胞又回到原来水平来降低炎症反应从而促进机体将摄入的营养物质更多地用于生长而非调动免疫反应增加机体对营养物质的利用率,从而提高滩羊生产性能[22]。
3.3 酵母细胞壁多糖对滩羊血液抗氧化指标的影响
在机体的抗氧化系统中,SOD、GSH-Px能清除机体过量自由基,减缓机体氧化应激状态,在维持细胞的氧化与抗氧化平衡过程中扮演着重要角色[23]。MDA是机体脂质过氧化的最终产物,具有细胞毒性,会造成一系列细胞结构和功能的破坏,其含量高低反映氧自由基水平和脂质过氧化的强度和速率,当含量升高时,机体的抗氧化作用减弱。张勇等[24]研究发现,保持较低水平的酵母细胞壁多糖可以提高猪血清中SOD 水平。邵良平等[25]给哺乳仔猪灌服甘露寡糖至28 d 断奶,发现甘露寡糖能够极显著地提高GSH-Px和SOD活性。黄婧溪等[18]研究表明,添加酵母细胞壁多糖未改变42 d黄羽肉鸡血清GSH-Px的水平,但可以提高T-AOC 水平。本试验中,滩羊饲粮中添加酵母细胞壁多糖提高了血清中SOD、GSH-Px、T-AOC的含量,降低了MDA浓度,与黄小珍等[26]、康雨芳[27]的研究结果一致,说明滩羊日粮中添加一定比例酵母细胞壁多糖能够通过提高SOD和GSH-Px等抗氧化酶的活性,以及清除羟自由基、提高超氧阴离子清除活性和增强抗脂质过氧化的作用来提高滩羊机体内的抗氧化水平[18]。
3.4 酵母细胞壁多糖对滩羊血液生化指标的影响
血液生化指标中TP 可以反映动物的抗体含量,抵抗力水平;ALB 可以维持血浆渗透压,并对机体有保护作用;GLOB 可以抵抗外界入侵物,具有免疫功能。本试验中,添加酵母细胞壁多糖提高了GLOB含量,同时提高了滩羊血清TP含量,尤其以0.2%酵母细胞壁多糖为最高,说明添加酵母细胞壁多糖提高了滩羊机体抵抗力水平,从而促进了其健康生长[28]。ALB、A/G 酵母细胞壁多糖添加组与对照组相比均无明显变化,说明添加酵母细胞壁多糖可维持血浆渗透压,调节机体的免疫应答[29]。UREA可以反映蛋白质代谢状态,UREA酵母多糖添加组与对照组差异不显著,说明本试验酵母细胞壁多糖的添加水平对机体氮代谢无影响。ALT是检测肝功能的重要指标,本试验中添加酵母细胞壁多糖降低了ALT水平,表明对肝脏无毒性,起到一定保护肝脏的作用。INS 可以促进机体对脂肪和蛋白质的合成,本试验中INS酵母细胞壁多糖添加组较对照组均有提高,可能是添加酵母细胞壁多糖提高抗氧化酶SOD、T-AOC 和GSH-Px 的活性,同时降低了血浆中MDA 含量,减轻脏器组织形态的损伤,促进胰岛素分泌[30]。
4 结论
在日粮中添加酵母细胞壁多糖可以促进滩羊机体抗氧化物的生成,改善滩羊的抗氧化能力和免疫机能,提高滩羊饲料转化效率,增加滩羊日增重,当添加比例为0.2%时效果最好。
