CuCl催化串联反应构建氢化异香豆素衍生物
2021-07-22冯弼曦
冯弼曦
(河南省核工业地质局,河南 郑州 450044)
氢化异香豆素骨架化合物存在于很多天然产物和药物分子当中,具有一定的生物活性与药用价值[1]。例如,蜂蜜曲菌素Mellein具有杀菌、抗菌的特性;赭曲霉毒素Ochratoxin是一种一种真菌毒素,对人巨噬细胞的免疫起到了一定的调节作用;绣球素Pestalotiopisorin是从绣球叶中分离,能促进3T3-L1细胞的生成,并具有抗糖尿病的特性[2-5](图 1)。因此,发展一种高效便捷的方法合成氢化异香豆素骨架化合物具有很重要的研究意义。
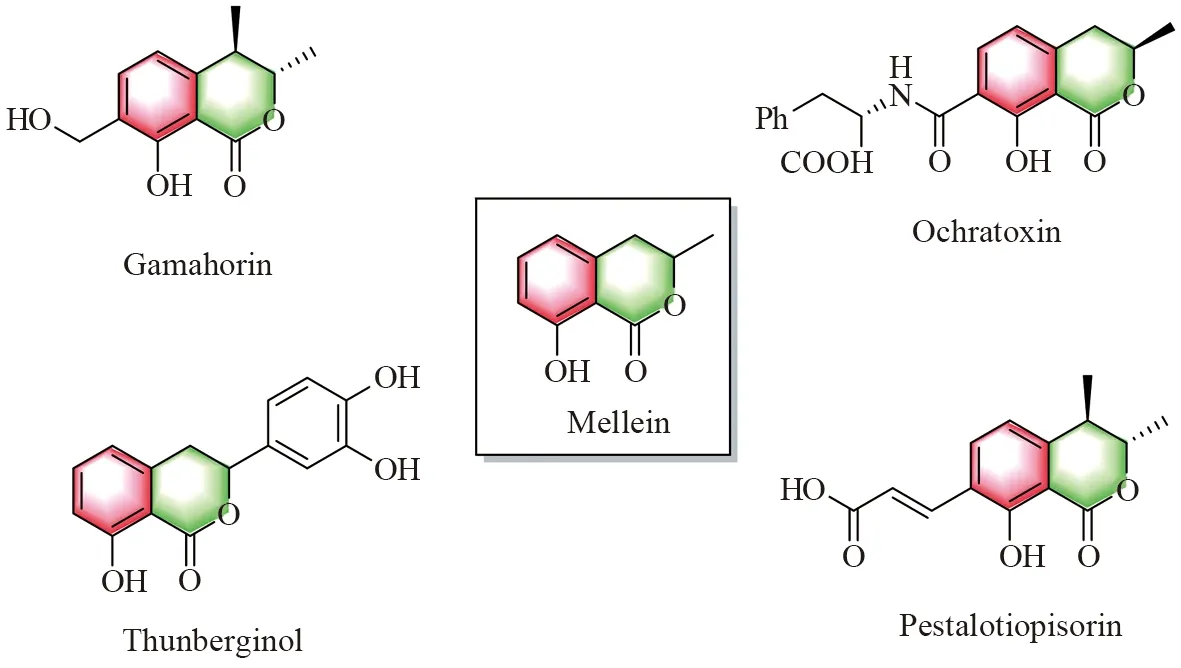
图1 几种含氢化异香豆素骨架的天然产物Fig.1 Some natural products containing the skeleton of hydroisocoumarin
芳环化反应是当前合成芳香化合物的主要策略之一,如过渡金属催化炔烃的[2+2+2][6-7]和[4+2]苯环化反应[8-9]、电子环化反应[10-11]、[5+1]环化反应[12]等。在众多报道中,区域选择性限制了这些反应的应用,同时大多数需要金属参与,造价昂贵。我们设想以简单易得的廉价原料出发,即以4-羟基-6-甲基-2-吡喃酮与邻羟基查尔酮为合成子,通过一锅串联反应合成氢化异香豆素骨架化合物,该产物的结构经过1H NMR、13C NMR进行表征,确定了3a的绝对构型(图2)。在筛选了不同反应条件对该反应过程的影响后,考察了该反应的底物范围。
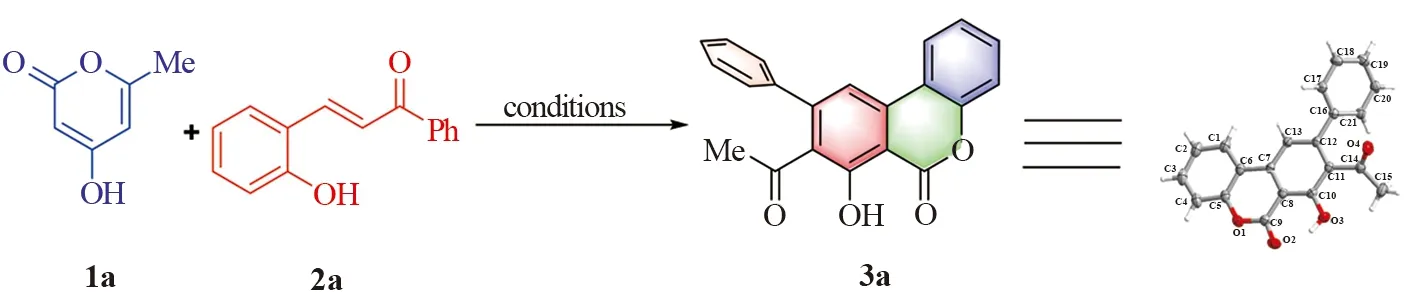
图2 3a合成路线Fig.2 Synthesis route of 3a
1.1 仪器与试剂
1HNMR、13CNMR分别用Bruker Avance 400型核磁共振仪和Bruker Avance 300型核磁共振仪测定,CDCl3化学位移以ppm 作单位, Me4Si作内标;高分辨质谱用Bruker QTOF质谱仪测定。所有常用的溶剂均为国产分析纯试剂。
1.2 氢化异香豆素骨架化合物的合成方法
在干燥的反应试管中分别加入0.2 mmol1、0.24 mmol2、0.04 mmol CuCl为催化剂,于80 ℃下搅拌,TLC检测反应完全后,反应体系减压蒸馏除去溶剂,柱色谱分离(石油醚/乙酸乙酯作洗脱剂),即可获得氢化异香豆素骨架化合物3。
2 结果与讨论
2.1 反应条件的优化
为了提高氢化异香豆素3a的合成收率,我们对反应条件进行了优化(表1)。首先,以乙酸乙酯为溶剂,0.2 mmol 4-羟基-6-甲基-2-吡喃酮1a与1当量的邻羟基查尔酮2a为底物,于80℃下,三氟甲磺酸铋催化,反应72 h后,以36%的核磁收率获得目标产物3a(表1,Entry 1)。在一系列催化剂筛选后,氯化亚酮的催化效果最好,以42%的核磁收率获得目标产物3a(表1, Entry 4)。接下来,我们对反应的溶剂进行了筛选,在乙腈溶剂中,以55%的核磁收率得到目标产物3a(表1, Entry 8)。当我们增加邻羟基查尔酮2a的量至1.2 当量时,反应核磁收率达到70%,分离收率59%。
表1 反应条件的优化
2.2 底物扩展
为了验证该合成策略的普适性,在最优反应条件下,对邻羟基查尔酮上不同取代基的底物的范围进行了考察。结果发现对于各种取代基,反应都能顺利进行,并以中等的产率得到氢化异香豆素骨架化合物3(图3,3a-3f)。
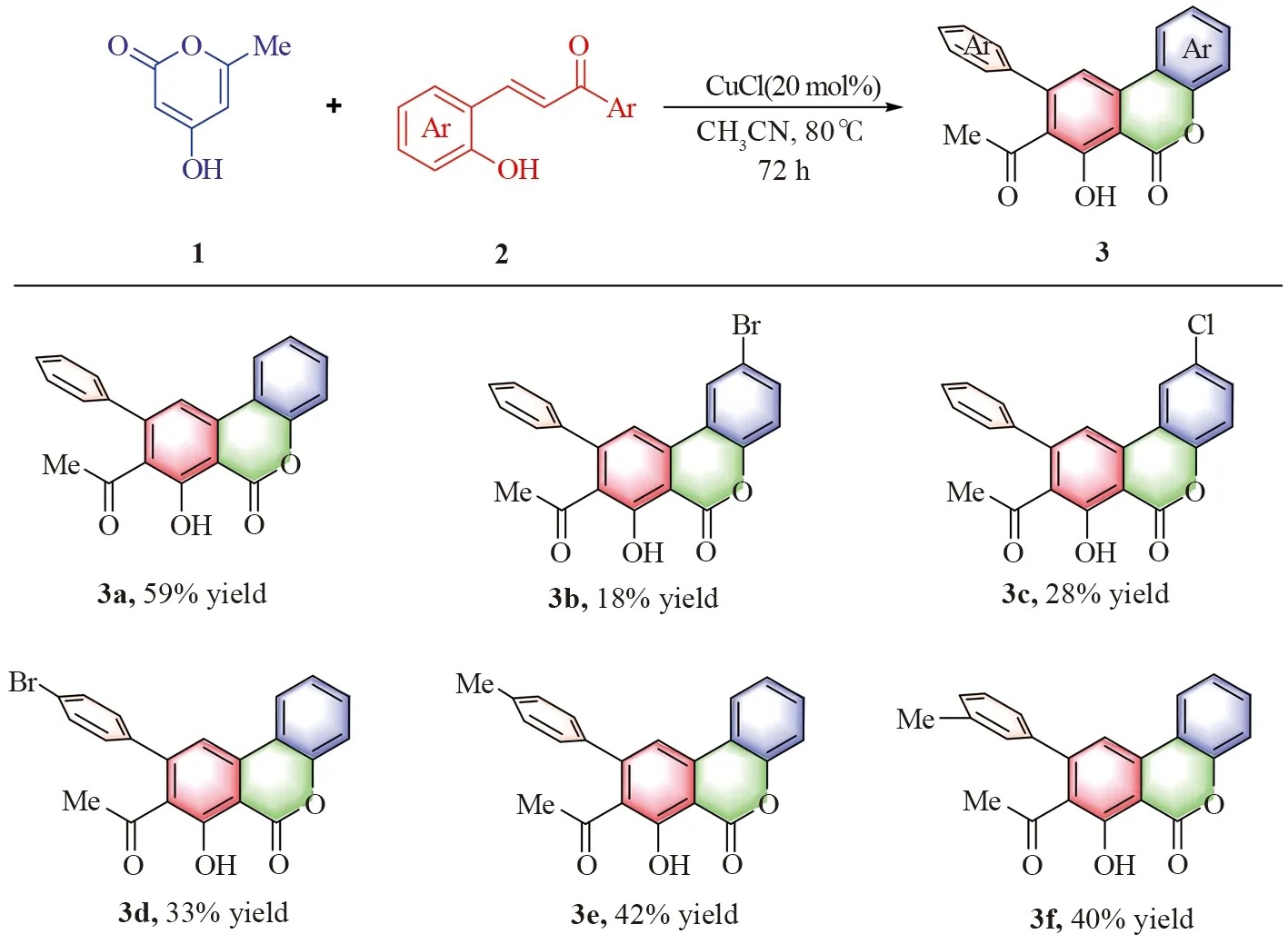
图3 底物范围Fig.3 Substrate range
3a, 8-acetyl-7-hydroxy-9-phenyl-6H-benzo[c]chromen-6-one
淡黄色固体, 产量 38.8 mg, 收率 59%, 反应时间 72 h, 柱层析 (石油醚:乙酸乙酯 = 20∶1~15∶1), 熔点189.6~190.8 ℃;1H NMR (400 MHz, CDCl3)δ11.65 (s, 1H), 7.90 (d,J= 12.0 Hz, 1H), 7.42~7.37 (m, 2H), 7.34~7.32 (m, 3H), 7.29(d,J= 4.0 Hz, 2H), 7.26 (s, 1H), 7.23 (s, 1H), 2.17 (s, 3H);13C NMR (100 MHz, CDCl3)δ202.2, 165.1, 159.0, 150.8, 148.3, 138.9, 135.4, 131.3, 129.3, 128.8, 128.8, 128.5, 125.4, 123.4, 117.8, 117.6, 113.8, 105.0, 32.2。 HRMS (ESI) calcd for C21H15O4[M+H]+: 331.096 5, found: 331.096 1。
3b, 8-acetyl-2-bromo-7-hydroxy-9-phenyl-6H-benzo[c]chromen-6-one
白色固体, 产量 14.9 mg, 收率 18%, 反应时间 72 h, 柱层析 (石油醚:乙酸乙酯 = 25∶1~20∶1), 熔点 201.1~201.8 ℃;1H NMR (400 MHz, CDCl3)δ11.65 (s, 1H), 8.16 (s, 1H), 7.63 (d,J= 8.0 Hz, 1H), 7.51 (s, 1H), 7.47~7.46 (m, 3H), 7.42~7.40 (m, 2H), 7.30 (d,J= 8.0 Hz, 1H), 2.30 (s, 3H);13C NMR (100 MHz, CDCl3)δ202.0, 164.6, 159.0, 149.8, 148.6, 138.6, 134.1, 134.1, 130.1, 129.0, 128.9, 128.5, 126.3, 119.6, 119.5, 118.5, 114.0, 105.0, 32.2。 HRMS (ESI) calcd for C21H14BrO4[M+H]+: 409.007 0, found: 409.006 6。
3c, 8-acetyl-2-chloro-7-hydroxy-9-phenyl-6H-benzo[c]chromen-6-one
黄色固体, 产量 20.6 mg, 收率 28%, 反应时间 72 h, 柱层析 (石油醚:乙酸乙酯 = 25∶1~20∶1), 熔点 200.5~201.3 ℃;1H NMR (400 MHz, CDCl3)δ11.56 (s, 1H), 7.88 (d,J= 4.0 Hz, 1H), 7.37 (s, 1H), 7.35~7.33 (m, 3H), 7.28~7.26 (m, 2H), 7.22 (d,J= 8.0 Hz, 1H) , 7.12 (s, 1H), 2.16 (s, 3H);13C NMR (100 MHz, CDCl3)δ202.0, 164.7, 159.1, 149.3, 148.5, 138.6, 134.2, 131.3, 131.1, 130.1, 129.0, 128.9, 128.5, 123.3, 119.3, 119.1, 114.0, 105.0, 32.2。 HRMS (ESI) calcd for C21H14ClO4[M+H]+: 365.057 5, found: 365.056 6。
3d, 8-acetyl-9-(4-bromophenyl)-7-hydroxy-6H-benzo[c]chromen-6-one
绿色固体, 产量 27.2 mg, 收率 33%, 反应时间 72 h, 柱层析 (石油醚:乙酸乙酯 = 25∶1~20∶1), 熔点 202.6~203.4 ℃;1H NMR (400 MHz, CDCl3)δ11.81 (s, 1H), 8.02 (d,J= 8.0 Hz, 1H), 7.58 (d,J= 8.0 Hz, 2H), 7.53 (d,J= 8.0 Hz, 1H), 7.50 (s, 1H), 7.40~7.36 (m, 2H), 7.27 (d,J= 8.0 Hz, 2H), 2.36 (s, 3H);13C NMR (100 MHz, CDCl3)δ202.0, 165.0, 159.2, 150.9, 147.1, 137.8, 135.7, 132.0, 131.5, 130.1, 129.1, 125.5, 123.5, 123.3, 117.9, 117.5, 113.7, 105.3, 32.4。 HRMS (ESI) calcd for C21H14BrO4[M+H]+: 409.007 0, found: 409.006 6。
3e, 8-acetyl-7-hydroxy-9-(p-tolyl)-6H-benzo[c]chromen-6-one
绿色固体, 产量 28.7 mg, 收率 42%, 反应时间 72 h, 柱层析 (石油醚:乙酸乙酯 = 25∶1~20∶1), 熔点 194.6~195.5 ℃;1H NMR (400 MHz, CDCl3)δ11.78 (s, 1H), 8.05 (d,J= 8.0 Hz, 1H), 7.55 (s, 1H), 7.54~7.52 (m, 1H), 7.40~7.35 (m, 2H), 7.33 (d,J= 8.0 Hz, 1H), 7.26 (t,J= 4.0 Hz, 1H), 7.23 (s, 1H), 7.19 (d,J= 8.0 Hz, 1H) , 2.43 (s, 3H), 2.31 (s, 3H);13C NMR (100 MHz, CDCl3)δ202.3, 165.1, 159.0, 150.9, 148.5, 138.9, 138.6, 135.4, 131.3, 129.6, 129.3, 129.1, 128.7, 125.7, 125.4, 123.5, 117.8, 117.7, 113.8, 105.0, 32.2, 21.5。 HRMS (ESI) calcd for C22H17O4[M+H]+: 345.112 1, found: 2 345.112 2。
3f, 8-acetyl-7-hydroxy-9-(m-tolyl)-6H-benzo[c]chromen-6-one
淡黄色固体, 产量 27.2 mg, 收率 40%, 反应时间 72 h, 柱层析 (石油醚:乙酸乙酯 = 25∶1~20∶1), 熔点 193.1~193.9 ℃;1H NMR (300 MHz, CDCl3)δ11.78 (s, 1H), 8.04 (d,J= 8.0 Hz, 1H), 7.55 (s, 1H), 7.54~7.52 (m, 1H), 7.38 (d,J= 8.0 Hz, 2H), 7.34 (d,J= 8.0 Hz, 1H), 7.28 (s, 1H), 7.24 (s, 1H), 7.20 (d,J= 8.0 Hz, 1H), 2.44 (s, 3H), 2.32 (s, 3H);13C NMR (75 MHz, CDCl3)δ202.3, 165.1, 158.9, 150.8, 148.4, 138.8, 138.6, 135.3, 131.2, 129.6, 129.2, 129.1, 128.6, 125.6, 125.3, 123.5, 117.8, 117.6, 113.8, 104.9, 32.2, 21.4。 HRMS (ESI) calcd for C22H17O4[M+H]+: 345.112 1, found: 2 345.111 7。
3 结论
以4-羟基-6-甲基-2-吡喃酮与邻羟基查尔酮为底物,通过一步反应高效构建多个环,简便地合成了氢化异香豆素骨架化合物。该反应具有操作过程简单、反应条件温和、无贵金属参与等优点,是对以往报道的[2+2+2]芳环化或[4+2]芳环化构建芳香化合物的策略的补充,为更多芳香化合物的合成提供了可能。
