毛兰素的提取分离、化学合成和生物活性的研究进展
2021-07-21蒋松伟黄昌港叶向阳
高 园,蒋松伟,戚 香,黄昌港,惠 子*,叶向阳,谢 恬, *
1.广东药科大学附属第一医院(广东药科大学临床医学院),广东 广州 510080
2.杭州师范大学 医学部药学院,浙江省榄香烯类抗癌中药重点实验室,浙产中药材资源开发与应用浙江省工程实验室,浙江省浙八味等浙产中药材综合利用开发2011协同创新中心,浙江 杭州 311121
毛兰素最早是从兰科的足茎毛兰中提取分离得到的,故此而得名[1]。后来发现毛兰素广泛存在于各种石斛品种中。毛兰素的分子式C18H22O5,相对分子质量318.364 3,化学名2-甲氧基-5-[2-(3,4,5-三甲氧基-苯基)-乙基]-苯酚[2],化学结构见图1。从化学结构上看,毛兰素是2个多取代苯环通过2个饱和碳原子连接起来。这2个多取代苯环含有多个甲氧基和1个酚羟基取代基。纯品毛兰素为无色晶体,密度1.147 g/cm3,沸点439.1 ℃,闪点219.4 ℃,mp 78.5~79 ℃,遇光易变色,应密封遮光,贮存于干燥、阴凉、通风良好处,若长时间暴露在空气中,含量会有所降低,很可能是多取代酚醚和酚官能团在空气中易被氧化的缘故[3]。毛兰素的多取代酚醚和酚官能团,很可能是毛兰素的生物活性(抗病毒、抗菌、抗炎和抗癌活性)的来源所在。如与毛兰素结构相似的化合物combretastatin A-4(CA-4)也具有显著的抗肿瘤活性。CA-4与毛兰素结构上的微小差异在于毛兰素的2个苄位饱和碳变成了不饱和的烯烃。这种从南非植物南非灌木矮柳树Combretum caffrumEckl.&Zeyh.中分离出来的一种新生血管抑制剂,能抑制肿瘤演进过程中异常血管的形成,从而达到治疗肿瘤的目的,也是一种有前景的抗肿瘤候选药物[4-6]。

图1 毛兰素的化学结构Fig.1 Chemical structure of erianin
关于毛兰素及其衍生物的抗肿瘤活性研究已有文献报道,并有相关的综述[2,7-8]。但所涉及的文献大部分为2015年之前的,尚未有系统总结毛兰素提取和化学合成方法的综述。因此,本文对毛兰素的提取分离和化学合成进行了归纳和总结,并对2016年以来有关毛兰素的文献进行了梳理,主要包括毛兰素生物活性及作用机制方面的新进展,以及在治疗牛皮藓和抗菌、抗炎等方面的应用。本文旨在通过系统的归纳,为今后毛兰素相关领域的深入研究、开发和综合利用(包括药物化学方面的结构修饰及围绕毛兰素的创新药物研究)提供理论基础。
1 提取分离
毛兰素广泛存在于多种石斛中,可直接从石斛中提取分离获得毛兰素。截至目前为止,已发现多种石斛属植物如鼓槌石斛、铁皮石斛、金钗石斛、球花石斛、流苏石斛、球花石斛、长苏石斛、小黄花石斛、大苞鞘石斛、兜唇石斛等,均含有一定量的毛兰素。首先要对石斛中的毛兰素进行定性定量检测,罗阳等[9]建立了一种检测石斛中7种化学成分的反相高效液相色谱-紫外光谱法(RP-HPLCUV),用此方法检测出21种石斛中有11个品种含有毛兰素,其中鼓槌石斛中的毛兰素高达0.120 3%,显著高于其他品种。母多等[10-11]研究了6个石斛品种的HPLC指纹图谱,经与毛兰素对照品对照,确认这6个石斛品种均含有毛兰素。此方法可用于对毛兰素进行定性分析,也证实了在6种被测定的石斛品种中鼓槌石斛中含有最多的毛兰素(0.135 1%)。张聪[12]建立一种液相色谱-串联质谱(LC-MS/MS)法对12种石斛进行定性定量检测,只发现鼓槌石斛、金钗石斛、流苏石斛这3种石斛里含有毛兰素,依次含有0.16%、0.06%、0.04%。张聪[12]测定的鼓槌石斛中毛兰素的含量略高于罗阳等[8]和母多等[10-11]的检测结果,这可能是由于鼓槌石斛产地不同的原因。
Liu等[13]报道了一种可筛选和测定石斛中酚类物质的超高效液相色谱-微型质量检测器,可同时测定12种酚类物质,包括双苄基、菲和氟酮等亚型。其中双苄基化合物含量最高,而双苄基化合物的典型代表则为毛兰素。通过建立毛兰素标准溶液浓度与峰面积之间的关系,可对毛兰素进行定量分析。Li等[14]采用RP-HPLC对铁皮石斛中提取的毛兰素进行定性和定量,通过对各种提取方法的检测和比对,提出了快速有效的提取铁皮石斛中毛兰素的工艺流程。
从以上研究可以看出毛兰素广泛存在于多种石斛中,可直接从石斛中提取分离获得纯品毛兰素。这是最初获得毛兰素的途径。用该途径获得毛兰素所需要解决的关键问题是如何比较高效地提取,且得到质量分数高的纯品。肖志勇等[15]报道了一种从铁皮石斛中提取高纯度毛兰素的方法:将新鲜铁皮石斛洗净加水搅碎成石斛汁,接着按体积比1∶4.5加入石油醚进行多次萃取,合并石油醚层,浓缩成膏状,再经硅胶柱色谱进行梯度洗脱分离,得粗品;最后将粗品用二氯甲烷溶解后,进行重结晶3~5次,即得毛兰素白色结晶粉末,质量分数约为98%,收率在1.8%以上。该法为以毛兰素为主要成分的抗肿瘤药物的研究和制备提供了物质基础。
与肖志勇等[15]经过石斛汁这个工艺略不同,雷世英[16]的工艺则是将石斛原料烘干、粉碎、再从石斛粉末中提取毛兰素。方法为将新鲜的铁皮石斛烘干并粉碎,用有机溶剂萃取,并浓缩至干;接着经2~3次硅胶柱色谱分离;最后将含有毛兰素的组分浓缩后进行重结晶,得到质量分数在95%以上的纯品毛兰素,该工艺未报道具体的收率。
上述2种提取法原理大体相同,前一种用石斛汁,后一种从烘干粉碎后的原材料溶剂提取。所经过的工艺包括萃取、浓缩、硅胶柱色谱分离、重结晶等步骤,并需要多次重复,才能得到纯品毛兰素。从结果来看前一种提取方法可以得到较高质量分数的毛兰素。
2 化学合成
由于毛兰素在石斛中的含量相对较低,且石斛生长条件较为苛刻,不少石斛品种如野生的铁皮石斛是国家重点二级保护的珍稀濒危植物,禁止采挖,因此寻求化学合成方法来替代或互补天然植物提取法是非常必要的。化学合成法可以避免石斛属植物过度开采而导致的个别宝贵种属灭绝,从某种意义上保护了生态环境。本文对毛兰素的化学合成法进行了归纳总结,并比较各方法的优缺点,旨在为毛兰素的结构改造提供新的思路。
2.1 经炔烃中间体合成
Petrov等[17]以廉价的愈创木酚(1)和3,4,5-三甲氧基苯甲酸(3)为原料制备毛兰素(图2)。先用氯乙酰氯保护原料1的羟基。所得的化合物2和化合物3进行傅克酰基化反应得到化合物4。在碱性条件下脱去酚保护基团上的氯乙酰基,并与叔丁基二甲基氯硅烷(TBDMSCl)进行反应得到化合物6。化合物6与三甲基硅重氮甲烷(TMSCHN2)经过Colvin重排反应直接转化为炔烃7,再通过四丁基氟化铵(TBAF)脱去羟基保护基得到化合物8。最后催化氢化还原得到毛兰素。该路线总收率为38.07%。在这条路线中,Colvin重排反应是本合成法的关键。具体步骤见图2。
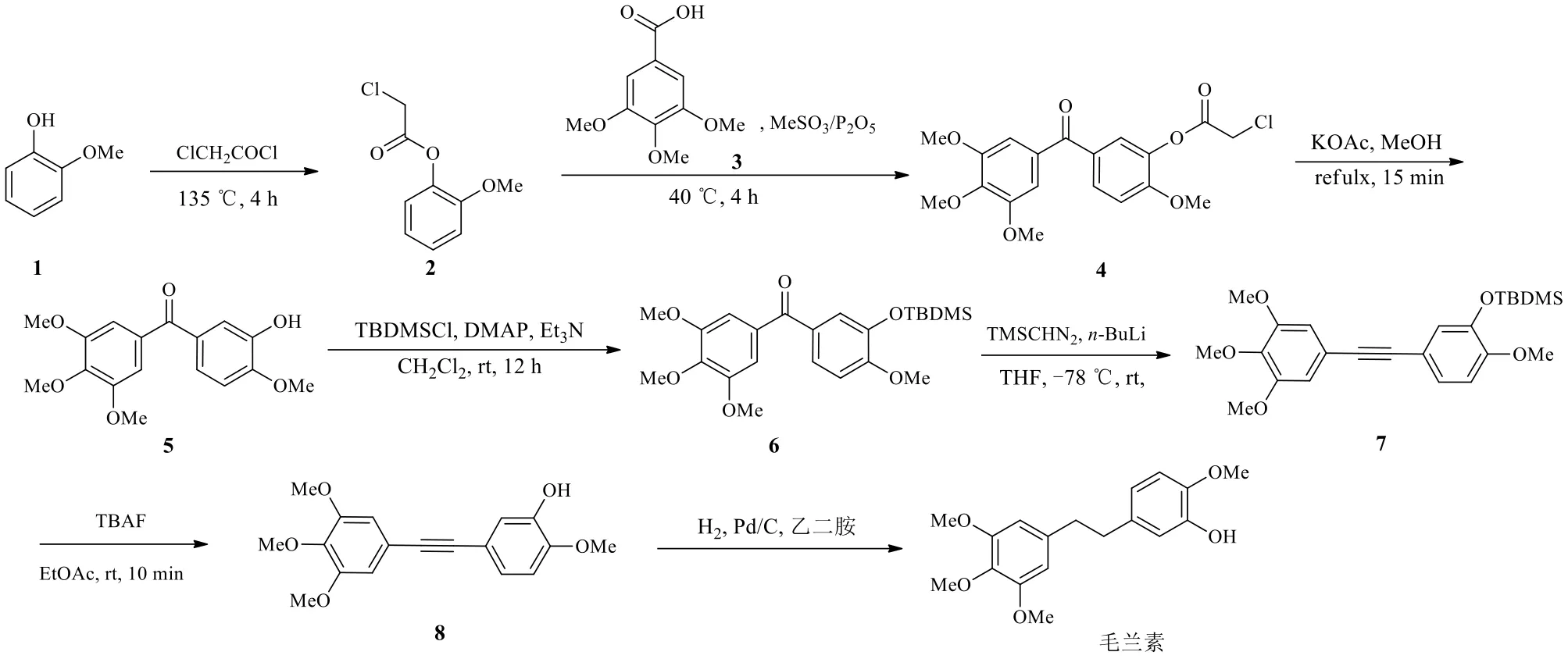
图2 经炔中间体合成毛兰素的路线Fig.2 Synthetic route of erianin via alkyne intermediate
2.2 经烯烃中间体合成(Wittig反应法)
2007年李亦平等[18]报道了以3,4,5-三甲氧基苯甲醛(9)和3-羟基-4-甲氧基苯甲醛(13)为原料制备毛兰素(图3)。从2个方向进行,一方面先用硼氢化钠(NaBH4)将化合物9还原为苯甲醇10,再用三溴化磷(PBr3)对化合物10进行溴代反应得3,4,5-三甲氧基苄溴(11),接着和三苯基膦(PPh3)反应得到3,4,5-三甲氧基苄基三苯基膦溴盐(12)。另一方面将化合物13的酚羟基先用苄基保护,得化合物14,再与12进行Wittig反应,得到烯烃15(顺反异构体混合物,比例不确定)。烯烃15在Pd/C催化氢化下双键被还原,同时苄基保护基被脱去,得到毛兰素,路线总收率33.3%,具体方法见图3。
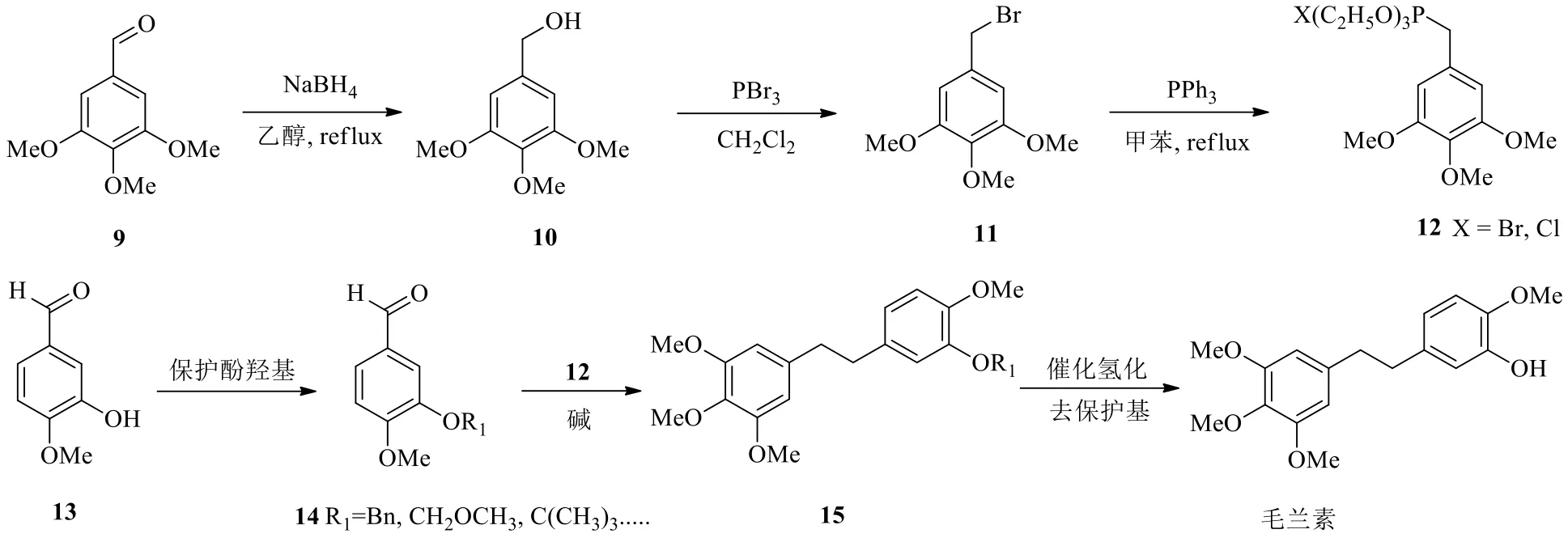
图3 经烯烃中间体合成毛兰素的路线(Wittig反应法)Fig.3 Synthetic route of erianin via alkene intermediate (Wittig reaction)
李亦平等[18]在进行优化实验时,优先选用的卤素为Br,即3,4,5-三甲氧基苄溴,羟基保护基团选用苄基、四氢吡喃基、乙酰基、叔丁基等。当然还有不少基团可用作酚羟基的保护基,由于苄基脱保护方便,且可以和最后一步的催化氢化同时完成,故李亦平等[18]的发明中优选为苄基。此外Wittig反应中所用的碱也有多种选择,李亦平等[18]采用叔丁醇钾替代正丁基锂,更便宜更安全,且操作简便。这条合成路线化学原料简便易得,所用试剂也较便宜,适宜工业规模生产。这条路线使用比较广泛,吴范宏等[19]、陈雨文[6]、Ma等[20]、Marset等[21]、Lam等[22]都相继报道过毛兰素或毛兰素类似物的合成方法,所涉及的路线和图2大体相同,都是用取代的苄基三苯基膦溴化物[23]和取代苯甲醛进行Wittig反应,形成毛兰素的关键二苯乙烯母核结构。区别之处往往是在原料的选择、羟基保护基团的选择、苄基三苯基膦卤代物的选择以及Wittig反应所用的碱的选择。如陈雨文[6]的路线采用的是叔丁醇钾做Wittig反应的碱,最后一步还原时用了5% Pd/C。Lam等[22]采用氯甲基甲醚来保护羟基,同时用苄基三苯基膦氯化物替代溴化物,最后用1 mol/L盐酸回流1 h脱去甲氧基甲醚。Zhao等[24]也报道了毛兰素类似物的合成方法,并合成了一些类似物,如羟基旁的甲氧基换成了乙氧基,并探讨了其生物活性。
2.3 经烯烃中间体合成(羟醛缩合法)
Zou等[25]采用羟醛缩合的方法构建双键,与Wittig反应法有所不同(图4)。首先用单质溴在化合物16的芳香环进行溴代,在甲氧基的邻位引入溴得到化合物17。将化合物17和化合物9在三乙胺的作用下羟醛缩合并脱水,得烯烃化合物18,再通过亲核取代反应用羟基取代溴,随后羧酸在喹啉(quinoline)、硫酸铜(CuSO4)的作用下发生脱羧反应,最后催化氢化将双键还原,得到毛兰素,该路线总收率为30.8%。
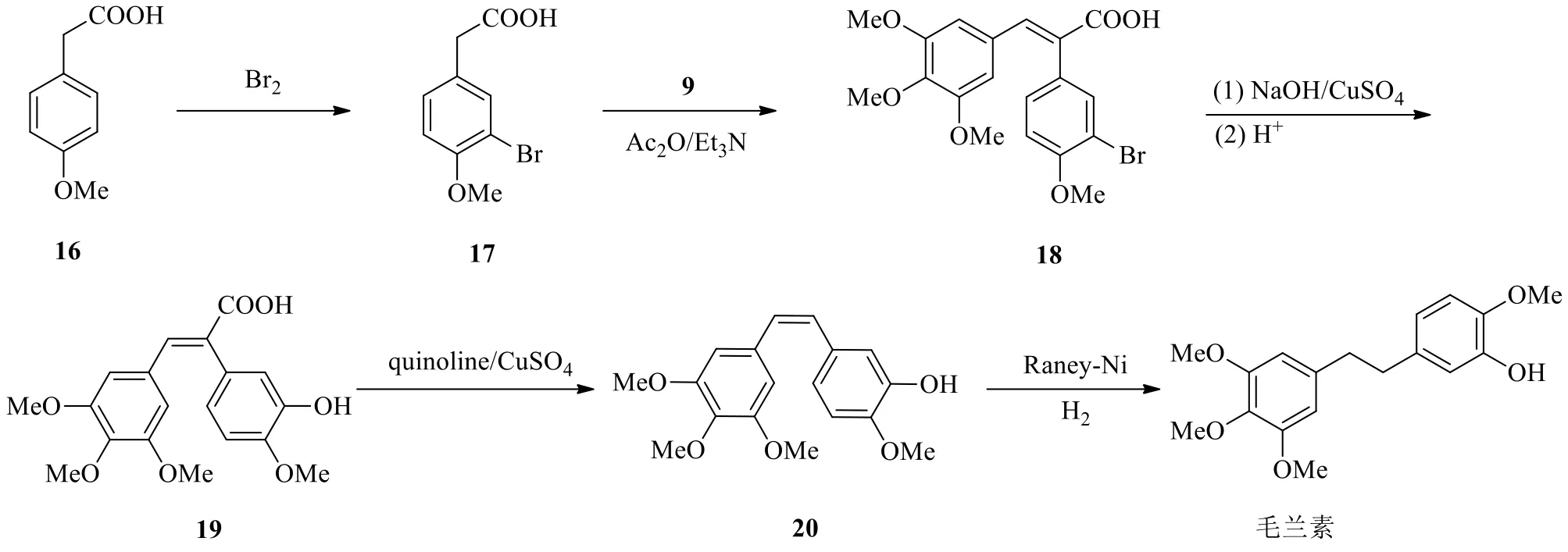
图4 经烯烃中间体合成毛兰素的路线(羟醛缩合法)Fig.4 Synthetic route of erianin via alkene (aldol condensation)
2.4 经烯烃中间体合成(砜类法)
Wang等[26]报道了不同于上面2种方法的砜类合成法(图5)。其关键就是经过硫醚氧化为砜,进而重排构筑碳-碳双键。苄醇21(从相应的取代醛如化合物9和14还原得到)既可以经光延反应(Mitsunobu反应)和硫代乙酸转化为乙酸硫酯22,也可以与三溴化磷反应得到苄溴23。乙酸硫酯22和苄溴23在氢氧化钾(KOH)作用下发生了硫酯水解和烷基化反应,一锅生成不对称硫醚24。硫醚24经oxone氧化得二苄基砜类化合物25。二苄基砜在KOH、Al2O3和CF2Br2条件下反应,得到以反式双键为主的异构体多取代二苯乙烯26(>95%)。最后在Pd/C催化氢化下得到毛兰素及类似物27,未报道总收率。

图5 经烯烃中间体合成毛兰素的路线(砜类法)Fig.5 Synthetic route of erianin via alkene (sulfone method)
Robinson等[27]报道的合成方法与上述的合成方法相类似,但有2处不同:一是羟基保护基从苄基变为叔丁基二甲基硅烷(TBDMS),相应脱保护方法也有相应改变;二是二苄基砜类变为二苯乙烯类化合物的条件不同。Robinson等[27]采用C2F4Br2、t-BuOH、KOH-Al2O3,加热下反应12 h,这一步收率从原先47%升至89%(构型比E∶Z为97∶3)。
3 生物活性
铁皮石斛作为传统中药,具有清热、解毒和镇痛的功效,常用作解热剂和镇痛剂。作为铁皮石斛主要成分之一的毛兰素具有多种药理作用,包括抗氧化、抑制血管生成及肿瘤生长等,这在李震等[7]的文献中已经有总结。近年来有关毛兰素的生物活性和药理作用机制又有新的发现,除了抗肿瘤方面的独特性外,文献还报道了毛兰素在对牛皮藓的治疗、抗菌、抗炎等方面也能发挥重要作用。本文对毛兰素这些新的生物活性和作用机制进行归纳总结。
3.1 抗肿瘤及作用机制
毛兰素作为一种广谱的抗肿瘤化合物,对多种肿瘤细胞均有抑制作用。近期研究结果显示,毛兰素在体外细胞毒性实验中,对结肠癌Caco-2细胞[28]、人骨肉瘤143B和MG63.2细胞[29]、人宫颈癌HeLa细胞[30]、人肺癌549细胞[31]、人膀胱癌EJ和T24细胞[32]、人结肠癌HCT-116和SW620细胞[33]、人乳腺癌T47D细胞[34]、肺癌2LL-IDO细胞[35]、肺癌H460和H1299细胞[36]、多种肝癌细胞[37-38]、鼻咽癌NPC-039和NPC-BM细胞[39]、多种口腔癌细胞[40]均显示出了明显的抑制作用,其半数抑制浓度(50%concentration of inhibition,IC50)见表1。近年来对于毛兰素的作用机制已有大量研究,结果表明毛兰素具有多种抗瘤作用机制。主要包括抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、抑制肿瘤血管生成和诱导肿瘤自噬。
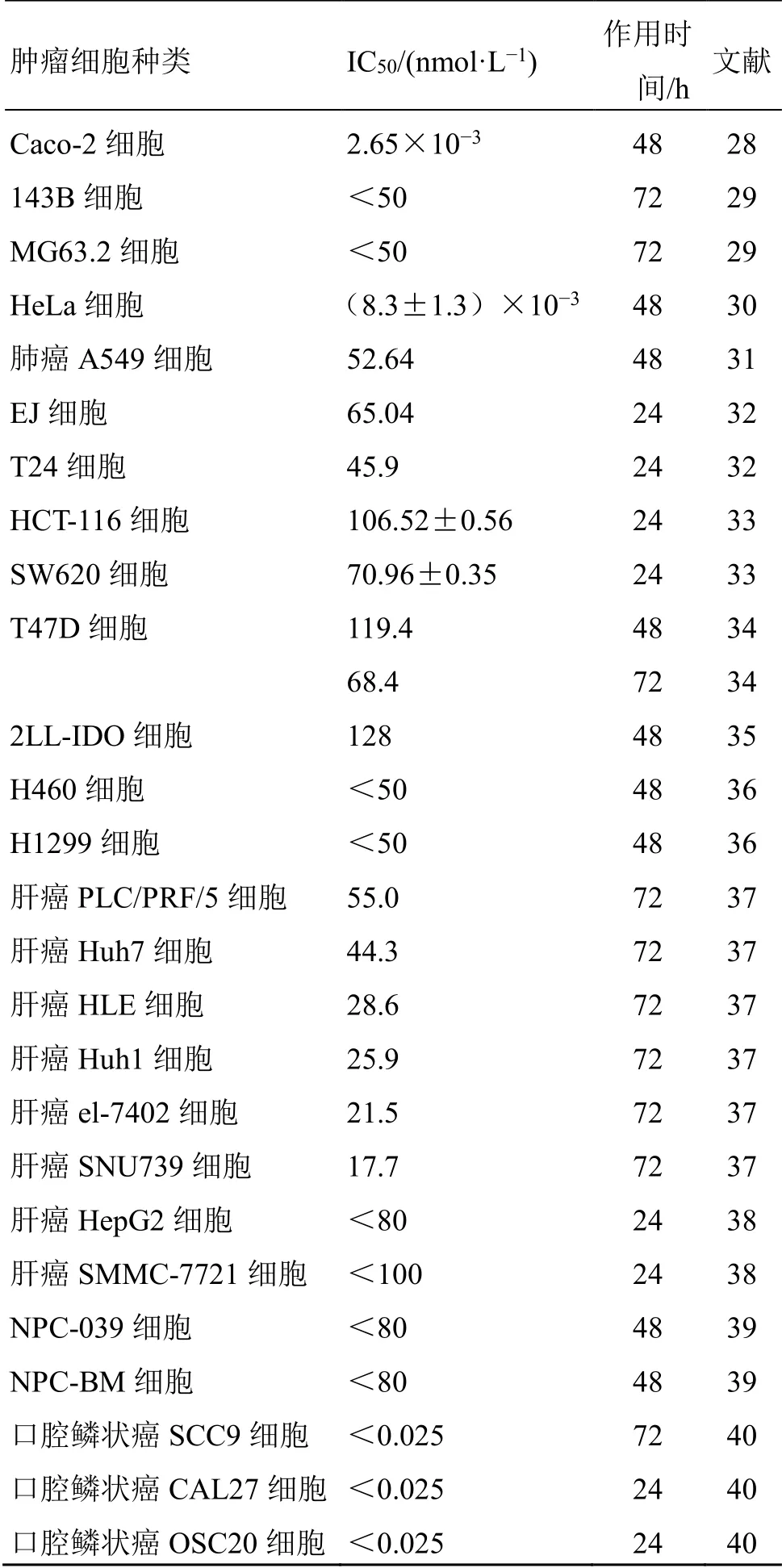
表1 毛兰素对不同肿瘤细胞增殖的抑制作用Table 1 Inhibitory effects of erianin on proliferation of different tumor cells
癌症即恶性肿瘤,它是100多种相关疾病的统称。当身体内细胞发生突变后,它会不断地分裂,不受身体控制,最后形成癌症。人们身体内所有器官都是由细胞组成。细胞增长和分化可满足身体需要,这种有序的过程可保持人们身体健康。然而,如果细胞继续分裂,这些额外的大量细胞就形成肿瘤。恶性肿瘤的细胞能侵犯、破坏邻近的组织和器官[41]。毛兰素在体外能够有效抑制多种肿瘤细胞株的增殖,充分表明毛兰素及其类似物具有治疗各种癌症的潜能。如何降低毛兰素的毒性并保留其有效的抑制肿瘤细胞的增殖,一个主要的研究方向是对毛兰素进行结构修饰和类似物的合成,研究构效关系,这也是药物化学家们一直在从事的研究领域。
3.1.1 阻滞细胞周期,抑制增殖 细胞周期是指细胞从一次分裂完成开始到下一次分裂结束所经历的全过程,包括分裂间期和分裂期。这个过程受到许多调控因子和调控蛋白的影响。若能干扰其中任一环节都将导致细胞停止分裂而阻止细胞增殖。崔名扬等[28]研究表明毛兰素诱导细胞内线粒体膜电位的改变及阻滞细胞于G2期。从而对Caco-2细胞的增殖具有一定抑制作用,且可通过线粒体途径诱导Caco-2细胞发生凋亡。Li等[30]研究了毛兰素和阳性对照物紫杉醇对HeLa细胞内的多个蛋白表达量的影响,阐述了毛兰素通过细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK1/2)信号转导和线粒体途径将细胞周期阻滞于G2/M期,从而抑制细胞生长和导致细胞凋亡。进而推测毛兰素具有治疗宫颈癌的潜能。Zhu等[32]研究表明毛兰素可通过调控细胞周期蛋白的表达将EJ和T24细胞阻滞在细胞分裂周期的G2/M期,此外毛兰素还可以通过启动c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)通路,下调B淋巴细胞瘤-2基因(Bcell lymphoma-2,Bcl-2)的表达,诱导细胞色素C释放,改变线粒体膜电位来诱导线粒体介导的凋亡途径,致使膀胱癌细胞凋亡,而且毛兰素对正常膀胱细胞无此作用。毛兰素对患膀胱癌(EJ细胞)裸鼠的肿瘤生长抑制率为65%;Dong等[37]研究表明毛兰素导致不可修复的DNA损伤,诱导G2/M期阻滞及异常有丝分裂,最终导致肝癌细胞凋亡。毛兰素处理后,有丝分裂细胞异常增多,表明有丝分裂突变导致毛兰素诱导的细胞死亡。体内实验表明,毛兰素能有效抑制肝癌的生长,并且对体内其他正常器官毒性较小。
3.1.2 促进癌细胞凋亡效应 细胞凋亡效应在癌症治疗中起着重要作用 其中大多数癌症治疗药物是通过激活凋亡因子或凋亡蛋白来发挥作用,使癌细胞凋亡,达到治疗癌症的作用。邓同兴等[31]研究表明毛兰素抑制超氧化物歧化酶活性,下调核因子E2相关因子2、醌氧化还原酶1和血红素氧合酶-1表达,继而导致ROS含量升高和p38丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路的启动,进而诱导A549细胞的凋亡;Tang等[33]研究表明毛兰素通过启动JNK信号通路,诱导细胞阻滞和凋亡,从而抑制SW620细胞的增殖,提供了治疗结肠癌潜在可能性;Chen等[36]通过体内、体外研究首次证实毛兰素可以通过诱导肺癌细胞死亡和抑制肺癌细胞迁移而呈现高效、低毒的抗癌活性。进一步研究显示,诱导钙离子依赖性铁死亡是毛兰素发挥抗肿瘤作用的关键分子机制。研究首次报导毛兰素是一种新的铁死亡诱导剂,并首次证实Ca2+/钙调蛋白信号通路信号通路是其诱导肺癌细胞铁死亡关键靶点;Zhang等[38]研究表明毛兰素可通过调节氧化应激介导的线粒体凋亡和免疫反应,从而发挥其抗HepG2和SMMC-7721细胞活性,并且在体内实验能明显抑制移植HepG2细胞小鼠肿瘤的生长,对正常组织毒性较小;Liu等[39]首次对毛兰素在鼻咽癌上的活性进行研究,毛兰素通过线粒体膜交替、死亡受体激活和含半胱氨酸的天冬氨酸蛋白水解酶(csyteine aspartic acic specific protease,Caspase)-3、8、9激活,显著提高NPC-039和NPC-bm的凋亡激活,并明显抑制细胞周期。磷酸化ERK1/2在毛兰素处理的鼻咽癌细胞中也呈剂量相关性下降,可能促进细胞凋亡;Chen等[40]第1次报道了在口腔鳞状癌细胞中毛兰素通过诱导细胞周期阻滞和Caspase依赖性凋亡途径发挥细胞毒性作用。内源性和外源性途径都被发现参与了毛兰素介导的细胞死亡。此外,毛兰素处理也增加了口腔鳞状癌OSCC细胞的自噬。进一步分析发现,毛兰素通过调控MAPK信号通路诱导细胞凋亡和自噬。查桂平等[42]研究表明毛兰素能够有效抑制葡萄膜黑色素瘤C918、MUM-2B细胞的增殖,阻滞细胞周期,促进葡萄膜黑色素瘤细胞凋亡,且其作用效果在一定范围内呈现出剂量相关性,其作用机制与上调p21表达,抑制p38 MAPK表达有关,后者可削弱MAPK信号通路活化,并可活化细胞凋亡途径中关键蛋白Caspase-3从而诱导凋亡;Sun等[43]研究表明毛兰素可通过抑制基质金属蛋白酶及其抑制因子的表达来抑制T47D细胞迁移;毛兰素还可下调Bcl-2基因的表达,从而诱导乳腺癌细胞凋亡;此外,毛兰素可下调周期蛋白依赖性激酶1、2、4、7、8、9、10的表达,致使乳腺癌细胞阻滞在G2/M期。
3.1.3 通过自噬抑制肿瘤细胞生长 细胞自噬与细胞凋亡、细胞衰老一样,是十分重要的生物学现象,参与生物的发育、生长等多种过程。因此引发癌细胞自噬可成为一种新的抗癌疗法。Wang等[29]研究表明毛兰素可通过增加微管相关蛋白轻链3B(microtubule-associatedprotein light chain 3 B,LC3B)II蛋白,上调p62和Beclin-1的表达致使人骨肉瘤细胞自噬。且毛兰素显著诱导G2/M细胞周期阻滞,通过ROS/JNK信号通路调控细胞凋亡和自噬。同时在胫骨内注射143B细胞建立原位人骨肉瘤小鼠模型,ip给药8 d,2 mg/(kg·d),对照组每隔1天ip 5%二甲基亚砜,8 d后发现肿瘤体积明显比对照组较小,实验小鼠的体质量没有明显下降,也证明了在没有明显毒性的情况下,毛兰素可以显著降低移植瘤小鼠的肿瘤生长。Chen等[40]研究发现毛兰素显著提高了人舌鳞状癌SAS和SCC9细胞中LC3-I和LC3-II的表达,降低了P62的表达。结果表明,毛兰素能够诱导OSCC细胞自噬。
3.1.4 抑制肿瘤细胞血管生成 肿瘤形成机制复杂多样。肿瘤生长速度快,早期诊断困难,无有效治疗措施,预后差,死亡率高。血管生成是肿瘤细胞获得充足的血液供应和营养以维持其生长的机制之一[44]。毛兰素通过抑制肿瘤血管生成而发挥其抗肿瘤作用,Su等[45]研究认为毛兰素通过靶向调控酪氨酸激酶2/信号转导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)途径及其下游基因基质金属蛋白酶-2、9,调控吲哚胺2,3-双加氧酶诱导的肿瘤细胞血管生成拟态和内皮细胞依赖的血管生成,下调炎症因子的表达,从而抑制肺癌细胞的血管生成。
3.2 其他
3.2.1 抗细菌感染和抗炎作用 在对毛兰素的近期研究中发现,毛兰素具有抗细菌感染的活性。袁中伟等[46]研究表明毛兰素对金黄色葡萄球菌的体外最小抑菌质量浓度为512 μg/mL,最小杀菌质量浓度大于1024 μg/mL,且毛兰素可缓解金黄色葡萄球菌引发的腹膜炎。毛兰素使通过结合分选酶A的活性中心来影响结合分选酶A的生物活性,且毛兰素在体外金黄色葡萄球菌引起的腹膜炎有良好的缓解作用,可减轻金黄色葡萄球菌所导致的小鼠脓肿症状。Ouyang等[47]研究表明毛兰素通过阻止表面蛋白的T-G肽链和脂质II进入和结合到生物活性中心,从而抑制革兰阳性菌中的转肽酶结合分选酶A的结合,达到抗金黄色葡萄球菌感染的目的,毛兰素对金黄色葡萄球菌的IC50值为(65.7±7.2)μmol/L。毛兰素与结合分选酶A残基Ile182、Val193、Trp194、Arg197和Ile199结合,通过疏水相互作用形成稳定的键。此外,与金黄色葡萄球菌共培养时,毛兰素抑制了金黄色葡萄球菌与纤维连接蛋白的结合活性和生物膜的形成。在体内实验时,经尾静脉注射的毛兰素可提高感染金黄色葡萄球菌小鼠的存活率。研究毛兰素对溃疡性结肠炎小鼠抗炎作用发现给药3周可使溃疡性结肠炎小鼠体质量和结肠长度增加,并且肝、脾、肾各脏器指标及病理观察证实,毛兰素无细胞毒作用,具有改善免疫器官功能的作用。蛋白质组学分析和酶联免疫吸附实验表明,毛兰素可调节血清和结肠组织中炎症和氧化应激相关因子和免疫趋化因子的水平,从而减少细胞过氧化损伤和减轻免疫炎症反应。Western blotting进一步证实,毛兰素抗溃疡性结肠炎是通过抑制Toll样受体4和STAT3信号通路介导的[48-49]。
此外,人们还报道了毛兰素具有抗炎作用。Zhang等[50]研究表明,在糖尿病性视网膜病变发展过程中,毛兰素通过减少细胞葡萄糖摄取和消除下游ERK1/2-核因子κB通路的后续启动,抑制小胶质细胞引发的视网膜炎症,毛兰素还能减轻活化的小胶质细胞释放的肿瘤坏死因子-α引起的血-视网膜屏障损伤。从而达到治疗糖尿病性视网膜病变。
3.2.2 抗病毒作用 Meng等[51]研究表明毛兰素可通过诱导G2/M期阻滞而抑制人肠道EVD68病毒的产生,毛兰素对感染人肠道病毒RD细胞的IC50为22.75 nmol/L,流式细胞仪显示毛兰素处理后和对照组相比,G2/M期细胞的比例从原来的(35.23±1.40)%增加到(96.94±1.01)%,并且经形态学分析发现毛兰素对EVD68感染诱导的细胞损伤具有保护作用。毛兰素能够起到抗EVD68病毒的作用,成为治疗人肠道病毒的潜在药物。
3.2.3 抑制视网膜内血管生成作用 Yu等[52]发现毛兰素可通过抑制高糖诱导的视网膜新生血管的生成来治疗高糖诱导的视网膜内皮细胞病变。研究表明毛兰素可通过抑制ERK1/2调控缺氧诱导因子1α、血管内皮细胞生长因子、血管内皮细胞生长因子受体2信号通路,减少ERK1/2、丝裂原活化细胞外信号调节激酶1/2和原癌基因丝氨酸/苏氨酸蛋白激酶cRaf的磷酸化活性来减轻高糖诱导的视网膜内皮RF-6A细胞的病变程度,且毛兰素对正常的视网膜BV2细胞没有此作用。
3.2.4 抗牛皮藓作用 Mo等[53]发现毛兰素对人永生化角质形成HaCaT细胞具有增殖抑制作用并可诱导其凋亡。研究表明毛兰素通过ROS的产生增加了JNK/c-Jun的表达,抑制了蛋白激酶B、丝/苏氨酸激酶信号通路;此外,毛兰素还能促进凋亡相关蛋白Caspase-3和聚(ADP-核糖)聚合酶的表达,最终抑制HaCaT细胞的增殖和诱导其凋亡,而ROS抑制剂能逆转这种作用。毛兰素对HaCaT细胞的作用使其可能成为潜在的抗牛皮癣药物。
4 结语
石斛属植物已经被制成多种中药产品和保健品,是我国中药瑰宝之一。石斛中存在的众多天然产物中,毛兰素是生物活性最为突出和广泛的一种,且被研究最多。除了已经报道的体内、外对各种肿瘤细胞增殖的抑制作用外,毛兰素的生物活性范围还在不断地被拓展。如近年来人们发现了毛兰素对治疗牛皮藓和抗菌等方面有着潜在的功效。这些新发现归功于科学家们对毛兰素研究的不断深入。从药物研发的角度来看,毛兰素是单一的分子实体。现有毛兰素的研究成果显示它很可能是潜在的临床候选药物或药物研发的先导化合物。今后对毛兰素的研究工作可能要转入对毛兰素的药动学、成药性、毒理学评价等领域,以及对毛兰素药物化学的优化。本文对近年来有关毛兰素提取分离、化学合成及生物活性等的研究成果进行归纳和总结,旨在为毛兰素药物研发工作的进一步推进打下基础,也可以激发新思路。这方面的深入研究有助于我国名贵中药材的开发及利用,并进一步推动中药的现代化进程。
利益冲突所有作者均声明不存在利益冲突
